敲除Fto基因对糖尿病小鼠主动脉平滑肌收缩及钙调控异常的作用研究*
2024-03-07郑燕湘蔡泳江王梓帆邝素娟邓春玉
郑燕湘, 蔡泳江, 王梓帆, 邝素娟, 杨 慧, 饶 芳, 邓春玉,3△
[1华南理工大学医学院,广东 广州 510006;2南方医科大学附属广东省人民医院(广东省医学科学院),广东 广州 510080;3南方医科大学药学院,广东 广州 510515]
糖尿病(diabetes mellitus, DM)是以高血糖为典型特征的慢性代谢性疾病。血管长期浸润在高血糖环境中会引发不同程度的损伤,如内皮功能障碍、氧化应激增强等,进而导致血管病变[1]。血管的收缩主要依赖于血管平滑肌细胞(vascular smooth muscle cells, VSMCs)内钙离子浓度(intracellular calcium concentration, [Ca2+]i)变化,[Ca2+]i在高糖环境下紊乱。血管功能异常与脂肪质量和肥胖相关基因(fat mass and obesity-associated gene,Fto)的异常表达有着密切的联系。在肥胖小鼠和肥胖人群的血管组织中,动脉肌原性收缩和血管阻力增加,伴有FTO蛋白表达水平升高[2]。FTO能以m6A依赖的方式调节众多底物的稳定性,还可与钙调蛋白(calmodulin,CaM)直接发生相互作用,介导钙信号通路,从而广泛调控各项生命活动[3]。但FTO是否通过参与VSMCs的钙调控,影响DM小鼠的血管收缩功能及其分子机制目前尚无相关报道。本项工作拟以离体小鼠主动脉血管环为研究对象,观察敲除Fto后血管环的收缩反应差异,初步阐明其对血管平滑肌收缩钙调控的作用。
材料和方法
1 动物
SPF级的6周龄C57BL/6野生型(wild-type, WT)雄性小鼠30只和平滑肌特异性Fto基因敲除(smooth muscle-specificFtogene knockout,FtoSMKO)雄性小鼠15只,体重为20~22 g,购于广东集萃药康生物科技有限公司,许可证号为SYXK(粤)2021-0265,饲养在华南理工大学实验动物中心SPF级屏障内。动物实验已获得南方医科大学附属广东省人民医院(广东省医学科学院)伦理委员会批准(KY-Z-2021-581-01)。
2 主要试剂和仪器
2.1 实验试剂 链脲佐菌素(streptozotocin, STZ)、苯肾上腺素(phenylephrine, Phe)、硝苯地平(nifedipine)、咖啡因(caffeine)、乙酰胆碱(acetylcholine,ACh)和毒胡萝卜素(thapsigargin, TG)均购自Sigma-Aldrich;抗β-actin鼠多克隆抗体(81115-1-RR)和抗FTO兔多克隆抗体(27226-1-AP)购自Proteintech;其余化学试剂均为国产分析纯。
2.2 实验溶液 Krebs-Henseleit (K-H)溶液(mmol/L):NaCl 119, NaHCO325, MgCl2·6H2O 1, KCl 4.7,KH2PO41.2, CaCl22.5, D-glucose 11.1;高钾K-H溶液(mmol/L):KCl 60, NaCl 63.7,其余组分与K-H溶液一致;无钙K-H溶液(mmol/L):在K-H溶液的基础上添加EGTA 0.05,且不添加CaCl2。上述溶液配好后均通混合气(95% O2+5% CO2)充分饱和。咖啡因溶液:精密称取0.194 2 g咖啡因粉末溶解于50 mL的无钙K-H溶液中制得20 mmol/L的咖啡因溶液,采用倍半稀释法用无钙K-H溶液稀释成10 mmol/L和5 mmol/L的咖啡因溶液。
2.3 实验仪器 620M型多通道血管张力测定仪(DMT);Pro2Go便携pH计(METTLER TOLEDO);LAS500超灵敏化学发光成像仪(GE);Advatage 血糖仪和血糖试纸(Roche);蛋白电泳仪和转膜仪(北京市六一仪器厂);Power Lab 8/30生物信号采集处理系统(AD)。
3 主要实验方法
3.1FtoSMKO小鼠的制备及鉴定 委托生物公司通过Cre-loxP重组技术,平滑肌特异性SM22α-CreKI+小鼠与Ftofl/fl小鼠杂交,得到平滑肌细胞中Fto特异性完全缺失的FtoSMKO小鼠,C57BL/6小鼠(WT)为对照小鼠。Western blot检测WT小鼠和FtoSMKO小鼠主动脉FTO蛋白的表达水平,验证平滑肌Fto敲除鼠制备是否成功。
3.2 DM小鼠模型的建立及鉴定 将从公司购买的30只C57BL/6小鼠随机分组为DM组和WT组,又将15只FtoSMKO小鼠作为实验组(FtoSMKO-DM组)。连续5 d对DM组小鼠和FtoSMKO-DM组小鼠腹腔注射50 mg/kg STZ,WT组小鼠注射等体积的溶媒(0.1 mol/L柠檬酸-柠檬酸钠缓冲液,pH 4.2~4.5)。造模前12 h禁食不禁水,并在给药后再禁食2 h。造模后每2周通过尾静脉采血,用血糖试纸检测小鼠的血糖水平变化,空腹血糖高于13.8 mmol/L视为造模成功。
3.3 小鼠离体主动脉环的制备 主动脉环的制备方法参考前期同实验室发表的文献[4-5],颈椎脱臼处死小鼠后,用眼科剪沿着小鼠脊柱将胸主动脉分离,置于预冷的K-H溶液中。在体视显微镜辅助下用显微镊和显微剪去除多余的组织后,制成长度约为2 mm的血管环,用机械法去除内皮。血管张力测定仪调零后,将血管环平行套入浴槽两端的钳夹上,然后调节钳夹的松紧进行固定,平衡30 min。给予3 mN基础张力,用高钾K-H溶液刺激血管产生收缩,15 min后用K-H溶液洗脱,待基线平稳后再次用高钾KH溶液刺激,若连续两次高钾K-H溶液刺激血管的收缩峰值差异小于10%,则血管已达到平衡。加入1 μmol/L Phe诱导血管收缩,待张力达最大值并趋于稳定后加入1 μmol/L ACh。若血管舒张程度大于60%,则视为内皮完整;若血管舒张程度在10%以内,则视为内皮去除完全,可进行后续的实验。实验过程中浴槽温度需维持在(37±0.5) ℃,并持续通入含5% CO2的O2。
3.4 实验药物对小鼠主动脉张力的影响
3.4.1 小鼠主动脉平滑肌对血管收缩剂Phe的反应 采用累积浓度给药方法,在K-H溶液中依次用不同浓度的Phe(0.001~10 μmol/L)诱导小鼠的主动脉平滑肌产生收缩,观察3组血管平滑肌对Phe的反应性差异;然后用K-H溶液洗脱至基线,在K-H溶液中加入1 μmol/L硝苯地平孵育30 min,重复Phe累积浓度给药,观察3组血管平滑肌在nifedipine存在的条件下的收缩差异;随后用无钙K-H溶液洗脱至基线,用含1 μmol/L硝苯地平的无钙K-H溶液孵育血管环30 min,重复Phe累积浓度给药,进一步观察在含硝苯地平的无钙K-H溶液的环境下,3组血管平滑肌收缩的变化[4-5]。
3.4.2 小鼠主动脉平滑肌SOCC在血管收缩中的作用 取血管反应性良好且内皮去除完整的血管环进行张力测定,用Phe (1 μmol/L)刺激血管平滑肌收缩达到峰值后,用无钙K-H溶液洗脱至基线平衡,在无钙K-H溶液中加入1 μmol/L硝苯地平和2 μmol/L TG共同孵育30 min,用2.5 mmol/L CaCl2诱导血管产生收缩,观察3组小鼠的血管平滑肌收缩反应[4-5]。
3.4.3 小鼠主动脉平滑肌对咖啡因的反应性变化 在浴槽中直接加入5 mmol/L的咖啡因溶液5 mL刺激血管平滑肌收缩,待血管收缩平稳后,用K-H溶液洗脱4次。平衡30 min后,分别直接加入10 mmol/L和20 mmol/L的咖啡因溶液各5 mL,重复上述操作。观察3组小鼠的血管收缩峰值和达峰时间的变化并统计下降时间常数(τ)的差异[5]。
白音高老组火山岩在TAS图解中落入R区,属流纹岩。SiO2含量较高,介于69.9%~83.2%之间,Al2O3(8.54%~13.7%)含量较高,富碱(K2O+Na2O=5.89%~9.86%)。TiO2含量普遍较低,变化于0. 12%~0.38%之间。属于低钛流纹岩系列(w(TiO2)<0.4%);所有火山岩样品的A/CNK变化于0.96~1.06,为准铝质岩石。σ=0.86~3.21,属钙碱性系列。故白音高老组流纹岩属高硅富碱低钛准铝质钙碱性流纹岩。
3.5 Western blot检测小鼠主动脉FTO的表达水平 取-80 ℃冻存的小鼠主动脉组织置于研磨管中,用眼科剪尽可能剪碎,加入200 μL含蛋白酶抑制剂的RIPA裂解液,用研磨仪进行充分研磨粉碎,4 ℃、13 500×g离心15 min,用BCA试剂盒对上清液的总蛋白定量。加入上样缓冲液和RIPA裂解液制得蛋白样品,金属浴100 ℃加热10 min使蛋白变性。依次进行SDS-PAGE分离,PVDF膜湿转,5%脱脂牛奶溶液封闭、抗体孵育,1∶1配置ECL发光液显影蛋白条带。最后利用ImageJ图像分析软件量化灰度值,分析蛋白的表达水平差异。
4 统计学处理
数据分析参考前期实验室发表的文献[4-5]。计量数据均采用均数±标准误差(mean±SEM)表示。文中n代表实验例数。以连续两次高钾K-H溶液刺激血管收缩峰值的均值作为内参照,各浓度药物刺激血管产生收缩的大小以占内参照的百分率来表示。半数有效浓度(half effective concentration, EC50)是指产生50%最大效应(maximum effect, Emax)时所需激动剂的摩尔浓度,pEC50=-lg(EC50)。pEC50和Emax由GraphPad Prism软件根据量-效关系方程拟合得出。采用SigmaPlot 14.0作图软件拟合收缩曲线。时间常数τ为血管环收缩峰值下降1/e(e为自然对数底数)所需要的时间。数据均使用SPSS 26.0软件进行统计分析,两组间比较采用t检验,3组间比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 DM小鼠主动脉FTO蛋白的表达变化
Western blot检测显示,DM小鼠主动脉FTO蛋白的表达水平较WT小鼠显著升高(P<0.01),见图1。

Figure 1.Changes of FTO protein level in the aortic tissues of diabetes mellitus (DM) mice were detected by Western blot.Mean±SEM.n=4.**P<0.01 vs wild-type (WT) group.图1 糖尿病小鼠主动脉FTO蛋白的表达变化
2 FtoSMKO小鼠的鉴定及DM造模后小鼠的体重和空腹血糖变化
在外观形态上,FtoSMKO小鼠和WT小鼠无明显差异,见图2A。Western blot结果显示,FtoSMKO小鼠主动脉组织FTO蛋白基本不表达(P<0.01),提示平滑肌Fto敲除小鼠制备成功,见图2B。空腹血糖高于13.8 mmol/L视为造模成功,最终成功制备FtoSMKODM小鼠13只,DM小鼠14只。DM组小鼠和FtoSMKODM组小鼠体重较WT小鼠显著降低(P<0.05),空腹血糖显著升高(P<0.01),但两组小鼠之间的体重和空腹血糖水平无显著差异(P>0.05),见图2C、D。

Figure 2.Identification of smooth muscle-specific Fto knockout (FtoSMKO) and changes of body weight and fasting blood glucose level in mice after diabetes mellitus (DM) modeling.A: appearance of WT mouse and FtoSMKO mouse;B: FTO protein level in the aortic tissues detected by Western blot;C: body weight of the mice after DM modeling;D: fasting blood glucose level of the mice after DM modeling.Mean±SEM.n=15 in wild-type (WT) group;n=14 in DM group;n=13 in FtoSMKO-DM group.*P<0.05, **P<0.01 vs WT group.图2 平滑肌Fto特异性敲除小鼠的鉴定及糖尿病造模后小鼠的体重和空腹血糖变化
3 DM小鼠平滑肌Fto特异性敲除后主动脉对血管收缩剂的反应性
与WT组相比,DM组血管收缩量效曲线的Emax及pEC50均显著升高(P<0.05);与DM组相比,FtoSMKO-DM组血管收缩量效曲线的Emax显著降低(P<0.05),pEC50无显著差异(P>0.05),见图3、表1。
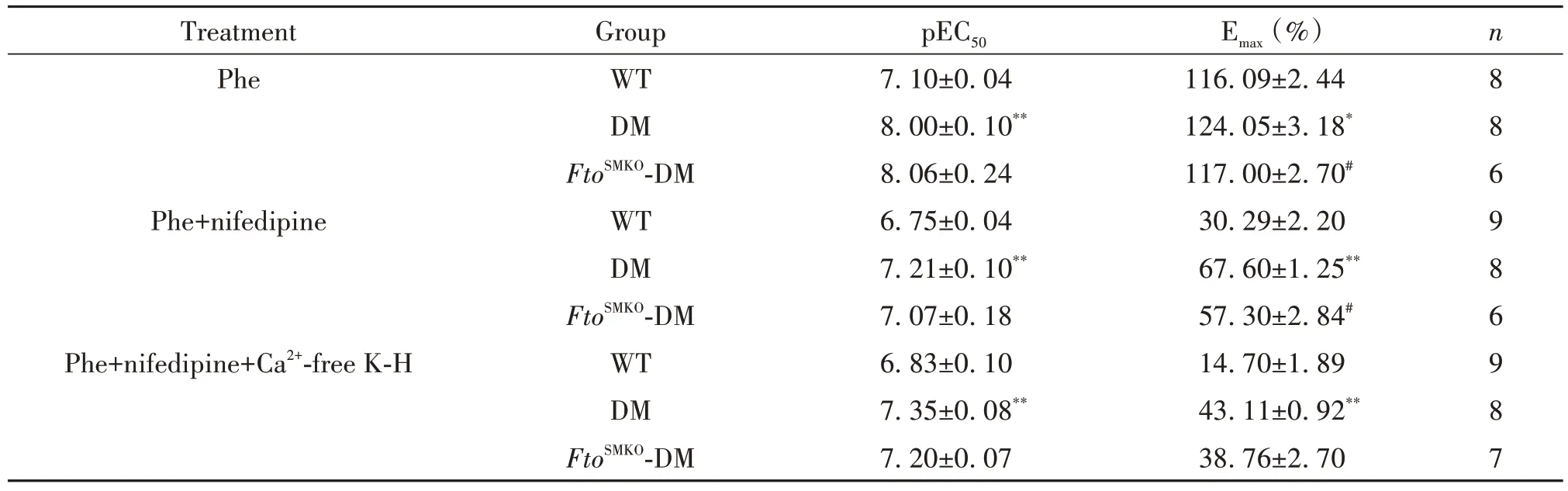
表1 不同处理下血管收缩剂Phe诱导主动脉收缩的pEC50和EmaxTable 1.The pEC50 and Emax derived from mouse aorta constriction curves induced by phenylephrine (Phe) under different treatments(Mean±SEM)

Figure 3.Responses of the aorta to agonist after smooth muscle-specific Fto knockout (FtoSMKO) in diabetes mellitus (DM) mice.A:representative recording of phenylephrine (Phe)-induced concentration-dependent contraction in aortic rings;B: concentrationdependent vasoconstriction induced by Phe in aortic rings.Mean±SEM.n=8 in wild-type (WT) group and DM group;n=6 in FtoSMKO-DM group.*P<0.05, **P<0.01 vs WT group;#P<0.05 vs DM group.图3 糖尿病小鼠平滑肌Fto特异性敲除后主动脉对血管收缩剂的反应性
4 DM小鼠平滑肌Fto特异性敲除后对非L型钙通道介导的血管平滑肌收缩的影响
血管环在含硝苯地平(1 μmol/L)的K-H溶液中孵育30 min,此时加入Phe诱导血管平滑肌产生的收缩主要由非L型钙通道介导。如图4、表1所示,与WT组相比,DM组血管平滑肌收缩量效曲线的Emax及pEC50显著升高(P<0.05);与DM组相比,FtoSMKO-DM组血管收缩量效曲线的Emax显著下降(P<0.05),pEC50无明显差异(P>0.05)。

Figure 4.Vasoconstriction responses mediated by non-L-type calcium channels after smooth muscle-specific Fto knockout(FtoSMKO)in diabetes mellitus (DM) mice.A: representative recording of contraction mediated by non-L-type calcium channels in aortic rings;B: influence of nifedipine (1 μmol/L) on phenylephrine (Phe)-induced vasoconstriction in aortic rings.Mean±SEM.n=9 in wild-type (WT) group;n=8 in DM group;n=6 in FtoSMKO-DM group.**P<0.01 vs WT group;#P<0.05 vs DM group.图4 糖尿病小鼠平滑肌Fto特异性敲除后对非L型钙通道介导的血管平滑肌收缩的影响
5 DM小鼠平滑肌Fto特异性敲除后对肌浆网钙释放介导的血管平滑肌收缩的影响
血管环在含1 μmol/L硝苯地平的无钙K-H溶液中孵育30 min,此时加入Phe诱导血管平滑肌产生的收缩主要由IP3R介导肌浆网的Ca2+释放引起。如图5、表1所示,与WT组相比,DM组血管收缩量效曲线的Emax及pEC50显著升高(P<0.05);与DM组相比,FtoSMKO-DM组血管收缩量效曲线的Emax及pEC50均无显著差异(P>0.05)。

Figure 5.Concentration-dependent vasoconstriction responses mediated by calcium released from the sarcoplasmic reticulum after smooth muscle-specific Fto knockout (FtoSMKO) in diabetes mellitus (DM) mice.A: representative recording of contraction mediated by sarcoplasmic reticulum calcium channels in aortic rings;B: influence of nifedipine (1 μmol/L) on phenylephrine (Phe)-induced vasoconstriction in aortic rings in Ca2+-free K-H buffer.Mean±SEM.n=9 in wild-type (WT) group;n=8 in DM group;n=7 in FtoSMKO-DM group.*P<0.05, **P<0.01 vs WT group.图5 糖尿病小鼠平滑肌Fto特异性敲除后对肌浆网钙释放介导的血管平滑肌收缩的影响
6 DM小鼠平滑肌Fto特异性敲除后对SOCC介导的血管平滑肌收缩的影响
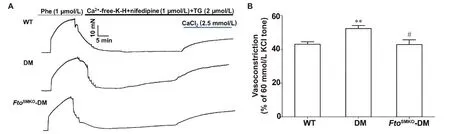
Figure 6.Store-operated calcium channel (SOCC)-mediated vasoconstriction responses after smooth muscle-specific Fto knockout(FtoSMKO) in diabetes mellitus (DM) mice.A: representative recording showing SOCC-mediated vasoconstriction of aortic smooth muscle;B: a summary graph of Ca2+-induced vasoconstriction mediated by SOCCs.Mean±SEM.n=8.**P<0.01 vs WT group;#P<0.05 vs DM group.图6 糖尿病小鼠平滑肌Fto特异性敲除后对SOCC介导的血管平滑肌收缩的影响
7 DM小鼠血管平滑肌Fto特异性敲除后肌浆网钙对咖啡因的反应性变化
与WT组相比,DM组RyR介导肌浆网钙释放诱导血管平滑肌收缩的峰值在不同浓度的咖啡因刺激下均显著降低(P<0.05);但与DM组相比,FtoSMKODM组血管平滑肌的收缩峰值在不同浓度的咖啡因处理下均显著升高(P<0.05),见图7B。在10 mmol/L咖啡因处理下,FtoSMKO-DM组的收缩达峰时间长于DM组(P<0.05),其余各组的收缩达峰时间均无显著差异(P>0.05),见图7C。利用时间常数τ衡量血管收缩达到峰值后恢复到基础张力所需的时间,结果显示,与WT组相比,DM组的τ值在不同浓度的咖啡因处理下显著降低(P<0.05);与DM组相比,FtoSMKODM组在5 mmol/L咖啡因处理下,τ值显著升高(P<0.05),在10 mmol/L和20 mmol/L咖啡因浓度处理下无显著差异(P>0.05),见图7D。
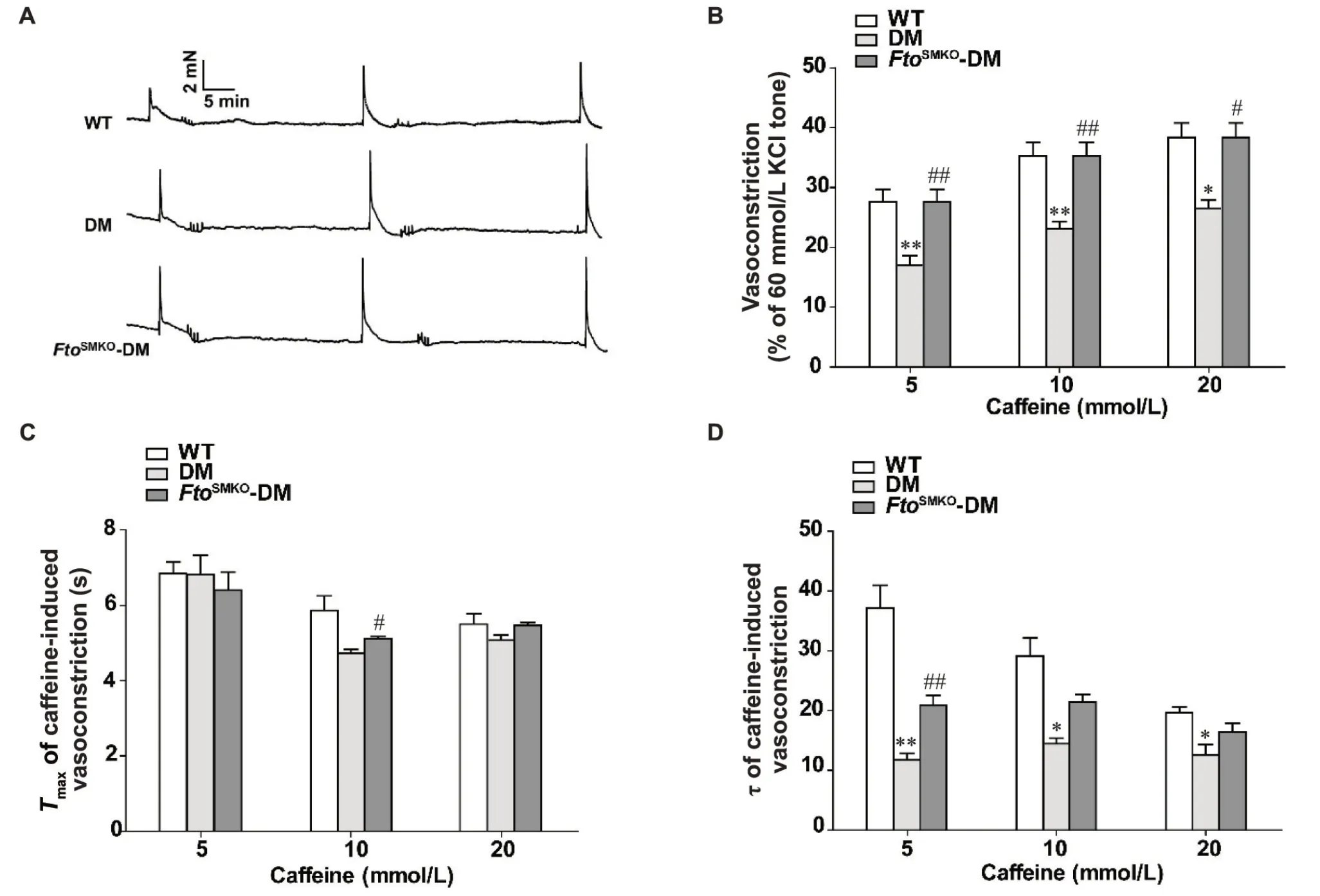
Figure 7.Changes in sarcoplasmic reticulum calcium responsiveness to caffeine after smooth muscle-specific Fto knockout (FtoSMKO)in diabetes mellitus (DM) mice.A: representative recording of aortic vasoconstriction induced by different concentrations of caffeine;B: the peak of caffeine-induced contraction in aortic rings;C: the time taken to reach the Emax(Tmax) of caffeine-induced vasoconstriction;D: τ of vasoconstriction in wild-type (WT), DM and FtoSMKO-DM mice.Mean±SEM.n=8.*P<0.05, **P<0.01 vs WT group;#P<0.05, ##P<0.01 vs DM group.图7 糖尿病小鼠平滑肌Fto特异性敲除后肌浆网钙对咖啡因的反应性变化
讨 论
研究结果显示,与正常小鼠相比,DM小鼠主动脉组织FTO表达增高;且课题组前期研究结果显示DM小鼠主动脉平滑肌收缩显著增加[4],提示FTO的表达水平可能与DM血管平滑肌收缩功能异常有关。为探究FTO对DM小鼠离体主动脉平滑肌收缩的影响,本研究在DM小鼠平滑肌Fto特异性敲除后,测量其离体主动脉平滑肌的张力变化。本研究结果显示,平滑肌敲除Fto后,Phe诱导DM血管平滑肌收缩的高反应显著降低,与非L型钙通道和SOCC介导的钙内流减少,咖啡因激活肌浆网的钙释放增加有关。
FTO是双加氧酶超家族的成员,主要存在于细胞核中,通过出口蛋白2(exporitein 2, XPO2)在核质间活跃移动[6]。研究表明FTO与DM血管病变有关:在基因水平上,Fto基因变异与DM肾病发生发展有关[7];在细胞水平上,VSMCs敲除Fto后,增殖和迁移减少[8];在动物水平上,小鼠的内皮细胞Fto缺失后,可以减少高脂饮食引起的葡萄糖不耐受和胰岛素抵抗[7]。FTO可通过不同途径广泛参与众多信号通路及疾病的发生发展,除作为去甲基化酶参与转录后修饰发挥作用外;FTO C 结构域还能通过钙依赖方式结合CaM,形成稳定复合物,和其他蛋白分子发生相互作用,介导FTO参与钙信号通路[3]。本实验结果提示,平滑肌特异性敲除Fto后,可通过钙调控方式改善DM血管的收缩功能,但目前尚不清楚Fto参与DM血管平滑肌收缩的分子机制。
[Ca2+]i是血管平滑肌收缩的关键因素,Phe通过与平滑肌细胞膜上的α1受体结合,激活偶联G蛋白信号通路引起[Ca2+]i增加,Ca2+与CaM形成Ca2+-CaM复合物,促进肌球蛋白轻链磷酸化,诱导血管平滑肌收缩[9]。血管平滑肌的功能受到代谢影响,长期暴露于代谢紊乱环境会引起血管平滑肌的张力异常[10]。研究表明,db/db小鼠主动脉和肠系膜动脉血管平滑肌收缩增强[4,11]。本实验结果显示,DM小鼠主动脉平滑肌收缩显著升高;但平滑肌特异性敲除Fto后,可减少DM血管平滑肌的过度收缩,提示Fto与血管的收缩功能有关。[Ca2+]i来源包括胞内Ca2+储存释放和胞外Ca2+内流,L型钙通道是胞外Ca2+内流介导血管收缩的重要途径[12]。实验结果显示Fto敲除后,血管平滑肌在硝苯地平存在的情况下,高糖诱导的收缩反应性增高得到抑制,提示Fto可通过非L型钙通道调控[Ca2+]i影响血管平滑肌的收缩。IP3R是肌浆网的钙释放通道,Phe与受体结合后,通过激活膜相关磷脂酶C,分解质膜磷脂酰肌醇4,5-二磷酸,分解产物IP3在细胞质中扩散并刺激Ca2+从肌浆网中释放[13]。本研究结果显示IP3R介导肌浆网Ca2+释放诱导血管平滑肌的收缩在FtoSMKO-DM组和DM组间无明显差异,提示Fto与IP3R介导的Ca2+释放无关。
SOCC异常与DM血管病变有着密切联系,并在不同物种、血管类型等因素下会产生不同影响[5]。本研究结果提示平滑肌特异性敲除Fto后,可以保护SOCC的功能不受高糖的影响。研究表明,SOCC活性增强可能与基质相互作用分子1和钙释放激活钙调节因子1(calcium release activates calcium regulatory factor 1, Orai1)表达增强有关,也可能与Orai1和大电导钙激活钾通道(large-conductance calcium-activated potassium channel, BKCa)相互作用减少有关[14]。CaM与众多钙通道蛋白存在相互作用,但目前尚不清楚FTO能否在Ca2+/CaM的介导下参与分子间的相互作用,进而影响SOCC活性。此外,ROS、下游信号通路CN/NFAT的异常等也是导致SOCC活性改变的因素[15],目前尚未明确FTO的作用,需要后续实验去进一步探究。
RyR是肌浆网上另外一个钙释放通道,在咖啡因作用下对Ca2+的敏感性增加,被低浓度的Ca2+激活,介导Ca2+释放诱导血管平滑肌收缩[16];血管的舒张主要依赖于BKCa介导VSMC超极化,引起[Ca2+]i降低[17-18]。本实验结果显示平滑肌特异性敲除Fto后,DM小鼠血管平滑肌在咖啡因刺激下产生的收缩幅度增强,提示FTO介导的钙调控调节血管平滑肌收缩与RyR介导的Ca2+释放有关。研究表明,咖啡因刺激小鼠肠系膜动脉收缩不仅与RyR介导的钙释放通道有关,还与介导钙内流的通道有关;如抑制CaV1.2,咖啡因刺激血管的收缩增强;而抑制Orai1,血管的收缩减弱[18]。说明Ca2+释放过程复杂,不同的钙通道间存在相互作用;但目前FTO在Ca2+释放过程中确切的功能和分子机制尚不清楚,仍需后续的实验进一步探究。
综上所述,本研究通过测定离体平滑肌Fto特异性敲除DM小鼠主动脉的张力变化,观察到Fto缺失后,高糖引起的血管平滑肌过度收缩得到改善,可能与FTO介导SOCC的钙内流及RyR介导的肌浆网钙释放有关,而与IP3R介导的肌浆网钙释放无关。FTO参与血管平滑肌的钙调控,改善血管收缩功能,是治疗DM血管病变的潜在靶点。后续将在细胞水平上,深入研究FTO参与DMVSMCs钙调控的分子作用机制。
