补体系统参与病理性疼痛的机制研究进展*
2024-03-07慕静然曾俊伟
骆 延, 梁 璇, 慕静然, 徐 陶, 曾俊伟
(遵义医科大学生理学教研室,贵州 遵义 563000)
慢性病理性疼痛是由于躯体感觉系统或者组织损伤而导致的疼痛,在临床上很常见,给患者的身心健康带来很大危害。其治疗方法涵盖了药物治疗、经皮神经电刺激、运动及心理治疗以及介入治疗等方法。然而,这些治疗方法也存在一些缺陷,如疗效欠佳、药物耐受、患者接受度不高等。近年研究表明,在补体(complement, C)系统,补体成分及相应受体的生成与活化不仅参与了一些神经系统退行性疾病如帕金森病和阿尔茨海默病的发生,也参与了病理性疼痛的发生与维持[1]。机体在接受来自外界的伤害性刺激或者来源于机体内环境中的伤害性刺激之后,感觉传导通路的多个关键位点如背根神经节(dorsal root ganglion, DRG)、脊髓背角、杏仁核、大脑皮层等区域均检测到多种补体成分、及补体受体的表达异常。因此,有关补体系统参与病理性疼痛的发生与维持的分子机制研究受到广泛关注。本文就这方面的新近研究进展作一综述,希望能够为研发新药用于临床镇痛治疗提供参考资料。
1 补体系统简介
补体系统在非特异性免疫中占有重要地位,主要包括补体固有成分、补体调节蛋白及补体受体,广泛参与机体免疫和炎症反应。补体固有成分包括C1~C9,甘露糖结合凝集素(mannose-binding lectin,MBL)及B因子、D因子等;补体调节蛋白一般表现为可溶性或膜结合形式,参与调控补体活化和后续效应的产生,主要有H因子、I因子、C1抑制因子(C1 inhibitor, C1INH)、C4b结合蛋白(C4b-binding protein,C4BP)、衰 变 加 速 因 子(decay-accelerating factor,DAF;即CD55)、膜辅因子蛋白(membrane cofactor protein, MCP;即CD46)、CD59等;补体受体分布在细胞膜表面,与补体活化过程中产生的活性片段结合,介导后续效应,主要包括补体受体1-5(complement receptor 1-5, CR1-5),补体成分1q受体(complement component 1q receptor, C1qR)、补体成分3a受体(complement component 3a receptor, C3aR)、补体成分5a受体(complement component 5a receptor,C5aR)等。补体激活主要有经典激活途径、凝集素途径和替代途径[2]。这三条途径激活后形成的C3转化酶可将C3裂解为C3a和C3b,导致进一步的C5转化酶激活,但也存在不依赖C3激活的C5转化酶形成,随后C5b与C6-9形成膜攻击复合物(membrane attack complex, MAC),MAC形成穿膜的亲水性通道,破坏局部磷脂双层结构,导致细胞裂解[3]。在补体活化过程中产生的多种裂解片段,可结合细胞膜相应受体而介导调理作用、免疫黏附作用、炎症介导作用、趋化作用等。近年研究表明,补体系统的激活参与了病理性疼痛的发生发展(图1)。
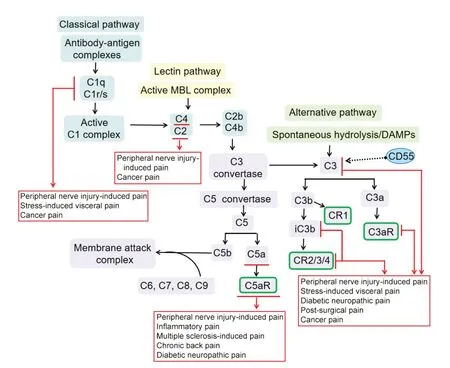
Figure 1.The associatation between the complement cascade and chronic pain.MBL: mannose-binding lectin;DAMPs: damage-associated molecular patterns.图1 补体级联反应与慢性病理性疼痛的关系
2 补体系统参与病理性疼痛的临床分析
在动物和人体的血液或组织液中存在多种补体固有成分,在正常情况下补体成分含量稳定,但在病理情况下有可能发生波动。近年研究观察到,在组织损伤导致的病理性疼痛患者,其外周血或组织液中补体成分含量异常,特别是补体激活片段明显增加,这提示补体系统的激活可能与病理性疼痛的发生与维持有关。与正常孩童相比,急性脑创伤导致头痛的患儿唾液标本中,补体成分C1qa、C1qb、C1S、C3和C4a含量增加,补体调节因子CD55、CFB和C-反应蛋白(C-reactive protein, CRP)也随之同步增加;在慢性性脑创伤导致头痛的患儿,其唾液标本中C1qa、C5、C8b和CD55含量增加[4]。在纤维肌痛患者的脑脊液标本检测到补体成分C4a含量增加,推测C4a参与疼痛可能是由于C4a与蛋白酶激活受体1(protease-activated receptor, PAR1)和PAR4结合导致这两种受体激活所致[5]。在类风湿性关节炎疼痛患者,其外周血红细胞表面补体受体CR1和CD59表达显著降低,其中,CR1表达下降导致免疫复合物不能及时被清除,CD59表达下降则不能阻碍MAC的组装,这均促进了补体系统的激活,给予药物治疗提高红细胞表面补体受体1(complement receptor 1, CR1)和CD59表达,则关节痛减轻[6]。
随后的一些研究报道进一步提示,补体系统的激活可能在病理性疼痛的发生及维持过程中起重要作用。给予高乌甲素或曲马多可明显缓解直肠癌术后患者的痛觉感受症状,其视觉模拟量表VAS评分(用于评估痛觉感受)显著降低,同时检测到外周血C3和C4含量明显上升,提示补体的激活裂解片段生成减少[7];与之相类似,神经母细胞瘤患者给予抗GD2抗体ch14.18(可促进补体激活)治疗后最常见的副作用就是疼痛感受增强,此时患者血清补体成分C3和C4含量下降,但给予另一种可以抑制补体激活的抗GD2抗体Hu14.18K322A进行治疗后患者痛觉感受减轻,血清C3和C4含量升高,对吗啡的需要量明显减少,也说明补体的激活以及裂解片段生成减少有助于患者痛觉感受的减轻[8]。阵发性睡眠性血红蛋白尿症患者表现出腹痛症状,而在给予依库珠单抗(eculizumab;靶向末端补体蛋白C5的人源化单克隆抗体)治疗后,腹痛症状完全缓解[9]。
3 补体系统参与病理性疼痛的分子机制
近年通过形态学及分子生物学技术证实,神经系统中的神经元、少突胶质细胞、小胶质细胞和星形胶质细胞都能合成补体成分[10]。在多种病理性疼痛动物模型,观察到感觉传导通路的多个节点上补体系统成分表达异常,采取相应干预措施下调补体激活,抑制补体激活片段则具有镇痛效应,这提示补体系统激活对神经病理性疼痛的产生和维持起着至关重要的作用。近年该领域分子机制的研究进展如下。
3.1 补体系统参与病理性疼痛的外周机制 DRG神经元能接受外部伤害性信息,并传达到脊髓背角。在炎性痛以及神经痛动物模型中,可见皮肤损伤区域或DRG组织补体成分表达上升,如:足底切口疼痛小鼠,切口处皮肤C5的mRNA表达水平上升[11];足底注射C3a和(或)C5a的炎性痛小鼠,DRG分布的C5aR表达上升[12];注射酵母聚糖-不完全弗氏佐剂到大鼠L5/S1椎间孔以诱发DRG神经炎症,检测到DRG补体级联反应激活,经典补体激活途径的始动分子C1q和C3表达增多[13];坐骨神经慢性压迫(chronic constriction injury, CCI)疼痛大鼠的DRG持续 高 表 达C1q[14-15];在 脊 神 经 结 扎 大 鼠 的DRG,C1qα、C1qαβ、C1qαγ、C1r、C1s、C2、C3、C4和C7等多种补体成分,B、D、H和P因子,以及补体受体CR3表达上调,但补体抑制物DAF表达却明显下调[16-17];在多发性硬化小鼠,表现出痛觉感受,其DRG有大量C5aR1阳性的免疫细胞[18]。在皮肤损伤处注射C5aR拮抗剂PMX53或腹腔注射补体活性抑制剂眼镜蛇毒因子CVF分别可以缓解实验动物的炎性痛或神经痛症状,下调DRG补体成分C5的表达和裂解,并抑制C5aR的表达或抑制C3的表达[11]。
从这些研究结果来看,外周神经系统的补体系统激活参与了病理性疼痛的发生与维持,主要有以下3个相关机制。
3.1.1 补体激活促进外周痛觉感受器的敏化 在小鼠足底切口痛模型,伴随着补体成分C5表达和裂解增多,同时C类纤维对热刺激的反应增强[11];在小鼠爪部注射C3a和(或)C5a引出机械痛或热痛敏行为,A类或C类传入纤维动作电位阈值降低,动作电位发放频率增加;这种现象与巨噬细胞释放NGF和C类纤维末梢释放降钙素基因相关肽(calcitonin gene-related peptide, CGRP)增多有关[19-20]。在离体实验也证明,C3a和C5a不仅刺激培养的DRG神经元胞内钙动员,更促进了辣椒素受体——瞬时受体电位阳离子通道亚家族V成员1(transient receptor potential subfamily V member 1, TRPV1)诱发的DRG神经元胞内钙动员[12];神经生长因子(nerve growth factor, NGF)更进一步促进TRPV1介导的内向电流幅度增加,而CGRP可以促进DGR神经元河豚毒素不敏感型的电压门控的Na+内流,引起DRG神经元的兴奋与敏感程度增加。
3.1.2 补体激活促进免疫细胞活动增强 补体系统的激活被认为是慢性疼痛神经免疫机制中的重要环节[21]。机体受到外界伤害性刺激之后,随着补体级联反应发生,损伤局部区域的B细胞、中性粒细胞和巨噬细胞等迁移至损伤区域,释放致痛物质如趋化因子(C-C基序)配体2[chemokine(C-C motif) ligand 2, CCL2]、三磷酸腺苷(adenosine triphosphate,ATP)、肿瘤坏死因子α(tumor necrosis factor-α, TNFα)、前列腺素E2(prostaglandin E2, PGE2)、白细胞介素1β(interlenkin-1β, IL-1β)等,参与了痛觉敏化的维持[22]。如C5aR1基因敲除可以明显缓解类风湿性关节炎小鼠的疼痛症状,减轻关节滑液中性粒细胞浸润和滑膜组织巨噬细胞聚集,TNF-α和细胞间黏附分子1(intercellular adhesion molecule-1, ICAM-1)分泌相应减少[22-23];同样,给予C3激活抑制物Efb-C可以减轻免疫细胞的激活,减轻强直性脊柱炎小鼠的痛行为[24]。
3.1.3 补体激活参与调节神经损伤后的轴突再生 在外周神经损伤后,损伤区域的C1q和C3a可以减轻髓鞘相关糖蛋白对DRG神经元轴突生长的抑制作用,但C3b却导致DRG神经元活力下降,轴突生长被抑制,由此可见补体的激活对于轴突损伤后的修复更像一把双刃剑。当外周神经损伤后,DRG神经元DAF表达下降,实验动物表现出痛行为,当神经损伤恢复之后,DAF表达上升[25-26],痛行为减轻。可见,补体活化与轴突损伤以及相应的痛行为发展密切相关。
3.2 补体系统参与病理性疼痛的中枢机制 痛觉作为感觉的一种,由于组织损伤或神经系统病变形成的传入冲动进入中枢神经系统,首先到达脊髓,与脊髓浅层分布的中间神经元、上行投射神经元以及脑干下行纤维之间组成局部网络,这导致脊髓水平的痛觉敏化;随后伤害性信息继续上行,到达脊髓上结构(supraspinal structures),包括丘脑、下丘脑、海马、杏仁核、扣带回、感觉及运动皮层等部位,参与痛觉信息的整合。因此,有关补体系统参与病理性疼痛的相关机制按照脊髓以及脊髓上结构两部分进行阐述。
3.2.1 脊髓 脊髓背角是疼痛信息整合的重要部位,接收来自DRG输入的伤害性信息。对CCI、脊神经结扎和坐骨神经分支选择性结扎的疼痛大鼠的脊髓背角组织采用mRNA表达谱的微阵列分析及形态学技术显示,C1qb、C1qg、C3和C4表达明显上升,荧光双标观察到C1q、C3、C4和C5aR表达于背角小胶质细胞[27],但在皮肤肌肉切开-牵拉痛以及足底注射完全弗氏佐剂的炎性痛小鼠也检测到C3位于背角星形胶质细胞[28-29];C5基因缺陷或鞘内给予C5aR拮抗剂的坐骨神经损伤(sciatic nerve injury, SNI)小鼠痛觉感受明显减轻,但C6基因缺陷的SNI小鼠痛觉感受并没有减轻,说明补体裂解片段与相应受体结合促进了痛觉敏化,而补体反应下游的MAC似乎并没有参与痛觉敏化[27]。
目前认为脊髓水平补体系统促进痛觉敏化主要通过以下3个机制。
3.2.1.1 兴奋性和抑制性突触传递失衡 外周神经损伤后,在脊髓背角,补体成分C1q增多,位于抑制性突触的iC3b和淀粉样前体样蛋白2(amyloid precursor-like protein 2, APLP2)均可与小胶质细胞的CR3结合,启动CR3/TREM2信号通路,溶酶体膜CD68表达上升提示小胶质细胞溶酶体功能增强,针对抑制性突触进行吞噬,导致抑制性突触丢失近51%,兴奋性突触传递效能相对增强,促进慢性疼痛的维持[30-31];脊髓背角RhoA/ROCK通路激活促进小胶质细胞吞噬神经元突触碎片,参与神经痛的维持[32]。另外,脊髓损伤导致大鼠神经痛,其背角C1q、CR3和神经元谷氨酸NMDA受体亚单位NR2B的表达同步上调[33],也支持伤害性刺激作用下,补体激活与脊髓背角兴奋性突触传递增强有关。
3.2.1.2 促进胶质细胞激活 在脊髓背角小胶质细胞表达的补体受体CR3、C3aR1和C5aR,可以促进小胶质细胞活化,导致痛觉敏化。在糖尿病大鼠脊髓背角C3和CR3表达增多而补体调节蛋白CD55表达下降[34-35];鞘内给予小胶质细胞活性抑制剂米诺环素或补体抑制剂compstatin(以C3为靶点)均明显减轻癌痛大鼠的疼痛症状,抑制小胶质细胞激活和CR3表达,下调背角神经元C1、C2和C3表达,C3裂解产物iC3b减少[36];在SNI疼痛大鼠的脊髓背角小胶质细胞C3aR1表达升高,C3aR1的激活导致小胶质细胞钙离子浓度升高,有助于促进炎症因子的释放[37]。鞘内注射C5a可以诱发大鼠冷痛觉过敏,后来证实该现象缘于C5a刺激小胶质细胞分布的C5aR导致[38]。
3.2.1.3 影响背角神经元功能 尾静脉注射补体抑制物眼镜蛇毒因子可明显缓解CCI大鼠的痛行为,减轻神经损伤导致的脊髓背角C3 mRNA表达上调、超氧化物歧化酶(superoxide dismutase, SOD)活性下降、丙二醛(malondialdehyde, MDA)含量增多、神经元线粒体肿胀以及线粒体嵴碎裂等[26]。也有报道在椎间盘源性腰痛大鼠脊髓背角神经元表达有C5aR[39],但尚不清楚C5aR激活对神经元功能的调节作用。
3.2.2 脊髓上结构 当外界伤害性刺激持续作用下,脊髓水平以上包括脑干、间脑和大脑皮层,参与处理来自脊髓上行的疼痛信息并进行整合,产生痛觉感受[40]。转录组学分析显示,在海马CA1区给予米诺环素可以减轻CCI大鼠疼痛症状,此时海马补体级联反应激活也明显被抑制[41]。在应激导致的内脏痛大鼠的中央杏仁核,补体成分C1q和C3增多,C3裂解为C3a和C3b,C3b降解为iC3b,与小胶质细胞CR3结合,促进小胶质细胞激活,对兴奋性突触成分突触后致密蛋白95(postsynaptic density protein 95, PSD95)进行吞噬,导致局部突触结构重塑;在中央杏仁核给予米诺环素或CR3抑制剂NIF可明显抑制小胶质细胞的活化,降低小胶质细胞对兴奋性突触进行吞噬,进而产生镇痛效应,说明杏仁核小胶质细胞CR3信号通过吞噬兴奋性突触参与内脏痛的发生和维持[42-44]。国内研究还证实,在基底外侧杏仁核小胶质细胞激活后吞噬突触的能力增强,导致癌痛大鼠的疼痛、焦虑及抑郁样行为[45]。
与脊髓背角的情况相似,在炎性痛或神经痛动物模型,多个脑区如未定带区域(丘脑网状核旁的丘脑下核团,含较多GABA能抑制性神经元)、前扣带回皮层和感觉皮层的小胶质细胞激活后对GABA能神经元树突棘成分进行吞噬修剪,导致这些区域的抑制性突触传递效能减退而兴奋性突触传递增强,从而促进了痛觉敏化的形成[46-48],但是否有补体机制的参与,还需要探讨。
补体系统参与病理性疼痛分子机制的总结见表1。

表1 补体及其受体参与病理性疼痛发生和维持的机制Table 1.The mechanism of complement and their receptors in the occurrence and maintenance of pathological pain
4 补体系统:镇痛治疗的潜在靶点
在临床上,骨关节炎、类风湿性关节炎、胰腺炎、烧伤以及手术创伤导致疼痛的患者,其关节滑液、外周血或损伤区域组织液中补体成分(如C3a、C5、C5a等)含量上升;在多种疼痛动物模型的感觉传导通路的多个位点补体成分及补体受体(CR3或C5aR)表达上升,而C3或C5基因敲除或者给予补体激活抑制物可以明显减轻实验动物的痛觉过敏症状。目前已经在临床上使用的以补体系统为靶点的药物有C1酯酶抑制剂辛里泽(cinryze)、补体C3抑制剂pegcetacoplan(靶向近端补体蛋白C3的聚乙二醇化肽)、长效C5补体抑制剂依库珠单抗eculizumab和ravulizumab[22]。pegcetacoplan用于治疗阵发性睡眠性血红蛋白尿症;辛里泽用于减轻血管性水肿;eculizumab用于神经脊髓炎、全身性重症肌无力以及阵发性睡眠性血红蛋白尿症的治疗。这3种药物均可减轻这些患者的疼痛症状,但这些药物价格昂贵,且都存在一些不良反应。因此,以补体系统为靶点研发价格合理且副作用小的新型镇痛药是有意义的。
正在临床前实验或临床试验阶段的补体干预药还有C5aR1抑制剂CCX168和PMX53有望用于减轻周围神经病变,发挥镇痛效应[49]。PMX53虽然在动物疼痛模型展示了良好的镇痛效应,但临床试验的结果并不理想,缺点在于PMX53的口服吸收差、生物利用度低。另一种脂溶性的PMX53类似物PMX205由于口服吸收良好,可以透过血脑屏障,更有望在临床实验中取得好的结果。
我国对中草药的开发与使用已有上千年时间,近年对天然产物的提取和优化工艺水平显著提升。相关研究表明,国内在风湿性多肌痛患者给予白芍总苷联合雷公藤治疗,外周血C3含量下降,疼痛症状明显减轻[50];在动物实验也观察到芍药苷可以抑制胶质细胞激活以及后续的炎症反应;此外,国内研究报道,背根神经节脉冲射频可以缓解炎性痛大鼠脊髓背角小胶质细胞CR3表达,抑制小胶质细胞和星形胶质细胞激活,从而发挥镇痛效应[51],这提示除药物治疗之外,其他治疗手段也有可能通过下调补体反应发挥镇痛效应。
