经血源子宫内膜干细胞移植通过免疫调节缓解化疗引起的小鼠肠道损伤和菌群失调*
2024-03-07常梦源宋豪锋杜晨旭李永海张胜辉刘彦礼林俊堂
刘 秦, 常梦源, 宋豪锋, 杜晨旭, 李永海, 张胜辉, 刘彦礼△, 林俊堂,3
(1新乡医学院生命科学技术学院,河南 新乡 453003;2新乡医学院干细胞与生物治疗技术研究中心,河南 新乡 453003;3新乡医学院医学工程学院,河南 新乡 453003)
肿瘤作为全球公共卫生的主要威胁之一,为患者及其家庭带来了巨大的心理和生理负担。据统计,2022年约有482万例新发肿瘤病例和320万例肿瘤死亡病例[1]。尽管靶向治疗和免疫治疗等医学治疗手段不断进步,但化疗、放疗和手术仍然是肿瘤的主要治疗手段。而常规化疗药物包括抗代谢物、烷基化剂、抗肿瘤抗生素和金属铂类络合物等,均具有细胞毒性,在有效杀死肿瘤细胞的同时对健康细胞也产生毒性,会导致肠道黏膜炎、骨髓抑制、脱发及骨质疏松等症状[2-4]。约40%的标准剂量化疗患者和100%的大剂量化疗患者会出现恶心、呕吐、腹痛、腹泻等和肠黏膜炎相关的营养不良[5]。而化疗引起的肠黏膜炎(chemotherapy-induced intestinal mucositis, CIM)是由化疗药物直接诱导的细胞毒性和异常炎症过程引起的肠道黏膜损伤,不仅严重降低患者的生活质量,增加住院费用,而且还会影响患者抗癌治疗的依从性,降低患者对化疗的耐受性,从而导致化疗方案实施的中断、延迟等[6]。顺铂(cisplatin,Cis)作为常用的铂类化疗药物之一,在临床上已广泛应用于不同类型肿瘤的治疗,包括卵巢癌、乳腺癌、睾丸癌和头颈部实体瘤等[7-9]。铂类药物对细胞的治疗和毒性作用,与其与DNA上的嘌呤碱基的相互作用相关,可通过干扰DNA修复,抑制DNA合成和有丝分裂,随后诱导细胞凋亡[10]。此外,Cis具有较强的肾毒性、耳毒性、神经毒性以及胃肠道毒性等毒副作用,显著影响治疗效果。研究表明,化疗引起肠道毒性的主要机制在于氧化应激和炎症反应,通过增加细胞产生活性氧自由基,激活促炎因子及促凋亡因子的表达,导致肠上皮细胞损伤及肠道微生物紊乱[11]。间充质干细胞(mesenchymal stem cells,MSCs)作为一种多能性干细胞,具有良好增殖能力、营养及免疫调节能力,在诸多疾病的治疗中展现出效果[12]。经血源子宫内膜干细胞(menstrual bloodderived endometrial stem cells, MenSCs)凭借其周期性、无创采集、来源丰富、良好的增殖能力以及可用于自体移植等优势,逐渐成为干细胞治疗的优良种子细胞[13-14]。因此,本研究旨在明确MenSCs移植对Cis引起的小鼠肠黏膜炎的治疗效果,并进一步分析其中的机制及其对小鼠肠道菌群的影响,以期为临床使用MenSCs治疗CIM提供参考资料。
材料和方法
1 实验动物
30只SPF级别ICR小鼠,6~8周,雌性,体重(26±2) g,许可证号为SCXK(京)2021-0006,购于北京维通利华实验动物技术有限公司。所有动物均常规饲养于恒温(25±1) ℃、恒湿(45%~65%)的洁净动物房中,12 h/12 h明暗交替,可自由进食饮水。所有实验程序均按照新乡医学院伦理委员会要求进行。
2 主要试剂
Cis注射液(云南生物谷药业有限公司);IL-10鼠单克隆抗体(Proteintech,60269-1-Ig)、Bax兔多克隆抗体(Proteintech,50599-2-Ig)、IL-6鼠单克隆抗体(Proteintech,66146-1-Ig)、Bcl-2兔多克隆抗体(Proteintech,26593-1-AP)、紧密连接蛋白ZO-1兔多克隆抗体(Proteintech,21773-1-AP)及occludin兔多克隆抗体(Proteintech,27260-1-AP);IL-1β兔单克隆抗体(Cell signaling technology,12703S);β-tubulin兔单克隆抗体(Abways,AB0039);HRP标记的山羊抗兔IgGⅡ抗(absin,abs20040)和HRP标记的山羊抗鼠IgGⅡ抗(absin,abs20039);HE染色试剂盒(上海碧云天生物技术有限公司)。
3 主要方法
3.1 Cis诱导小鼠肠道损伤模型构建及MenSCs移植:本模型构建方法以腹腔注射Cis(2 mg/kg)引起小鼠肠黏膜炎为基础[15],模拟临床化疗相关肠黏膜炎的发病原因,构建小鼠化疗后肠道损伤模型。将符合实验标准的30只ICR小鼠适应性喂养1周后,随机分为正常(normal)组、Cis组和Cis+MenSC组,每组10只。除正常组小鼠外,其余小鼠从第1天(Day 1)开始,连续5天腹腔注射Cis(2 mg/kg);正常组小鼠经腹腔注射接受等体积生理盐水。第7天Cis+Men-SC组小鼠经尾静脉移植MenSCs[每只小鼠1×106(300 μL)],正常组和Cis组小鼠经尾静脉输入等体积生理盐水(图1A)。2周后采用颈椎脱臼法处死小鼠,取小鼠全部肠道做HE染色、免疫组化染色和Western blot实验,收集各组小鼠肠道粪便,进行高通量16S rDNA扩增子测序。

Figure 1.Flow chart of animal experiment and body weight changes of mice in each group.A: flow chart of animal experiment;B:body weight changes of mice in each group.Compared to the Cis group, the MenSCs-treated mice showed significantly increased body weight.Mean±SD.n=10.*P<0.05 vs Cis group at same time.图1 动物实验流程及各组小鼠体重变化
3.2 体重检测 自Day 1开始观察,每隔3天定时称量各组小鼠体重,同时观察小鼠毛发、活动情况、精神状态等。
3.3 HE染色 将各组小鼠肠道组织于4%多聚甲醛中固定24 h,常规脱水、石蜡包埋后进行切片,厚度为5 μm。将组织切片经二甲苯脱蜡后进行HE染色、无水乙醇脱水、中性树胶封片后于倒置显微镜下观察拍照。
3.4 免疫组化染色 小鼠肠道石蜡切片常规脱蜡、乙醇梯度孵育复水,抗原修复;使用封闭缓冲液封闭标本60 min,4 ℃条件下加入Ⅰ抗(F4/80,1∶200;IL-6,1∶200)孵育过夜;苏木素复染、脱水、风干后将切片密封并在显微镜下成像。
3.5 Western blot 小鼠肠道组织,加入含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液于组织匀浆破碎仪中提取总蛋白,BCA法检测蛋白浓度;样本进行SDS-PAGE分离,400 mA恒流转膜45 min,5% BSA室温封闭1 h,4 ℃条件下加入Ⅰ抗(β-tubulin、ZO-1、occludin、IL-1β、IL-6、IL-10、Bax和Bcl-2)分别孵育过夜,室温下加入Ⅱ抗孵育1 h;ECL发光后凝胶成像仪采集图片。Image J软件分析目的条带灰度值,以β-tubulin为内参照,分析目的蛋白的表达水平。
3.6 肠道微生物的分析测定 小鼠粪便样本高通量16S rDNA扩增子测序由华大基因完成。首先提取粪便中细菌的总DNA,取质量合格的基因组DNA样品30 ng及对应的融合引物配置PCR反应体系,设置PCR反应参数进行PCR扩增,使用Agencourt AMPure XP磁珠对PCR扩增产物进行纯化并溶于Elution Buffer,完成建库。使用Agilent 2100 Bioanalyzer对文库的片段范围及浓度进行检测。检测合格的文库根据插入片段大小,选择HiSeq平台进行测序。
4 统计学处理
通过GraphPad Prism 8.0软件对本研究数据进行统计学分析,计量资料以均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,两组间比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1 MenSCs显著改善Cis诱导小鼠体重
正常组小鼠体重随时间逐步增加,排便正常,活动自如。Cis组小鼠体重下降,出现腹泻,毛发粗糙,活动逐渐缓慢。给予MenSCs移植后,小鼠毛发光滑,活动能力增强,体重显著恢复(P<0.05),见图1。进一步解剖取材显示,Cis组小鼠肠道外观呈暗红色,无光泽,肠道解剖位置改变;而Cis+MenSC组小鼠肠道血供良好,呈鲜红色,肠道解剖位置正常。
2 MenSCs显著改善Cis诱导小鼠肠道微观结构及上调紧密连接蛋白
HE染色结果可见,正常组小鼠小肠和结肠组织肠绒毛纤细,腺体结构完整,排列有序,无炎症与组织水肿表现;而Cis组小鼠肠道组织与正常组相比,肠黏膜变薄,绒毛缩短,腺体排列杂乱,杯状细胞减少,炎症细胞浸润严重,肠壁组织有存在缺血区域;经MenSCs移植后,小鼠肠道黏膜损伤和炎症浸润减轻,见图2A。随后小鼠肠道组织紧密连接蛋白检测结果显示,经MenSCs移植后,ZO-1和occludin在小肠和结肠组织中的表达均显著上调(P<0.05),见图2B。
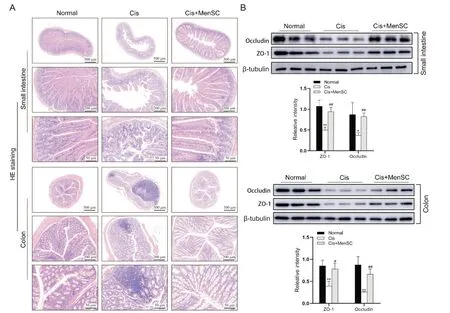
Figure 2.MenSCs transplantation significantly improved the intestinal microstructure and up-regulated the expression of tight junction related proteins in Cis-treated mice.A: HE staining was performed to evaluate the micromorphology of small intestine and colon tissues in mice.The results showed that MenSCs transplantation significantly relieved intestinal lymphocytes infiltration, alleviated intestinal villous edema, and orderly arranged glands in intestinal tissues in Cis-treated mice(n=5);B: the expression of tight junction related proteins in small intestine and colon was detected by Western blot and quantified using Image J software.The results demonstrated that MenSCs transplantation significantly up-regulated the expression of intestinal tight junction related proteins ZO-1 and occludin in Cis-treated mice.Mean±SD.n=3.*P<0.05, **P<0.01 vs normal group;#P<0.05, ##P<0.01 vs Cis group.图2 MenSCs移植显著改善Cis诱导的小鼠肠道微观结构并上调紧密连接蛋白的表达
3 MenSCs显著下调肠道组织中促炎因子及促凋亡蛋白的表达
小鼠肠道炎症因子检测结果显示,经MenSCs移植后小鼠肠道组织中F4/80和IL-6染色阳性细胞率显著降低(P<0.01);促炎因子IL-1β和IL-6的表达显著下调(P<0.01),抑炎因子IL-10的表达显著上调(P<0.01),见图3。进一步检测结果显示,经MenSCs移植后小鼠肠道组织中抗凋亡蛋白Bcl-2的表达显著上调(P<0.01),而促凋亡相关蛋白Bax表达显著下调(P<0.01),见图4。
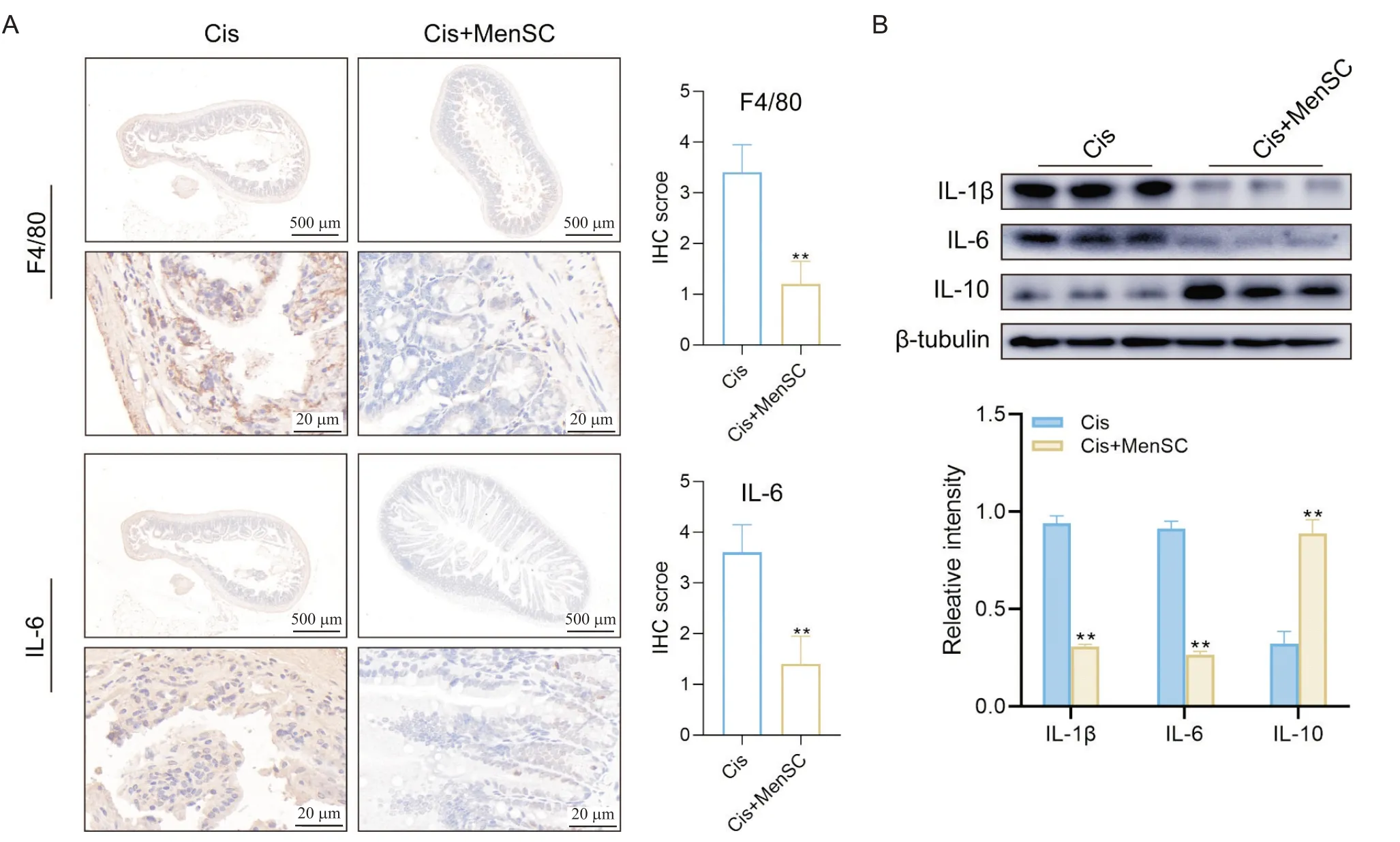
Figure 3.Effect of MenSCs transplantation on Cis-induced expression of inflammatory factors in the intestinal tissue of mice.A: the expression of F4/80 and IL-6 in the intestinal tissue of mice was detected by immunohistochemical staining and quantified using IPP software.The results demonstrated that MenSCs transplantation significantly inhibited the macrophages infiltration in the intestinal tissues of Cis-induced mice, and down-regulated the expression of IL-6;B: the expression of IL-1β,IL-6 and IL-10 in intestinal tissues was detected by Western blot and quantified using Image J software.The results indicated that MenSCs transplantation significantly down-regulated the expression of pro-inflammatory factors (IL-1β and IL-6)and up-regulated anti-inflammatory factor (IL-10) in the intestinal tissues of Cis-induced mice.Mean±SD.n=3.**P<0.01 vs Cis group.图3 MenSCs移植对Cis诱导的小鼠肠道炎症因子表达的影响

Figure 4.Effect of MenSCs transplantation on Cis-induced expression of apoptotic factors in the intestinal tissues of mice.The results indicated that MenSCs transplantation significantly up-regulated the expression of anti-apoptotic protein Bcl-2 and downregulated the pro-apoptotic protein Bax in the intestinal tissues of Cis-induced mice.Mean±SD.n=3.**P<0.01 vs Cis group.图4 MenSCs移植对Cis诱导的小鼠肠道凋亡因子表达的影响
4 MenSCs改善小鼠肠道微生物群的多样性和丰富度
小鼠粪便16S rDNA测序结果显示,在所有样本的362个操作分类单元(operational taxonomic unitis,OUT)中,共检测到255个通用OTU。Cis组、Cis+MenSC组中分别有50个和57个独特的OTU(图5A)。对两组间的Alpha多样性指数进行差异分析的检验,结果显示与Cis组小鼠相比,Cis+MenSC组小鼠肠道微生物辛普森多样性指数(ACE index)和香农-威纳指数(Shannon index)都有显著增加(P<0.05),见图5B、C。物种差异分析结果显示,MenSCs移植后不仅显著降低Cis组小鼠肠道中有害微生物艾森伯格氏菌(Eisenbergiella tayi)和人结肠厌氧棍状菌(Anaerotruncus colihominis)的丰度(P<0.01),同时还显著增加肠道中有益微生物乳杆菌(Lactobacillus apodemi)的丰度(P<0.05),见图5D、E。而进一步差异微生物群落功能富集结果显示,Cis组和Cis+Men-SC组小鼠肠道差异微生物主要富集在如下显著改变的代谢途径,包括氨基酸代谢(amino acid metabolism)、消化系统(digestive system)、折叠分类及降解(folding, sorting and degradation)等部分,见图5F。
讨 论
肿瘤不仅是全球死亡人数的第二大因素,也一直是生物医学研究与实践的焦点,尽管随着医学诊疗技术不断发展和进步,但化疗仍然是大多数晚期肿瘤患者的主要治疗手段[16]。在化疗过程中,使用大剂量具有细胞毒性化疗药物的患者常出现恶心、呕吐、腹痛、腹泻和化疗性肠粘膜炎等相关的营养不良症状[17]。研究表明,氧化应激、凋亡和肠道微生物群失调均参与了CIM的发生和发展[18]。MSCs及其多种衍生物(外泌体、胞外囊泡及活性因子等)在受损组织的愈合和修复过程中发挥积极作用,为其保护正常细胞免受化疗引发的组织损伤提供依据。同时,MSCs凭借强大的免疫调节能力,可通过抑制炎症反应改善正常组织细胞免受细胞毒性药物的损害,缓解化疗引发的毒副作用[19]。而MenSCs可通过无创的方法、周期性地从经血样本中分离获得,其表现出良好的增殖能力、低免疫原性和自体移植潜能,有效地促进组织修复,在临床应用中展示出巨大的应用前景。因此,本研究使用Cis诱导小鼠出现化疗性肠黏膜炎症状,并经MenSCs移植后,明确MenSCs改善Cis引起的CIM的效果,并进一步分析潜在机制。
现已明确在化疗相关性肠黏膜炎的发病机制中,肠道屏障的破坏影响肠通透性和紧密连接功能,可使细菌及其产物进入体循环,促炎因子的表达和炎症通路的激活均会加重黏膜损伤[20]。而化疗药物具有明确的细胞毒性,杀伤肿瘤细胞的同时也会抑制肠道细胞增殖,并通过诱导肠道细胞凋亡来引起肠道损伤。因此,维持肠道细胞稳态可以有效减轻化疗引起的肠道炎症和损伤。而MSCs已被证实可通过抑制炎症细胞的增殖及促炎因子的产生发挥其抗炎作用及促再生功能[21]。Lv等[22]研究表明Men-SCs移植可通过减少结肠组织淋巴细胞浸润和肠道内炎症反应,显著改善葡聚糖硫酸钠诱导的结肠炎小鼠症状和组织形态学变化。近来,Wei等[23]研究显示MSCs来源的外泌体携带的miR-129-5p,可通过靶向ACSL4抑制细胞内脂质过氧化和铁死亡,从而改善DSS诱导的小鼠肠道内炎症并修复肠道损伤。此外,本课题组前期研究表明MenSCs可改善受Cis化疗影响的卵巢结构和功能,提高了卵巢颗粒细胞的活性,并显著上调了其抗凋亡能力[24]。与前期结果一致,在本研究中,经MenSCs移植后,可显著下调小鼠肠道组织中促炎因子IL-1β、IL-6以及促凋亡蛋白Bax的表达,上调抑炎因子IL-10及抗凋亡蛋白Bcl-2的表达,显著改善Cis诱导小鼠肠道结构及功能。
此外,肠道微生物群在人体健康中发挥重要的代谢功能,并通过刺激免疫系统调节炎症反应,对于维持与免疫细胞的共生关系至关重要[25]。随着测序技术不断发展,肠道菌群与CIM的关系已成为CIM发病机制及治疗研究的热点[26]。研究表明,化疗药物可杀伤肠道内有益菌,导致肠道对有害菌的抵抗力减弱,有害菌大量增殖,破坏肠道菌群平衡,加重肠道黏膜炎症[27-28]。MSCs移植不仅可通过调节调节性T淋巴细胞-免疫球蛋白A(Tregs-IgA)反应,促进IgA分泌,进而促进肠道菌群的恢复来改善葡聚糖硫酸钠诱导的结肠炎症状[19];而且还可通过调节结肠炎小鼠代谢紊乱,使异常的肠道菌群功能恢复至正常水平[29]。与前期研究结果一致,在本研究中,经MenSCs移植后可改善Cis诱导的小鼠肠道菌群种类,促进肠道有益菌的增加,有利于恢复肠道菌群的平衡,改善肠道炎症。
综上,本研究明确了经MenSCs移植可显著改善Cis诱导小鼠肠道黏膜损伤及炎症反应,修复肠道免疫屏障,增加有益菌含量,改善化疗相关性肠道菌群失调,该结果为临床使用MSCs改善化疗性肠黏膜炎提供了参考资料。
