甘草酸抑制C57BL/6J小鼠耳蜗炎症减轻顺铂诱导的耳毒性*
2024-03-07张钰倩姜文君盛子轩黄子芸柴文敏曾宪思
张钰倩, 姜文君, 吕 昊, 盛子轩, 黄子芸, 柴文敏, 肖 婧,李 阳, 李 丽, 曾宪思
(嘉兴大学神经科学研究中心,医学院基础医学部,浙江 嘉兴 314000)
顺铂(cisplatin, CDDP)是一种金属化疗药物,广泛用于治疗各种实体肿瘤[1]。但该药具有严重的副作用,约80%接受CDDP治疗的肿瘤患者出现永久性听力损失[2-3]。目前临床上尚无有效预防和治疗其耳毒性的措施。有研究表明,CDDP可通过上调肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)和白细胞介素1β(interleukin 1β, IL-1β)等多种促炎因子,引发炎症反应[4],进而导致内耳细胞凋亡[5]。炎症因子通过破坏血管纹毛细血管完整性和内淋巴离子平衡诱导听力障碍[6]。血管纹血迷路屏障(blood-labyrinth barrier, BLB)将体循环与内淋巴液隔开,调节内耳体液平衡,调控内耳离子转运,阻挡血液中大量物质通过屏障进入内耳,维持内耳微环境稳定[7]。有研究表明,脂多糖诱导的中耳炎因下调紧密连接蛋白表达而破坏耳蜗BLB[8]。
甘草酸(glycyrrhizic acid, GL)是一种三萜皂苷,是中药甘草根部提取物的主要活性成分和甜味成分,具有抗炎作用,能显著降低巨噬细胞白细胞介素类、趋化因子和TNF等十多种炎症介质释放[9-10]。同时,GL还可通过抑制核因子κB(nuclear factor-κB,NF-κB)表达来抑制细胞增殖及诱导细胞凋亡,具有抗肿瘤作用[11]。GL合理长期用药无明显毒副作用[12]。尽管之前已经有研究显示GL可抑制CDDP导致的小鼠肾毒性等毒性副作用[13-15],然而,目前没有关于GL抑制CDDP小鼠耳毒性的报道。本研究探讨了GL对CDDP诱导的小鼠耳毒性的抑制作用及其分子机制,可为GL用于临床防治CDDP化疗导致的听力损失提供参考资料。
材料和方法
1 动物
7周龄的SPF级雄性C57BL/6J小鼠共70只,体重(23±1) g,购自杭州子源实验动物科技有限公司[SCXK(浙)2019-0004]饲养1周,控制温度20~25 ℃,控制湿度50%~70%,自由获取水和食物。
2 主要试剂
CDDP(#153593)和DMSO(#1121E0329)购 自Sigma;GL(#A12HS191107,UV≥95%)购自上海源叶生物技术有限公司;伊文思蓝(Evans blue, EB;#20221111)购自Solarbio;ZO-1抗体(GR3441013-1)、VE-cadherin抗 体(ES106BP06)、IL-1β试 剂 盒(#11618124222)和TNF-α试剂盒(#2411930331)购自Boster;TNF-α抗体(PY19810M)购自Abmart;IL-1β抗 体(#AF5103)购 自Affinity;Alexa Fluor®488(#GR3442006-1)购自Abcam。
3 主要方法
3.1 实验分组与模型制备 将70只小鼠随机分为对照(control)组、5% DMSO组、CDDP组、CDDP+50 mg/kg GL组和CDDP+100 mg/kg GL组,每组各14只。CDDP组腹腔注射CDDP(4 mg·kg-1·d-1)4 d[16],control组腹腔注射等量的生理盐水;CDDP+50 mg/kg GL组和CDDP+100 mg/kg GL组提前1 d按剂量灌胃GL,之后再连续灌胃7 d[17-18]。动物实验按嘉兴大学医学院实验动物伦理委员会实验动物使用指南进行,动物实验伦理批准号(JUMC2023-155)。
3.2 听性脑干反应(auditory brainstem response,ABR)检测 利用ABR听力设备(PA-900,MADSEN)检测不同组C57BL/6J小鼠听力阈值及潜伏期,观察各组小鼠听力变化规律及特点。于隔声屏蔽室内进行常规测试。动物腹腔注射戊巴比妥钠(50 mg/kg)进行麻醉,记录电极插入头皮正中皮下,参考电极插入左耳垂下,接地电极插入鼻尖。刺激声为4、8、16、24和32 kHz的短纯音(升降时间1 ms,持续时间10 ms)。采样频率使用125 kHz以及16-bit数模转换。声音产生以及生物信号的放大及采集均由TDT系统进行。反应电位放大10万倍(80 dB的增益),平均叠加次数200次。低通滤波的截止频率为200 Hz。
3.3 耳蜗石蜡切片制作 ABR测试结束后,每组随机挑选8只小鼠麻醉后断颈脱臼处死,取出耳蜗,4% 多聚甲醛(PFA)固定24 h。PBS洗3次,10%EDTA常温脱钙7 d(每天更换脱钙液)。脱钙后,去除标本余骨,进行梯度脱水透明(70%、80%、90%、100%梯度乙醇、二甲苯溶液Ⅰ,Ⅱ各1 h)。将耳蜗于平行蜗轴方向浸蜡包埋,平行蜗轴方向连续切片(5 μm),最后65℃烤片4 h。
3.4 HE染色 上述石蜡切片脱蜡、水合,苏木素染3~8 min,自来水洗,酸酒精分化5 s,自来水冲洗,0.6% 氨水返蓝,流水冲洗。伊红染液中染色1~3 min。脱水透明后,将切片从二甲苯拿出来稍晾干,封片剂封片。显微镜(JEM-1230透射电子显微镜)镜检观察血管纹形态学变化,图像采集分析。
3.5 EB渗漏检测 ABR测试结束后,每组剩余6只小鼠,置于专用固定器上,拉直尾巴后用酒精棉球轻轻擦拭,用微量注射器抽取2% EB从尾静脉远端平行进针注射。观察到小鼠皮肤迅速变蓝后,用干棉球压迫止血。2 h后麻醉小鼠,脊椎脱臼处死后断头,取出耳蜗,用4% PFA灌注,直至圆窗和前庭窗无血性絮状物冲出;显微镜下将血管纹从耳蜗内侧壁剥离,放入含有4% PFA中4 ℃固定过夜。次日,用PBS冲洗3次,甘油封片。显微镜(CKX53,Olympus)扫描成像并观察血管纹通透性变化。
3.6 免疫组化实验 上述耳蜗石蜡切片,60℃烘箱平衡2 h,进行脱蜡、水合后用枸橼酸钠溶液进行抗原修复。冷却后放入3% H2O2溶液浸泡10 min,擦净后用免疫组化笔圈住组织。滴加10% BSA于37 ℃温箱封闭1 h,PBS洗3×5 min。Ⅰ抗(1:200)湿盒内4℃孵育过夜。37 ℃烘箱中抗原修复30 min,重复上述清洗步骤,Ⅱ抗(1:400)37 ℃孵育30 min,重复上述清洗步骤。DAB染色,苏木素染细胞核,盐酸酒精分化。脱水透明后封片,自然晾干后在正置显微镜(JEM-1230透射电子显微镜)下观察耳蜗血管纹。
3.7 免疫荧光 上述耳蜗石蜡切片,60 ℃烘箱平衡2 h,进行脱蜡、复水后用枸橼酸钠溶液进行抗原修复。冷却后PBS洗3分钟,滴加封闭液在湿盒中37 ℃封闭30 min。用滤纸擦去封闭液后,Ⅰ抗(1∶100)4 ℃孵育过夜。37 ℃烘箱中复温30 min,PBS洗3×5 min。荧光Ⅱ抗(1∶200)37 ℃避光孵育2 h。避光条件下重复上述清洗步骤。用滤纸擦干后,用含DAPI的抗荧光猝灭剂进行封片,自然晾干后于显微镜(Olympus)下观察。
3.8 ELISA 将每组8只小鼠的全血收集于EP管中,376 ×g离心10 min,取上清。确定本次检测所需的已包被IL-1β或TNF-α抗体的酶标板孔数目,分别设标准孔、待测样品孔和空白孔,用样品稀释液分别稀释,盖封板膜后37℃反应90 min。反应后吸取板内液体,每孔加入生物素抗体100 μL,盖封板膜37℃反应60 min。洗涤液洗涤3×1 min。每孔加入ABC工作液100 μL,盖封板膜37℃反应30 min。洗涤液洗涤5×1 min。每孔加入已37℃平衡30 min的TMB显色液100 μL,避光反应18 min,每孔加入终止液100 μL。全波长酶标仪(BIO-RAD)测定430 nm处吸光度(A)值。
4 统计学处理
每组数据重复6次以上,所有实验结果均以均数±标准差(mean±SD)表示。本研究利用ImageJ软件进行图像数据的采集,利用GraphPad Prism软件进行多组数据单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 GL减轻CDDP小鼠的听力损失
如图1所示,与control组相比,CDDP组小鼠各频率ABR波形紊乱,听力阈值显著增高,16 kHz 90 dB SPL下I波潜伏期延长(P<0.05);与CDDP相比,给予GL后小鼠各频率ABR波形分化良好,听力阈值显著下降,I波潜伏期缩短,且CDDP+100 mg/kg GL组改善情况较为显著(P<0.01)。
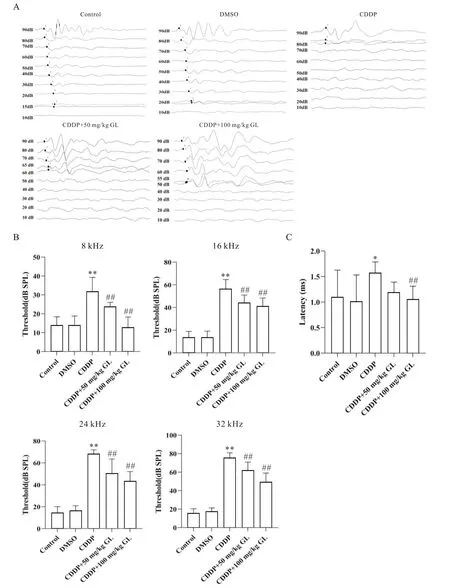
Figure 1.GL reduced the hearing threshold of CDDP mice and shortened the latency of I-wave.A: ABR waveforms of mice in each group under 32 kHz TB sound field intensity.The waveform of the CDDP group is disordered, and the waveform of the CDDP+GL group is neat;B: ABR threshold statistical analysis of mice in each group under 8 k, 16 k, 24 k and 32 kHz TB;C: ABR I wave latency statistical analysis of mice in each group under 16 kHz, 90 dB SPL.Mean ± SD.n=14.*P<0.05,**P<0.01 vs control group;##P<0.01 vs CDDP group.图1 GL降低CDDP小鼠听力阈值,缩短I波潜伏期
2 GL减轻CDDP小鼠耳蜗血管纹的形态损伤
利用HE染色检测小鼠耳蜗血管纹的形态变化。与control组相比,CDDP组小鼠血管纹形态紊乱,胞质减少,空泡增多,细胞核固缩且边界模糊;与CDDP组小鼠相比,GL组小鼠耳蜗血管纹明显整体胞质更饱满,空泡减少,细胞核更完整且边界更清晰,以高剂量组作用效果更为显著,见图2。

Figure 2.GL improved the morphological damage of cochlear veins in the mice of the CDDP group(HE staining).Compared with the control group, the vascular striations in the cochlea of mice in the CDDP group showed changed morphology, decreased cytoplasm, increased vacuoles, nuclear condensation and blurred boundaries.Compared with CDDP group, the vascular striations in the cochlea of mice in the CDDP+GL group showed significantly fuller cytoplasm, reduced vacuoles, more complete nuclei and clearer boundaries.Arrows indicated pyknotic nuclei and stria vascular vacuoles.图2 GL减轻CDDP小鼠耳蜗血管纹的形态损伤
3 GL降低CDDP小鼠血管纹通透性
利用EB染色检测小鼠血管纹通透性,结果显示,control组和DMSO组红色荧光主要集中于耳蜗血管纹毛细血管腔内,几乎无红色荧光渗漏至耳蜗血管纹毛细血管外的间隙内(图3A、B);CDDP组可见大量红色荧光出现在毛细血管外的间隙内,血管内红色荧光微弱,血管渗漏较control组显著增加(P<0.01),见图3C、F;给予GL后,毛细血管外红色荧光较CDDP组显著减少,且CDDP+100 mg/kg GL组改善更为显著(P<0.01),见图3D~F。

Figure 3.GL reduced the vascular permeability in CDDP mice.A~E: EB staining of the cochlear stria vascularis BLB of mice in control, DMSO, CDDP+50 mg/kg GL and CDDP+100 mg/kg GL group;a~e: magnified views of A~E ;F: semi-quantitative analysis of EB staining.Mean±SD.n=6.**P<0.01 vs control group;##P<0.01 vs CDDP group.图3 GL降低CDDP小鼠血管纹通透性
4 GL逆转CDDP小鼠耳蜗血管纹黏附连接蛋白和紧密连接蛋白的表达
利用免疫组化检测小鼠耳蜗血管纹黏附连接蛋白VE-cadherin和紧密连接蛋白ZO-1的表达。与control组相比,CDDP组小鼠耳蜗血管纹上VE-cadherin和ZO-1表达显著降低(P<0.01);与CDDP组相比,CDDP+50 mg/kg GL组小鼠耳蜗血管纹上VE-cadherin和ZO-1表达增加(P<0.01),而CDDP+100 mg/kg GL组VE-cadherin和ZO-1表达增加更为显著(P<0.01),见图4。

Figure 4.GL reversed the expression of VE-cadherin and ZO-1 in cochlear vascular veins of CDDP Mice.A: the expression of VEcadherin in the cochlear stria vascularis of mice in control, DMSO, CDDP+50 mg/kg GL, and CDDP+100 mg/kg GL group;B: the expression of ZO-1 in the cochlear stria vascularis of mice in control, DMSO, CDDP+50 mg/kg GL, and CDDP+100 mg/kg GL group;C: semi-quantitative analysis of VE-cadherin expression;D: semi-quantitative analysis of ZO-1 expression.The expression of ZO-1 and VE-cadherin in cochlear vascular veins of mice in the CDDP group decreased.After intervention of GL, the expression of ZO-1 and VE-cadherin increased.Mean±SD.n=8.**P<0.01 vs control group;##P<0.01 vs CDDP group.图4 GL逆转CDDP小鼠耳蜗血管纹VE-cadherin和ZO-1的表达
5 GL抑制CDDP诱导的IL-1β和TNF-α表达
利用ELISA检测小鼠血清中IL-1β与TNF-α的表达。与control组相比,CDDP组的血清中IL-1β和TNF-α的表达显著升高(P<0.01);与CDDP组相比,CDDP+50 mg/kg GL组IL-1β和TNF-α的表达均显著降低(P<0.01),而CDDP+100 mg/kg GL组IL-1β和TNF-α表达降低更为显著(P<0.01),见图5。

Figure 5.GL inhibited the levels of IL-1β(A) and TNF-α (B) in the serum of CDDP mice.Mean±SD.n=8.**P<0.01 vs control group;##P<0.01 vs CDDP group.图5 GL抑制CDDP小鼠血清中IL-1β和TNF-α的表达水平
利用免疫荧光检测小鼠耳蜗血管纹IL-1β与TNF-α的表达。与control组相比,CDDP组IL-1β与TNF-α荧光强度显著升高(P<0.01);与CDDP组相比,给予GL干预后,IL-1β与TNF-α荧光强度均显著降低(P<0.01),见图6。

Figure 6.GL inhibited the expression levels of IL-1β and TNF-α in the cochlea of CDDP mice.A: the immunofluorescence staining of IL-1β in the cochlear stria vascularis of mice in control, DMSO, CDDP+50 mg/kg GL, and CDDP+100 mg/kg GL group;B: the immunofluorescence staining of TNF-α in the cochlear stria vascularis of mice in control, DMSO, CDDP+50 mg/kg GL and CDDP+100 mg/kg GL group;C: semi-quantitative analysis of IL-1β;D: semi-quantitative analysis of TNF-α.Mean±SD.n=8.**P<0.01 vs control group;##P<0.01 vs CDDP group.图6 GL抑制CDDP小鼠耳蜗血管纹IL-1β和TNF-α的表达水平
讨 论
耳毒性是CDDP治疗肿瘤的主要副作用之一,CDDP可以通过对耳蜗毛细胞、螺旋神经节和血管纹造成不可逆性的损伤而引发听力损失[19-20]。有学说提出抗氧化剂、自由基清除剂可缓解CDDP耳毒性,如硫代硫酸钠、维生素E等[21]。然而,生理条件下细胞内氧化与抗氧化水平处于一种动态平衡状态,一旦失衡,必然引起细胞损害[22],包括维生素E在内的某些抗氧化物质甚至增加肿瘤死亡率[23]。Gentilin等[5]研究表明炎症可能是CDDP导致听力损失的第一个病理性变化。GL具有强大的抗炎作用,能显著降低CDDP导致的肝肾损伤。但其对于CDDP耳毒性是否具有保护作用仍未可知。ABR是一种经声音刺激后出现的瞬态反应,具有可重复性、客观性、稳定性,常用于检测听力[24]。本研究通过ABR测试显示,连续4 d注射CDDP干预后C57BL/6J小鼠ABR波形紊乱,听力阈值明显提高,16 kHz 90 dB SPL下I波潜伏期延长,提示CDDP导致了小鼠听力损失。这与在不同的CDDP耳毒性动物模型中得到的结果一致[25-26]。而GL干预后,小鼠的ABR波形分化良好,听力阈值显著下降,I波潜伏期缩短,提示GL减轻了CDDP所致的听力损失。这些结果表明本研究成功建立了CDDP耳毒性模型,且GL对CDDP导致的小鼠耳毒性表现出治疗作用。本研究是首次关于GL抑制CDDP耳毒性的报道。
血管纹和耳蜗血管结构对内耳听觉功能至关重要[27]。Dubno等[28]研究显示血管纹萎缩引起的内淋巴液电位下降是人类高频听力下降的主要原因。HE染色结果显示,CDDP破坏了耳蜗血管纹形态结构,导致胞质减少、空泡增多,细胞核固缩且边界模糊;而GL干预使小鼠耳蜗血管纹整体胞质更饱满,空泡显著减少,细胞核完整且边界更清晰,表明GL抑制了CDDP引起的耳蜗血管纹损伤。内耳是一个非常稳定的自体调节系统,通过BLB主动或被动转运离子、液体和营养物来维持其平衡状态[29-30]。血管纹中BLB通透性与听觉密切相关[31]。EB染色显示CDDP组微血管内红色荧光微弱,EB大量渗出,提示BLB通透性增加。CDDP+50 mg/kg GL组微血管外有少量红色荧光,EB少量渗出,CDDP+100 mg/kg GL组微血管外间隙内红色荧光渗出显著减少,EB微量渗出。提示GL呈剂量依赖性地降低了CDDP小鼠耳蜗血管纹BLB通透性。血管纹BLB通透性与内皮细胞间紧密连接蛋白和黏附连接蛋白有关,而ZO-1和VE-cadherin是内皮细胞上两个重要的连接蛋白[32-33]。有研究表明,ZO-1和VE-cadherin表达下调可增加BLB的通透性[34]。而GL可通过上调occludin蛋白的表达保护血脑屏障的通透性[35]。本研究免疫组化结果显示,CDDP组小鼠耳蜗血管纹上VE-cadherin和ZO-1表达降低,而GL给药显著逆转了CDDP小鼠耳蜗血管纹VE-cadherin和ZO-1表达,表明GL通过上调CDDP小鼠血管纹内皮细胞间黏附连接蛋白和紧密连接蛋白的表达,从而降低了BLB的通透性。
CDDP耳毒性机制与炎症有关[36]。许多研究表明炎症反应会对耳蜗组织造成损害,从而导致耳蜗退化和永久性的听力损失[37-39]。IL-1β和TNF-α是主要的促炎症细胞因子,由激活的巨噬细胞分泌,是炎症反应的重要标志[40]。一方面,CDDP可诱导巨噬细胞迅速释放炎症因子启动炎症反应[41];另一方面,CDDP可通过激活MAPK信号通路,引起耳蜗中NFκB的活化,上调IL-1β和TNF-α表达[4,42]。我们的ELISA检测结果显示,CDDP组小鼠血清中IL-1β和TNF-α表达水平显著升高,表明CDDP诱导了炎症反应产生。GL干预后CDDP小鼠血清中IL-1β和TNFα表达水平显著降低,表明GL抑制了IL-1β和TNF-α的表达。进一步检测了小鼠耳蜗血管纹内TNF-α和IL-1β的表达水平。结果显示CDDP组小鼠耳蜗血管纹上IL-1β和TNF-α的表达水平显著升高,而GL干预后IL-1β和TNF-α表达水平显著降低,表明GL显著抑制了CDDP小鼠耳蜗血管纹中的炎症反应。有研究表明炎性反应可破坏血管纹和BLB的通透性[43]。因此,GL可能通过抑制CDDP诱导的炎症反应降低了BLB的通透性。
综上所述,本研究报道了GL对CDDP诱导的C57BL/6小鼠的耳毒性的抑制作用。GL可能通过抑制CDDP引起的炎症反应,降低小鼠耳蜗血管纹BLB的通透性,从而减轻CDDP耳毒性引起的小鼠听力损失。
