长链非编码RNA LINC00987通过细胞色素P450途径促进AML细胞凋亡的机制研究*
2024-03-07杨彭月李扬秋余锡宝
杨彭月, 刘 暄, 王 艳, 徐 玲, 李扬秋, 余锡宝
(暨南大学基础医学与公共卫生学院血液学研究所,再生医学教育部重点实验室,广东 广州 510632)
急性髓系白血病(acute myeloid leukemia, AML)是一种由正常干细胞基因改变引起的高度异质性的恶性克隆性疾病,常见于成人,患者往往伴有不同的细胞遗传学和分子生物学表现,基于此,FAB系统归类了8种AML亚型[1-3]。患者多死于骨髓衰竭,目前,诱导化疗、巩固化疗、造血干细胞移植以及新型靶向药物治疗是主要的治疗手段。对于初诊患者,标准治疗方案是“3+7”方案(即3 d的蒽环类药物联合7 d的阿糖胞苷),尽管大部分患者缓解率可达60%~80%,但老年患者尤其伴有合并症或免疫力低下等因素的疾病复发率仍然很高,患者五年生存率不足27%,60岁及以上患者的预后较差,缓解率仅在40%~55%之间[3-4]。因此,研究其发病机制和耐药机制是改善AML治疗效果的关键。
长链非编码RNA(long noncoding RNA, lncRNA)是一类转录本长度大于200nt的RNA分子,不具有编码蛋白质的功能,但能够在遗传水平、转录水平和转录后水平调节基因的表达,与肿瘤的发展、转移及耐药密切相关[5-6],如lncRNA TDRG1可通过调节miR-101-3p促进结直肠癌细胞的增殖、侵袭和迁移[7]。也有文献报道,lncRNA在AML中异常表达,多种lncRNA如HOTAIRM1、CCDC26、LOC646762可以作为AML的预后生物标志物,或用于白血病的分类和危险分级[8-10];Qin等[11]发现lncRNA GAS5可通过抑制Nrf2的表达控制细胞的凋亡与增殖,从而抑制AML疾病的发展。
LINC00987是由人第12号染色体编码的一段lncRNA,在人体骨骼、肺、脑和淋巴结等组织有不同程度的表达,可参与多种疾病,如在骨肉瘤中,LINC00987沉默可通过海绵化miR-376a-5p调节FNBP1的表达进而抑制肿瘤细胞的增殖、迁移和侵袭[12];在肺腺癌中LINC00987/A2M轴可作为肿瘤抑制因子和生物标志物评估患者预后[13];在胶质母细胞瘤中,LINC00987被STAT1激活后通过调节miR-223-3p/FZD4轴诱导肿瘤相关巨噬细胞向M2型极化[14]。也有研究发现,该基因在AML骨髓血中高表达,与AML的预后不良相关[15],但相关机制的报道甚少。因此,本研究将采用慢病毒包装shRNA构建LINC00987稳定敲减的Molm13细胞模型,同时检测该基因在AML细胞中的表达水平,从而进一步研究LINC00987对AML细胞增殖、分化和凋亡等生物学行为的影响及发挥作用的信号通路,明确其在AML病程发展中的作用和机制,为AML诊疗提供新思路。
材料和方法
1 材料
1.1 病历资料 本研究外周血标本来自暨南大学第一附属医院收治的35例AML初诊患者[(56.3±19.4)岁]、8例AML治疗缓解(complete remission,CR)患者[(49.9±20.2)岁]和19例健康人[(50.1±15.7)岁]。其中,35例AML患者接受了随访,直至患者死亡、失访或截止2023年8月。CR、危险分层和总生存期(overall survival, OS)的定义见文献[16]。AML患者依据LINC00987表达水平将其分为LINC00987-Low和LINC00987-High两组,采用SPSS 20.0软件对获得数据进行统计学分析,分析结果见表1。本研究经暨南大学第一附属医院伦理委员会批准(伦理编号:2015伦审批科No.9),并根据赫尔辛基宣言患者均获得知情同意。
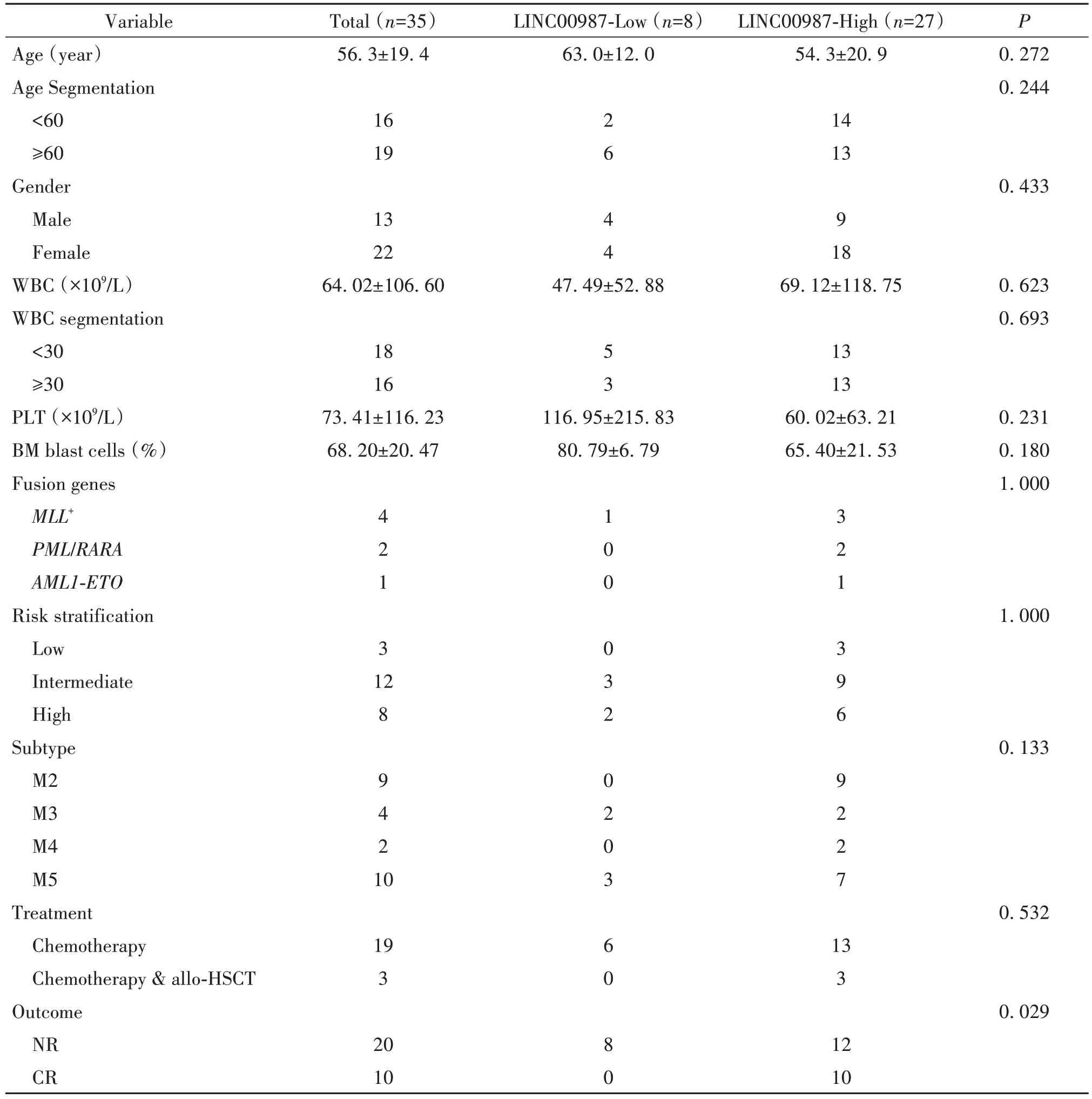
表1 AML患者信息Table 1.Clinical characteristics of patients with AML
1.2 细胞系与主要试剂 人急性髓系白血病细胞株Molm13、MV411和人肾上皮细胞系293T为本实验室长期保存。人淋巴细胞分离液(Ficoll)购自灏洋生物制品科技有限公司;胎牛血清(fetal bovine serum, FBS)、1640培养基、DMEM培养基、TRIzol裂解液购自赛默飞世尔科技公司;RT SuperMix 反转录试剂盒和RT-qPCR试剂盒购自南京诺唯赞生物科技股份有限公司;Annexin V-FITC/PI凋亡检测试剂盒购自杭州联科生物技术股份有限公司;抗肿瘤药物阿糖胞苷(cytarabine, AraC)、阿霉素/多柔比星(doxorubicin, Doxor)和维奈托克(venetoclax, ABT-199)购自Selleck;引物均由北京睿博兴科生物技术有限公司合成。
2 主要方法
2.1 数据库分析 通过Vizome数据库筛选急性髓系白血病的相关资料,分析AML不同亚型及融合基因患者中LINC00987基因的表达差异,利用统计学软件进行数据处理,对LINC00987在急性髓系白血病中的表达差异进行描述,并绘制散点图。在GEPIA数据库筛与LINC00987表达强相关的基因,通过Enrich R平台进行信号通路的富集。
2.2 引物和shRNA的设计与合成 从NCBI数据库查 找LINC00987(Gene ID: 100499405)、CYP11B1(Gene ID: 1584)、CYP2U1(Gene ID: 113612)、CYP2C9(Gene ID:1559)mRNA的序列,并设计合成其特异性检测引物,引物序列见表2。结合LINC00987mRNA序列进行短发夹RNA设计并合成2条LINC00987 shRNA用于后续实验,shRNA及对照(sh-NC)序列见表3。

表2 RT-qPCR引物序列表Table 2.The sequences of the primers for RT-qPCR

表3 shLINC00987 oligo 序列Table 3.shLINC00987 oligo sequences
2.3 细胞培养与模型建立 将液氮保存的Molm13、MV411和293T细胞取出复苏后,加入含10%胎牛血清的1640培养基或DMEM培养基,置于37 ℃、5% CO2环境中培养。待293T细胞增殖状态良好时将其接种到10 cm培养皿中,在细胞生长至密度60%~75%时进行转染,8 h后更换成完全培养基,24 h或48 h后收集慢病毒上清液。取2×105处于对数期生长的Molm13细胞培养接种于6孔板,加入适量上述收集的病毒血清,48 h后荧光显微镜观察感染效率,待感染效率达10%时,用嘌呤霉素筛选感染成功的Molm13细胞并获得稳定细胞株,建立目的基因敲减细胞模型,继续培养用于后续实验。RT-qPCR鉴定慢病毒过表达效果。
2.4 RT-qPCR检测RNA表达水平 取对数生长期Molm13、MV411细胞,离心收集细胞,TRIzol法提取总RNA、反转录合成cDNA。以cDNA为模板、RTqPCR法检测细胞中LINC00987及CYP11B1、CYP2U1和CYP2C9 mRNA表达水平。以β-actin为内 参 照,计 算LINC00987、CYP11B1、CYP2U1和CYP2C9相对表达量,绘制熔解曲线,最终数据以2-ΔΔCt方法进行分析。实验重复3次。
2.5 细胞凋亡检测 Annexin V-APC/PI法检测细胞凋亡。LINC00987稳定敲减的Molm13细胞株接种于6孔板中,用5 μmol/L阿糖胞苷处理细胞,24 h后低速离心收集细胞,使用100 μL 1×Binding buffer重悬细胞,每管加入0.5 μL AnnexinV-APC和1 μL PI避光孵育5 min,使用流式细胞仪进行检测,实验重复3次。FlowJo10软件分析结果。
3 统计学处理
采用SPSS 20.0软件进行统计学分析,GraphPad Prism 8.0.2软件进行绘图。使用Fisher确切概率法(样本量<40)对分类资料进行差异比较,Mann-WhitneyU检验或t检验对连续变量进行差异比较。利用Kaplan-Meier法绘制生存曲线,采用log-rank法进行检验。各实验均独立重复3次,以均数±标准差(mean±SD)表示正态分布数据。以P<0.05为差异有统计学意义。
结 果
1 LINC00987在AML中低表达,且低表达LINC00987与AML患者预后差相关
我们首先通过RT-qPCR检测LINC00987在AML外周血单个核细胞的mRNA表达水平,结果显示,与健康人和AML-CR患者相比,LINC00987在AML患者外周血单个核细胞和AML细胞系中低表达,差异具有统计学意义(P<0.01),见图1A。采用X-tile软件计算临界值将AML患者分为LINC00987低表达组和LINC00987高表达组,结果显示,低表达LINC00987的AML患者预后较差,差异具有统计学意义(P=0.003),其中LINC00987低表达组的1年OS率仅有12.5%,而LINC00987高表达组的1年OS率达48.1%,见图1B。此外,利用Vizome数据库分析发现,LINC00987在FAB-AML分类(M0、M1、M2、M3、M4、M5和M7)患者和伴有不同融合基因(CBFB
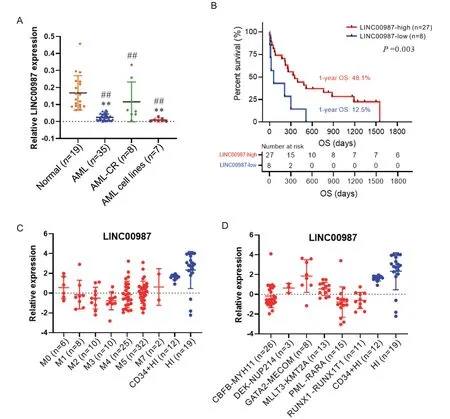
Figure 1.Detection of LINC00987 expression in AML.A: LINC00987 expression was analyzed by RT-qPCR;B: prognostic analysis of patients with high and low LINC00987 expression by X-tile software;C: LINC00987 expression in different AML subtypes was analyzed by Vizome database;D: LINC00987 expression in different fusion genes of patients with AML was analyzed by Vizome database.Mean±SD.**P<0.01 vs normal group;##P<0.01 vs AML-CR group.图1 LINC00987在AML中表达情况的检测
MYH11、DEK-NUP214、GATA2-MECOM、MLLT3-KMT2A、PML-RARA和RUNX1-RUNX1T1)的患者中表达水平略有差异但均低表达,其中在M3亚型和伴有PML-RARA融合基因的患者中较为明显,而在M7亚型和伴有GATA2-MECOM融合基因的患者中相对较弱,见图1C、D。
2 LINC00987的表达与AML临床特征的关系
我们随后分析LINC00987的表达与临床特征的关系。如表1所示,低表达LINC00987的患者经治疗后缓解的情况差于高表达LINC00987的患者,差异具有统计学意义(P<0.05);两组患者在年龄、年龄分组、性别、白细胞、白细胞分组、血小板、骨髓原始细胞比例、融合基因分型、风险分组、治疗方式方面的差异无统计学意义(P>0.05),但这有可能是我们的标本量小、统计数据部分有缺失。
3 LINC00987在抗肿瘤药物处理AML细胞株后表达增加
AraC、Doxor、三 氧 化 二 砷(arsenic trioxide,ATO)、ABT-199是可用于治疗AML的抗肿瘤药物[2,17-20]。利用 不 同浓 度(0 μmol/L /0.1 μmol/L /1 μmol/L /10 μmol/L)的AraC、Doxor、ATO、ABT-199分别处理Molm13、MV411两种AML细胞株,于24 h后收集,RT-qPCR检测LINC00987的表达水平。结果显示,四种抗肿瘤药物均可显著诱导AML细胞系的LINC00987表达(P<0.05),见图2。以上结果提示:LINC00987可能参与肿瘤细胞死亡相关信号通路的激活或介导细胞死亡抵抗。
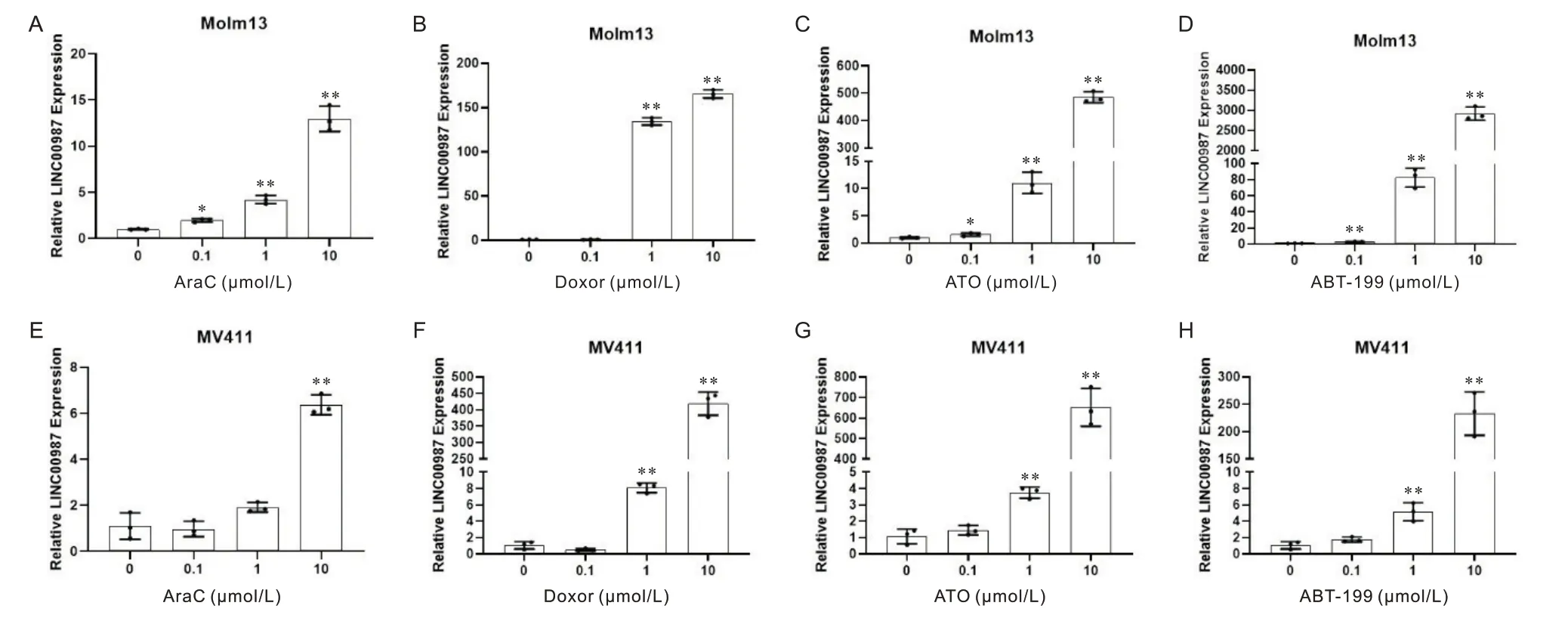
Figure 2.LINC00987 expression in AML cell lines treated with chemotherapy drugs.A: LINC00987 expression in Molm13 cells treated with AraC;B: LINC00987 expression in Molm13 cells treated with Doxor;C: LINC00987 expression in Molm13 cells treated with ATO;D: LINC00987 expression in Molm13 cells treated with ABT-199;E: LINC00987 expression in MV411 cells treated with AraC;F: LINC00987 expression in Molm13 cells treated with Doxor;G: LINC00987 expression in Molm13 cells treated with ATO;H: LINC00987 expression in Molm13 cells treated with ABT-199.Mean±SD.n=3.*P<0.05, **P<0.01 vs 0 mol/L group.图2 AML细胞株经化疗药物处理后LINC00987的表达情况
4 下调LINC00987表达抑制AraC诱导的AML细胞凋亡
为研究LINC00987在AML中的生物学功能,我们设计了两条不同的LINC00987 shRNA(对照组为sh-NC),并通过293T细胞包装慢病毒及感染Molm13获得LINC00987稳定敲减的AML细胞株,之后予以抗肿瘤药物AraC(5 μmol/L)处理,通过Annexin V/PI双染色检测细胞凋亡情况。与对照组相比,LINC00987敲减抑制了AraC诱导的AML细胞凋亡(P<0.05),见图3。表明LINC00987在促进AML细胞凋亡中具有重要作用。
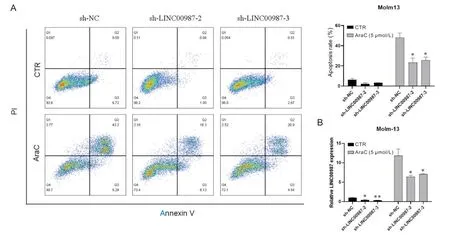
Figure 3.Effect of LINC00987 knockdown on AraC-induced apoptosis of AML cells.A: effect of LINC00987 knockdown on AraC-induced apoptosis of Molm13 cells;B: effect of LINC00987 knockdown on AraC-induced LINC00987 expression levels.Mean±SD.n=3.*P<0.05, **P<0.01 vs sh-NC group.图3 敲减LINC00987对AraC诱导AML细胞凋亡的影响
5 LINC00987通过细胞色素P450(cytochrome P450, CYP450)介导的氧化应激途径促进AraC诱导的AML细胞凋亡
进一步探究LINC00987参与AML细胞存活与凋亡的相关上下游分子或信号通路,我们在GEPIA数据库筛选出了与LINC00987表达强相关的前200个基因,然后通过Enrich R平台进行信号通路的富集,发现LINC00987共表达基因可富集于CYP450介导的氧化应激通路,见图4A,且LINC00987的表达与CYP450家族基因CYP11B1、CYP2U1和CYP2C9的表达水平呈正相关,见图4B。此外,RT-qPCR检测发现AraC可显著诱导Molm13细胞CYP11B1、CYP2U1和CYP2C9的mRNA表达(P<0.05),通过shRNA敲减LINC00987表达后以上mRNA表达被抑制(P<0.05),见图4C。综上所述,LINC00987可能通过CYP450介导的氧化应激途径促进AraC诱导的AML细胞凋亡。

Figure 4.Signaling pathway enrichment of LINC00987-coexpressed genes and detection of CYP450 family gene expression levels.A: coexpressed genes of LINC00987 were screened using GEPIA database and enriched with Enrich R platform;B: correlation analysis of LINC00987 and CYP450 family gene CYP11B1, CYP2U1 and CUP2C9 expression levels;C: CYP11B1,CYP2U1 and CUP2C9 mRNA expression in Molm13 cells treated with AraC and LINC00987 knockdown.Mean±SD.n=3.*P<0.05, **P<0.01 vs 0 mol/L group;#P<0.05 vs shNC group.图4 LINC00987共表达基因信号通路富集及CYP450家族基因表达水平检测
讨 论
本研究发现LINC00987在AML外周血单个核细胞低表达,且低表达LINC00987的患者预后较差,与此相反的是,Liu等[21]发现,与健康骨髓样本相比,AML患者骨髓细胞中LINC00987表达升高,与HS-5健康人骨髓基质细胞相比,THP-1,KG-1,HL-60,U937等AML细胞株LINC00987的表达也显著升高;Li等[15]发现,AML患者骨髓样本LINC00987高表达与预后不良相关。上述相反的结果可能与本研究对象为患者外周血样本,而Li和Liu的研究对象为骨髓样本有关,且相应的对照组细胞来源也存在差异,此外,鉴于AML异质性较大,不同患者的遗传学和分子生物学表现常存在差异,且基因的表达往往受多种因子调控,因此上述研究结果的差异可能与样本细胞组成及处理等诸多原因有关。后续研究需要进一步明确LINC00987在AML病人骨髓和外周血中的表达差异及其与患者生存预后的关系。
进一步研究发现抗肿瘤药物AraC、Doxor、ATO和ABT-199在抑制AML细胞存活的同时可显著诱导AML细胞系表达LINC00987,提示LINC00987可能参与了药物诱导的细胞凋亡过程。进一步应用AraC处理LINC00987稳定敲减AML细胞系发现细胞凋亡受到抑制,表明LINC00987在AML发生发展中发挥着抑癌基因的作用,与AML化疗疗效密切相关。
进一步通过GEPIA数据库和Enrich R平台对LINC00987共表达基因进行筛选和信号通路富集,发现这些基因可富集于CYP450介导的氧化应激通路/网络,且LINC00987的表达与CYP450家族基因CYP11B1、CYP2U1和CYP2C9的表达水平呈正相关。CYP450是一类主要存在于肝脏和其他组织内质网中的血红蛋白偶联单加氧酶,需要辅酶NADPH和分子氧的共同参与来发挥作用,是主要的药物和毒物代谢酶系统。一方面CYP450活性的变化可以引起细胞周围环境毒素代谢水平改变,另一方面,CYP450在氧化还原过程中可不断产生活性氧(reactive oxygen species, ROS)调节氧化应激过程,进而影响细胞的存活与凋亡[22-23]。值得注意的是,ROS在肿瘤的发生发展中通常发挥着双刃剑的作用,低至中等水平的ROS可以通过诱导细胞增殖、DNA突变和基因组不稳定性等促进肿瘤的发生;高水平的ROS可通过氧化应激促进细胞凋亡和严重的细胞损伤,而癌细胞常在肿瘤发展的早期通过压力选择不断进化 出 抗氧 化 机 制[24]。陈 宗 云 等[25]的 研 究 发 现,CYP450家族中重要的药物代谢酶CYP2B6在CYP2B6 785 A>G位点携带等位基因G可能会增加AML患病风险。有趣的是,AML化疗药物如AraC和ABT-199是CYP450的底物[26-27],AraC可诱导ROS水平增高,激活AML肿瘤细胞的氧化应激,并引发细胞凋亡,从而发挥抗肿瘤作用[28]。这一点与我们的研究结果相符,提示AraC通过促进LINC00987表达进而增高了CYP450活性,通过产生大量ROS促进AML细胞死亡。进一步研究发现,下调LINC00987的表达可抑制阿糖胞苷诱导的CYP11B1、CYP2U1和CYP2C9的mRNA表达,提示LINC00987可能通过CYP450介导的氧化应激途径促进阿糖胞苷诱导的AML细胞凋亡。但LINC00987的表达情况与ROS水平是否直接或间接相关,有待进一步研究。
综上,本研究通过体外实验证实了阿糖胞苷可以激活AML细胞LINC00987的表达,LINC00987可能通过调控CYP450家族基因CYP11B1、CYP2U1和CYP2C9的表达,启动氧化应激途径促进AML细胞凋亡,提示LINC00987有望成为AML靶向治疗的新靶点,并作为预后标志物帮助评估患者预后,但仍需进一步的验证。
