牛磺酸对骨骼肌缺血/再灌注损伤大鼠肌浆网功能的影响
2018-11-02李燕王吉先赵新卫刘军
李燕,王吉先,赵新卫,刘军
(青岛西海岸新区中心医院,山东青岛266555)
骨骼肌缺血/再灌注(I/R)损伤是临床常见的病理生理过程,常见于断肢(指)再植、骨筋膜间室综合征、四肢大血管损伤等血流重建后,轻者可引起骨骼肌局部损伤,重者可导致肢体坏死,甚至危及生命。骨骼肌I/R损伤的发生机制迄今尚未完全阐明。肌浆网是细胞内Ca2+的贮库,其功能是参与肌肉兴奋收缩偶联并维持肌细胞胞质Ca2+稳态。目前认为,骨骼肌细胞内Ca2+超载及肌浆网功能障碍是骨骼肌I/R损伤发生的重要环节。牛磺酸是神经、肌肉、腺体等可兴奋组织内含量最丰富的自由氨基酸,具有调节细胞内Ca2+稳态、清除氧自由基、抑制膜脂质过氧化等多种生物学功能[1]。以往研究证实,牛磺酸对I/R导致的大鼠心、脑组织以及骨骼肌损伤有确切防治作用[2~5]。2014年6月~2015年8月,我们观察了牛磺酸对大鼠I/R损伤时骨骼肌肌浆网功能的影响,并探讨其防治骨骼肌I/R损伤的可能机制。现报告如下。
1 材料
实验动物:雄性Wistar大鼠18只,SPF级,10周龄,体质量336~350 g,由北京大学医学部实验动物科学部提供,动物许可证号:SYXK(京)2011-0039。所有大鼠分笼饲养,自由摄食饮水,环境温度20~25 ℃、湿度(50±5)%,光照12 h明暗交替。主要仪器:QuantulusTMGCT 6220液体闪烁计数仪,美国Perkin Elmer公司;Optima XPN低温超速离心机,美国Beckman Coulter公司,MultiskanTMFC酶标仪、Evolution 600紫外-可见分光光度,美国Thermo Fisher Scientific公司。PMSF、Leupeptin、A23187、PEP、Caffeine、Ryanodine,美国Sigma公司;3H-Ryanodine,美国NEN DuPout公司;45CaCl2,英国Amersham公司。其余试剂均为国产分析纯。
2 方法与结果
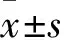
2.2 骨骼肌I/R损伤模型制备及牛磺酸干预 所有大鼠适应性饲养1周,随机分为对照组、模型组、牛碱酸组,每组6只。模型组、牛磺酸组参照Lamboley等[6]的方法建立骨骼肌I/R模型:术前禁食12 h,戊巴比妥钠60 mg/kg腹腔注射麻醉,用止血带扎紧双后肢根部以阻断血流2 h,松开止血带恢复血流2 h。牛磺酸组制模前30 min经左颈外静脉注射0.6 mol/L的牛磺酸1.5 mL/kg,模型组经左颈外静脉注射生理盐水1.5 mL/kg。对照组仅经左颈外静脉注射生理盐水1.5 mL/kg,不制备骨骼肌I/R损伤模型。
2.3 牛磺酸对骨骼肌I/R损伤大鼠组织水肿及氧化应激相关指标的影响 模型组与牛磺酸组再灌注2 h,对照组同时间,腹腔注射麻醉后,完整分离左侧股内侧肌群,切取一半称湿重,90 ℃彻底干燥后称干重,计算湿重/干重,以此反映组织水肿情况。取另一半左侧股内侧肌群,用预冷生理盐水制成10%肌组织匀浆,分别采用硫代巴比妥酸法检测脂质过氧化产物丙二醛(MDA)含量,化学比色法检测髓过氧化物酶(MPO)活性,以此评估骨骼肌I/R后氧化应激反应情况。结果显示,模型组与牛磺酸组骨骼肌湿重/干重及MDA含量、MPO活性均明显高于对照组,但牛磺酸组上述指标均明显低于模型组(P均<0.01)。结果见表1。
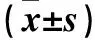
表1 各组骨骼肌湿重/干重及氧化应激损伤相关指标比较
注:与对照组比较,*P<0.01;与模型组比较,#P<0.01。
2.4 牛磺酸对骨骼肌I/R损伤大鼠肌浆网功能影响的观察
2.4.1 骨骼肌肌浆网制备 参照McGrew等[7]的方法制备骨骼肌肌浆网。分离各组双侧腓肠肌和比目鱼肌,0~4 ℃生理盐水冲洗,加入7.5倍体积的Buffer A(含20 mmol/L焦磷酸钠,20 mmol/L PBS,1 mmol/L MgCl2,0.303 mol/L蔗糖,0.5 mmol/L EDTA,76.8 nmo1/L aprotinin,1.1 μmol/L Leupeptin、0.23 mmol/L PMSF),冰浴中剪碎肌肉组织,Polytron匀浆器中匀浆,1 000 r/min离心15 min,上清液经纱布过滤,沉淀再复溶于5倍体积的Buffer A中,重复上述过程,合并2次滤液,16 000 r/min离心30 min,弃上清,沉淀用5倍体积的Buffer C(含0.6 mol/L KCl,0.303 mol/L蔗糖,pH 7.0)重悬,冰上孵育30 min,45 000 r/min离心30 min,弃上清,沉淀即为骨骼肌肌浆网。
2.4.2 牛磺酸对肌浆网Ca2+-ATPase活性的影响 参照Fauconnier等[8]的方法检测Ca2+-ATPase活性。分别取三组上述制备的肌浆网50 μg,加入Ca2+-ATPase活性反应液(A溶液:50.0 mmol/L Histidine,5 mmol/L MgCl2,111 mmol/L KCl,0.001 mmol/L CaCl2;B溶液:50.0 mmol/L Histidine,5 mmol/L MgCl2,111 mmol/L KCl,1.1 mmol/L EDTA,3.3 μg/mL A23187;使用前A溶液与B溶液1∶1混合,再加入新鲜配置的3.33 mmol/L PEP和15 U/mL PK)1 mL,37 ℃孵育10 min,加入ATP溶液0.1 mL(30 mmol/L Na2-ATP)启动反应,37 ℃孵育20 min终止反应。采用定磷法检测肌浆网Ca2+-ATPase活性。计算Ca2+-ATPase活性=样品磷(Pi)含量/(反应蛋白量×反应时间×1 000)。结果显示,对照组肌浆网Ca2+-ATPase活性为(2.24±0.13)μmol Pi/(mg protein·min),模型组为(1.35±0.16)μmol Pi/(mg protein·min),牛磺酸组为(1.79±0.23)μmol Pi/(mg protein·min)。模型组与牛磺酸组肌浆网Ca2+-ATPase活性均明显低于对照组,但牛磺酸组肌浆网Ca2+-ATPase活性明显高于模型组(P均<0.01)。
2.4.3 牛磺酸对肌浆网3H-Ryanodine受体结合的影响 采用同位素标记法。取三组上述制备的肌浆网150 μg,加入结合缓冲液(含1 mol/L KCl,25 μmol/L CaCl2,10 mmol/L HEPES,pH 7.4),调整体积至180 μL,再加入10 nmol/L3H-Ryanodine 20 μL,总体积200 μL。非特异性配体结合管的孵育液含50 μmol/L未标记的Ryanodine 20 μL,37 ℃孵育2 h,用预冷的缓冲液冲洗3次终止反应,Millipore抽滤后,将滤膜干燥,置于2 mL闪烁液中。采用液体闪烁计数仪检测3H-Ryandine的配体-受体最大结合量(Bmax)以及解离常数(Kd)。结果显示,模型组与牛磺酸组肌浆网3H-Ryandine配体-受体的Bmax均明显低于对照组,Kd均明显高于对照组(P均<0.01);但牛磺酸组肌浆网3H-Ryandine配体-受体的Bmax明显高于模型组,Kd明显低于模型组(P均<0.01)。见表2。
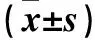
表2 各组肌浆网3H-Ryandine配体-受体Bmax、Kd比较
注:与对照组比较,*P<0.01;与模型组比较,#P<0.01。
2.4.4 牛磺酸对肌浆网45Ca2+摄取能力的影响 采用同位素标记法。取三组上述制备的肌浆网120 μg,加入Ca2+摄取反应液(含0.1 mmol/L KCl,5 mmol/L MgCl2,50 μmol/L CaCl2,20 mmol/L HEPES,pH 7.1)120 μL,再加入45CaCl23.7 kBq,总反应体系200 μL,混匀后加入500 mmol/L Na2-ATP 2 μL,37 ℃孵育30 min,加入冷冲洗液(含0.1 mol/L KCl,0.6 mol/L Tris-HCl,pH 7.2)混匀,2 min后终止反应。在Millipore上抽滤到0.45 μm滤膜上,取出滤膜干燥,置于闪烁液中。参照Fauconnier等[8]的方法,采用液体闪烁计数仪检测45Ca2+的放射活性,并换算成肌浆网45Ca2+摄取量。结果显示,对照组肌浆网45Ca2+摄入量为(0.74±0.10)nmol/mg protein,模型组为(0.53±0.05)nmol/mg protein,牛磺酸组为(0.60±0.04)nmol/mg protein。模型组与牛磺酸组肌浆网45Ca2+摄入量均明显低于对照组(P均<0.01);但牛磺酸组肌浆网45Ca2+摄入量明显高于模型组(P<0.05)。
2.4.5 牛磺酸对肌浆网45Ca2+释放能力的影响 采用同位素标记法。取三组上述制备的的肌浆网120 μg,按照2.4.4方法加入Ca2+摄取反应液,37 ℃孵育30 min,12 000 r/min离心5 min,弃上清,沉淀用PBS洗涤后,加入Ca2+释放液(含80 mmol/L KCl,20 mmol/L Tris-HCl,10 mmol/L caffeine,pH 6.8)400 μL,分别于1、3、5 min各取100 μL,采用液体闪烁计数仪检测45Ca2+的放射活性,并换算成骨骼肌肌浆网45Ca2+释放量。结果显示,三组加入反应液1 min时45Ca2+释放速度比较无明显统计学差异(P均>0.05);模型组与牛磺酸组加入反应液3、5 min时45Ca2+释放量均明显低于对照组(P均<0.01),但牛磺酸组45Ca2+释放量明显高于模型组(P均<0.01)。见表3。
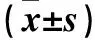
表3 各组肌浆网45Ca2+释放量比较
注:与对照组比较,*P<0.01;与模型组比较,#P<0.01。
3 讨论
细胞内钙超载是I/R损伤发生的重要机制。当I/R发生时,细胞膜上Ca2+泵以及Na+/Ca2+交换体活性异常导致细胞内Ca2+超载,引起细胞功能和结构受损。肌浆网作为细胞内Ca2+的贮库,其功能是参与肌肉兴奋收缩偶联并参与维持肌细胞胞质Ca2+稳态,Ca2+稳态主要通过调节Ca2+的摄取与释放而实现[5,6]。Ca2+的摄取由Ca2+泵(Ca2+-ATPase)的活性决定,而Ca2+的释放则与肌浆网上存在的一种特定Ca2+释放通道Ryanodine受体有关。Ryanodine受体可介导肌肉兴奋-收缩偶联过程中Ca2+的释放[7]。已有研究显示,I/R损伤导致肌浆网Ca2+的摄取与释放异常,改善肌浆网功能可起到缓解I/R损伤的作用[9,10],进一步研究发现,肌浆网Ryanodine受体缺陷是心肌I/R过程中Ca2+超载的重要原因[8,11]。
牛磺酸是一种β-氨基酸,其性质稳定,在体内由蛋氨酸代谢生成,在骨骼肌和心肌中含量比较丰富。研究证实,牛磺酸具有调节渗透压、抗细胞凋亡、调节膜稳定性、调节氧化应激、参与离子跨膜转运以及参与线粒体蛋白合成等多种生物学功能[1,2,12]。牛磺酸不仅可拮抗I/R引起的心肌细胞凋亡、脂质过氧化,降低I/R引起的心律失常,还可稳定线粒体膜电位、抑制线粒体损伤[13~15]。目前认为,牛磺酸主要通过激活Akt或PKCε信号通路启动对I/R损伤的拮抗作用,同时通过促进eNOS表达及磷酸化促进NO生成,拮抗I/R损伤[1]。
I/R所致组织损伤的一个典型变化是组织淤血水肿。骨骼肌湿重/干重可反映I/R后组织淤血水肿情况。本研究结果显示,模型组骨骼肌出现明显淤血水肿,而牛磺酸组淤血水肿减轻,证实外源性牛磺酸可减轻骨骼肌I/R损伤。引起组织I/R损伤的机制多与氧化应激反应有关,故本研究观察了骨骼肌组织MDA含量和MPO活性。结果显示,模型组与牛磺酸组骨骼肌MDA含量和MPO活性均明显高于对照组,而牛磺酸组MDA含量和MPO活性明显低于模型组,提示骨骼肌I/R后出现了明显的氧化应激反应,而牛磺酸能明显抑制脂质过氧化物引起的氧化应激损伤,与其对心肌I/R损伤的保护效应一致。为进一步探索牛磺酸的保护机制,本研究观察了大鼠骨骼肌肌浆网对Ca2+摄取和释放的影响。结果显示,模型组肌浆网45Ca2+摄入量和45Ca2+释放量均明显低于对照组,而牛磺酸组明显优于模型组,说明牛磺酸可改善肌浆网Ca2+摄取和释放的功能,从而减轻细胞内Ca2+稳态失衡,减轻I/R损伤。进一步研究显示,模型组3H-Ryandine配体-受体的Bmax显著减少,而配体-受体的Kd明显增加,牛磺酸组上述指标均有一定程度改善,提示骨骼肌I/R损伤后肌浆网RyR通道异常,导致肌浆网Ca2+摄取和释放平衡被破坏,从而影响骨骼肌兴奋收缩偶联,导致骨骼肌功能障碍;而牛磺酸通过促进I/R损伤时肌浆网Ca2+-ATPase的活性,增加Ca2+摄取,同时也可增加Ryandine受体通道活性,提高Ca2+释放速度而调节细胞内Ca2+平衡。已有文献证实,牛磺酸的代谢产物牛黄胆酸也可作用于Ca2+泵,促进Ca2+回收,调节细胞内Ca2+水平;牛磺酸及其代谢产物还可通过直接激活Ryanodine受体而保护骨骼肌兴奋收缩偶联的正常运转,恢复骨骼肌的收缩功能[16]。
综上所述,牛磺酸对大鼠骨骼肌I/R损伤具有一定防治作用,其机制可能与抑制氧化应激反应以及调节肌浆网Ca2+稳态有关。
