广东炭步芋头软腐病病原菌的分离鉴定与生物防治
2023-12-10罗燕羽黄绍力刘绍钦魏利国刘伟光张木清
罗燕羽 黄绍力 刘绍钦 魏利国 刘伟光 张木清
(广州市农业科学研究院 广东广州 510335)
槟榔芋[Colocasia esculenta(L).Schott]又称香芋,是芋属魁芋类粮菜兼用的作物,其食用部位为植株根部球茎,皮粗糙,剖面呈槟榔纹,名“槟榔芋”[1]。其肉质细腻,风味独特,除鲜食外,还被加工成芋圆、芋片、芋条、芋粉等,作为原料或配料也可添加到面包、奶茶、冰淇淋等食品中[2]。近几年,随着奶茶市场的发展,对槟榔香芋的需求量更是逐年攀升。广东炭步文冈槟榔香芋是广东省广州市花都区炭步镇的特产,其母芋(芋头)呈直桶状,体大形美,芋肉带紫红色槟榔花纹。煮食时,香味四溢,口感酥松、粉嫩、香醇。因其个头大、肉质粉、味香、绵软等特点而闻名海内外[3-4]。近几年随着种植结构的调整,炭步镇种植槟榔芋的面积逐年扩大,槟榔芋已成为该镇主栽蔬菜品种之一。然而长期的无性繁殖与连作导致了芋头植株病虫害严重、种性退化等,尤其是近几年,发病率达到80%以上,到最后采收的商品率仅为15%左右,严重影响了炭步芋头产业的发展[5]。
芋软腐病是一种细菌性土传病害,其病原菌随种芋和植物残体在土壤中越冬,借助雨水、灌溉水、小型昆虫活动及农事活动传播,从植株伤口侵入致病[6]。植株受害后,叶柄基部初呈水渍状病斑,叶片萎蔫,迅速软化,最后导致全株枯萎倒伏[7]。为探明芋软腐病的致病菌,陈潇航等[8]对广西荔浦芋头的软腐病致病菌进行了分离鉴定,证明其病原菌为Pectobacterium carotovorumsubsp.carotovorum。董晓菲等[9]也从福鼎市芋园中发病的槟榔芋中分离到了胡萝卜软腐果胶杆菌。不同的是Huang 等[10]从乐昌槟榔香芋病株中分离到的病源菌为Dickeya fangzhongdai。芋软腐病是一种细菌性土传病害,地下害虫、连作、芋种及苗床消毒等皆与芋软腐病的发生有关[11]。为防治芋软腐病菌,吴天长等[12]利用可杀得2000 和多菌灵等药剂进行防治;戴立智等[13]和何耀明[14]提出通过水旱轮作、种芋消毒和化学药剂72%农用链霉素等多种方法进行综合防治。为防止土壤微生态环境恶化,赵江涛等[15]从芋头表面粘附的土壤中分离筛选到解淀粉芽孢杆菌BGP14,其对胡萝卜软腐果胶杆菌具有强大的拮抗活性,认为能够有效防治贮藏期芋头软腐病;董晓菲等[16-17]从芋头根际土壤中分离筛选出了9 株对槟榔芋软腐病具有拮抗效果的细菌和2 株真菌性拮抗菌:藤仓镰刀菌和塔宾曲霉,认为其对芋软腐病有较好的生防应用价值。
尽管已有研究对芋软腐病的致病菌进行分离鉴定,但不同的地区其气候、土壤、栽培环境等皆不同,病原菌的种类、为害情况、发生特征及流行规律等也存在差异,且目前也尚未见到有关于广东炭步地区芋软腐病致病菌的相关报道,因此,开展广东炭步地区芋头软腐病的致病菌的分离鉴定与防治研究具有重要意义。本研究采用组织研磨法进行病原菌分离,基于科赫氏法则进行致病性测定,根据形态学观察、16S rDNA 序列与系统进化树分析及生物学特性测定明确致病菌种类,并将芋脱毒种苗与微生物菌剂及生物炭相结合进行芋软腐病的防治研究,以期为今后芋软腐病的大田防治提供参考。
1 材料与方法
1.1 材料
1.1.1 试材 患病槟榔芋头球茎样品取自广州市花都区炭步文冈香芋合作社芋头种植园。
1.1.2 供试培养基 营养琼脂(NA)、LB 培养基,广州环凯微生物有限公司;平衡复合肥、高氮型复合肥和高钾型复合肥,雅苒挪威国际有限公司;“第一细”微生物菌剂,广东植物龙生物技术有限公司;生物炭为玉米秸秆炭,河南立泽环保科技有限公司。
1.2 方法
1.2.1 病原菌的分离纯化 采集发病的植株,用自来水清洗干净,用灭菌剪刀剪下病健交界处0.5 cm3的组织块,先经75%酒精表面消毒30 s,无菌水清洗3 次,然后用0.1%升汞消毒1 min,无菌水清洗5 次,再用无菌剪刀将消毒好的组织块剪碎置于研钵中;加5 mL 无菌水研磨,静置10 min 充分释放菌液后,用灼烧过的接种环蘸取菌液,划线至NA 培养基平板上,将平板倒置于37℃的恒温培养箱中培养1~2 d;待平板上长出菌落,挑取单菌落接种至新的NA 培养基平板上,置于28℃的恒温培养箱中倒置培养1~2 d,如此重复3~5 次进行菌落纯化;将获得纯培养的菌株挑取单菌落于LB 液体培养基中,28℃振荡培养12 h,再分别取500 µL 菌液和500 µL 的30%甘油于2 mL 离心管中混合均匀,液氮速冻后置-80℃冰箱中保存备用。
1.2.2 病原菌致病性鉴定 将纯化后的单菌落接种于LB 液体培养基上,于28℃振荡培养12~24 h后,离心去上清,加无菌水悬浮细菌,用A600光密度比浊法制备浓度为10 cfu/mL 的菌悬液。

图1 芋软腐病发病症状
(1)离体球茎组织块侵染:准备健康的文冈槟榔香芋球茎,去皮洗净后切成3 cm×2 cm×1 cm的组织块,于超净工作台中用 75%酒精消毒1 min,无菌水清洗 3 次后再用0.1%升汞消毒1 min,无菌水清洗5 次,用无菌滤纸吸干表面水分后切成2 cm×1.5 cm×0.5 cm 的组织块,放入放有无菌滤纸的无菌培养皿中,吸取20 µL 菌悬液注入组织块表面,滤纸用无菌水润湿,以注入无菌水的组织块为空白对照,设3 次重复,于37℃恒温培养箱中培养24 h,观察记录组织块发病情况。
(2)田间活体回接:用灭菌解剖针蘸菌悬液后在盆栽健康芋头植株基部上刺3 次,每10 株为一组处理,共3 组。接种后每天观察,以无菌水作为对照,每个处理设3 重复。
取发病的芋头球茎按照1.2.1 的方法重新分离病原菌,并与最初接种的菌落表型进行比较,以确定导致病害发生的病原菌是否为最初接种的菌落。
1.2.3 病原菌形态学鉴定 形态学观察:将重新分离的病原菌单菌落接种于NA 平板培养基上,于28℃恒温培养箱48 h 后,观察、记录菌株的大小、表面形状、颜色、粘度、透明度。采用革兰氏染色法,在油镜下观察菌体形态。
1.2.4 病原菌分子鉴定 将纯化后的单菌落接种于LB 液体培养基上,于28℃振荡培养12 h 后,取3 mL 菌液送至广州艾基生物有限公司进行16S rDNA 的菌种鉴定。
1.2.5 病原菌生物学特性测定
(1)pH 对病原菌生长的影响 分别配置pH为3.0、4.0、5.0、6.0、7.0、8.0 和9.0 的LB 液体培养基,于 28℃恒温下培养 36 h,测定其OD600值。
(2)病原菌对不同碳源的利用 在基础培养液(KH2PO41.36 g,K2HPO40.5 g,CaCl2·2H2O 0.1 g,NaH2PO4·H2O 0.5 g,MgSO4·7H2O 0.2 g,纯水1 000 mL)中分别加入1%的葡萄糖、蔗糖、麦芽糖、甘露醇和乳糖,将pH 调到7.0 后进行灭菌;取0.1 mL 病原菌菌液于3 mL 的培养液中,28℃恒温下培养36 h,测定其OD600值。
(3)其他主要生理生化特性 对菌株进行明胶液化、产H2S、氧化酶、5%NaCl 生长、37℃下生长、吲哚等生理生化指标试验。
1.2.6 生物防治 研究表明,利用芋脱毒种苗进行栽培可减少病虫害的发生。本研究以炭步芋头脱毒种苗的假植杯苗为试材进行芋软腐病的生物防治技术研究,具体栽培方式如下。
定植:3 月初进行定植,以粗颗粒泥炭土:珍珠岩=7:1(V:V)的比例为基础种植基质装入45 cm×40 cm 无纺布种植袋的1/5 后,添加100 g的平衡复合肥为底肥,然后继续添加基质至种植袋的3/5 处,将脱毒种苗种植入装好基质的种植袋中,种植深度为没过脱毒种苗杯土表面即可,种植好的袋苗放置于苗床架上,以保证土壤和水等不被外源病菌侵染。
施肥:追肥分多次施入,第一次追肥在幼苗第一片新叶展开时(种植后约半个月),每株施高氮型复合肥30 g;生长旺盛前期(5 月中旬)进行第二次追肥,每株施平衡型复合肥50 g;生长旺盛中期(6 月中旬)进行第三次追肥,每株施高钾型复合肥50 g;生长旺盛后期(7 月中旬)进行第四次追肥,每株施高钾型复合肥50 g,生长旺盛末期(8 月中旬)进行第五次追肥,每株施高钾型复合肥50 g。
水分:采用滴灌进行浇水,于每天5:00~9:00进行,保持水分湿润。
覆土:分2 次进行覆土,配合施肥同时进行。第1 次培土在生长旺盛前期,施肥后向种植袋中添加粗颗粒泥炭土至4/5 处;第2 次培土在生长旺盛中期,施肥后向种植袋中添加粗颗粒泥炭土至与种植袋齐平。
试验设定如下6 组处理开展研究,每组处理30 株,3 个重复,以探明对广东炭步芋头软腐病最佳的防治技术。
①对照:利用芋脱毒种苗的假植杯苗正常栽培为对照。
②A+B+C+D+E:假植杯苗定植栽培前一周浇施一次“第一细”微生物菌剂800 倍液(A);在定植的基础种植基质中拌入种植基质体积为1%的生物炭(B);定植时以‘第一细’微生物菌剂800 倍液作为定根水进行浇施至全部湿润(C);定植一个月后沿着芋植株基部浇施致病菌株的菌悬液100 mL(D);每间隔半个月后浇施一次“第一细”微生物菌剂800 倍液,连续浇施3 次(E)。栽培管理与对照组相同。
③A+B+D+E;④A+D+E;⑤D+E;⑥D。
2 结果与分析
2.1 田间发病症状
患病植株叶片萎焉变黄、叶柄倒折,易拔起,芋球茎内部组织软化腐败,出现黏液且有腐烂恶臭味,有些病株球茎内部组织干燥发黑,有空洞,植株地上部分枯萎死亡(图1)。
2.2 菌株的致病性鉴定
将分离的菌株活化制备成菌悬液回接到槟榔香芋离体块茎组织,24 h 后,只有3 株菌株对芋头球茎发生致病现象,命名为T2202、S1905 和S1910。接种菌株T2202 的组织块呈灰白色,表面粘稠并散发臭味;接种菌株S1905 和S1910 的组织块呈黄褐色,黄褐色处变软并散发臭味(图2);对照组接种无菌水的组织块没有发生变化。由田间活体回接的试验结果可知,被菌株T2202侵染的球茎从伤口处向内逐渐腐烂,发臭;而被菌株S1905 和S1910 侵染的球茎与菌株T2202 侵染的球茎不同,其球茎组织则呈干燥发黑、空洞的情况(图3),亦有臭味。

图2 菌株对离体球茎组织块的致病性

图3 菌株对田间活体球茎的致病性
对接种发病后的球茎按照方法1.2.1 方法重新分离病原菌,结果分离到的菌落在形态上和最初接种的菌落完全一致。根据柯赫法则,分离的菌株T2202 是引起炭步芋头腐烂的病原菌,菌株S1905 和S1910 为炭步芋头的另一致病菌。
2.3 病原菌形态观察
通过组织研磨法从病植体的块茎中分离纯化得到分离物,通过柯赫氏法则验证,有3 株可使健康植株致病。由图4~6 可知,3 株致病菌株的形状、颜色及质地等均相似,菌落为圆形,灰白色,质地均匀、边缘整齐,中央稍隆起,表面光滑湿润,菌株有臭味,革兰氏染色呈阴性。菌株T2202 的菌落较小,直径1~2 mm,菌株S1905和S1910 的直径大小为2~3 mm。

图4 菌株T2202 菌落形态(A)及革兰氏染色(B)

图5 菌株S1905 菌落形态(A)及革兰氏染色(B)
2.4 分子鉴定
提取菌株T2202、S1905 和S1910 的DNA,使用16S rDNA 引物进行PCR 扩增,经电泳检测得到明亮清晰条带,分子大小约1 500 bp。根据广州艾基生物有限公司菌种鉴定结果,菌株T2202 分子大小为1 540 bp,菌株S1905 分子大小为1 432 bp,菌株S1910 分子大小为1 428 bp。将测序结果与NCBI 上相似序列经BLAST 对比,并用MEGA5.1 的邻接法构建系统进化树。从图7和8 可以看出,菌株T2202 与胡萝卜软腐果胶杆菌胡萝卜软腐亚种Pectobacterium carotovorumsubsp. carotovorumstrain KNU28212 的亲缘关系最近,相似度达到99%。菌株S1905 与假单胞菌属菌株Pseudomonas entomophlaL48 的亲缘关系最近,相似度达到98%;菌株S1910 与恶臭假单胞菌Pseudomona putidastrain SKG-1 的亲缘关系最近,相似度达到100%。

图7 菌株T2202 的PCR 凝胶电泳图(A)和16S rDNA 系统进化树(B)

图8 菌株S1905 和S1910 的PCR 凝胶电泳图(A)和16S rDNA 系统进化树(B)
2.5 生物学特性测定
从表1 可以看出,菌株T2202 与S1905 和S1910 可生长的pH 均在5~9,pH 低于4 时不能生长,最佳生长pH 为7.0。菌株T2202 可发酵葡萄糖、蔗糖、麦芽糖、甘露醇、乳糖产酸,菌株S1905 和S1910 只能发酵葡萄糖产酸。3 个菌株皆可在5.0%的NaCl 培养液和37℃下生长,氧化酶反应和吲哚反应呈阳性(表2),明胶液化呈阴性。菌株T2202 可产生H2S;菌株S1905 和S1910 不产生H2S。
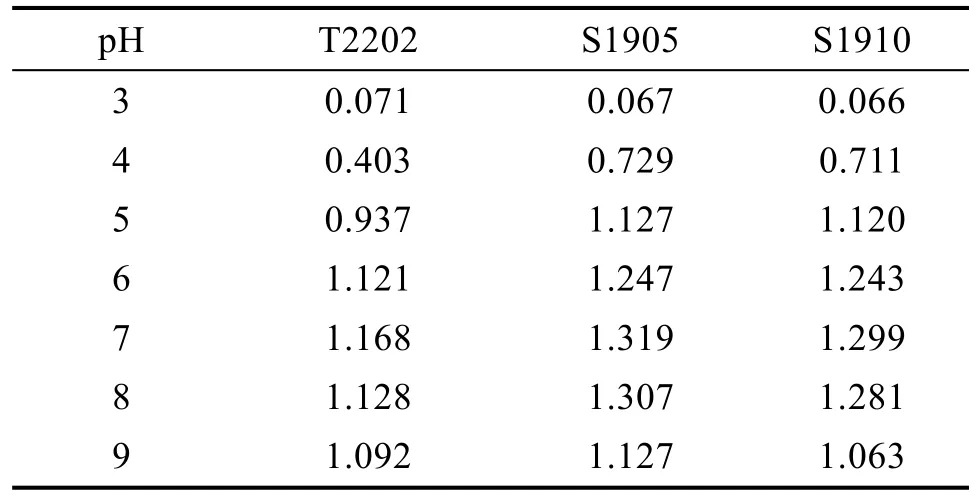
表1 pH 对病原菌生长的影响

表2 菌株的主要生理生化特征
2.6 防治技术
由表3 可知,处理组②③和④的发病率控制在20%以内,其中最好的是处理组②,接种T2202菌株的发病率仅为3.30%,接种菌株S1905 和S1910 的没有发生病害。可见,在使用脱毒种苗的前提下,定植前浇施“第一细”微生物菌剂对芋软腐病可以起到很好的防治作用,在定植时再浇施“第一细”微生物菌剂,并在基质中添加生物炭可进一步防治。定植后再浇施“第一细”微生物菌剂也可起到一定的作用,但作用效果较差。
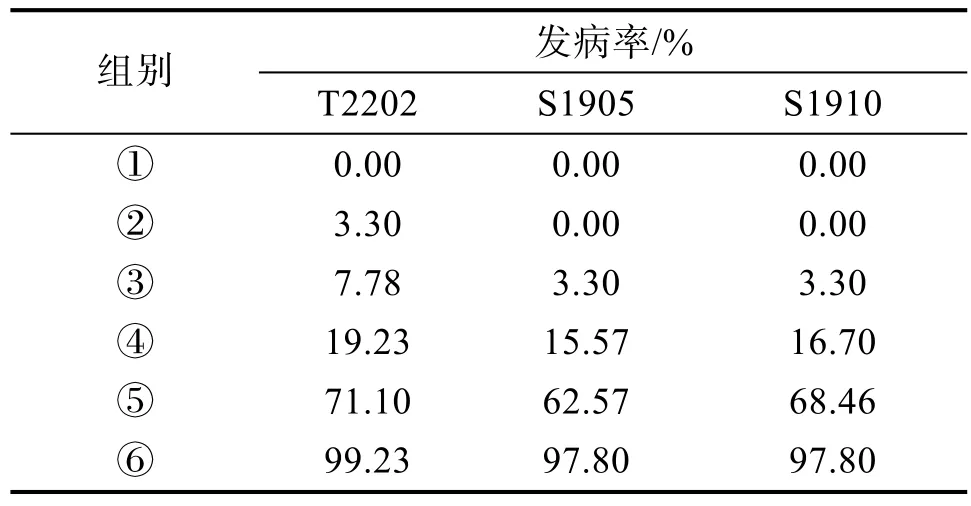
表3 不同处理对芋软腐病发病率的影响
3 讨论与结论
3.1 讨论
细菌性软腐病是目前众多植物的一种重要病害,可使半夏[18]、魔芋[19]、马蹄莲[20]、春羽[21]等植物发生软腐病,亦是目前为害广东炭步芋头最严重的病害,发病率可到80%以上,严重影响了芋头的品质和产量,给芋农们带来了巨大的经济损失。有研究表明,芋软腐病是由胡萝卜软腐果胶杆菌引起的[8-9],但Huang 等[10]分离的致病菌为D. fangzhongdai。本研究从广东炭步文冈香芋中分离到的菌株T2202 为胡萝卜软腐果胶杆菌,该菌株的形态特征和生物学特性与董晓菲等的研究结果[16-17]一致,最适生长pH 为7.0,可在5.0%的NaCl 培养液和37℃下生长,氧化酶反应和吲哚反应呈阳性,可利用葡萄糖、甘露醇产酸,明胶液化呈阴性,而陈潇航等[8]分离鉴定的菌株其明胶液化呈阳性。离体块茎组织侵染和田间活体回接的结果也表明,菌株T2202 对芋头具有致病性。科赫法则表明,分离的菌株是引起炭步芋头腐烂的病原菌。
假单胞菌是自然界分布最广的微生物之一,在环境生物修复、生物防治、生物转化等领域逐步体现出越来越重要的作用,但有些种类也是植物常见的致病菌[22]。本研究从炭步文冈槟榔香芋病株中不仅分离到了胡萝卜软腐果胶杆菌T2202,还分离到了假单胞菌S1905 和S1910。从形态学和生物学特性上看,菌株S1905 和S1910与假单胞菌属的特征描述表现一致[23-24],氧化酶阳性,只能利用葡萄糖产酸,不能利用蔗糖、麦芽糖、甘露醇、乳糖产酸,明胶液化呈阴性。16S rDNA 系统进化树分析结果表明,菌株S1905 与假单胞菌属菌株P. entomophlaL48 的相似度达到98%;菌株S1910 与恶臭假单胞菌P. putidastrain SKG-1 的相似度达到100%。P. entomophla是一种虫媒性假单胞菌,目前对其的研究较少,主要是代谢物质分子以及对果蝇的毒杀作用等方面[25],未有其对植物病害方面的相关报道。恶臭假单胞菌是假单胞菌属一种常见的条件致病菌,广泛存在于土壤、水体和植物当中,是目前鱼类的一种常见致病菌,亦是食用菌的病原之一[26]。本研究分离的菌株S1910 吲哚反应与杨圆圆等[27]分离的鱼类恶臭假单胞菌不同,而与韩金鑫[23]从碳酸盐岩表面分离的相同,其吲哚反应呈阳性。据报道,假单胞菌可引起百合软腐病[28]、马蹄莲块茎软腐病[29-30]、柑橘枯萎病[31]、烟草野火病[32]、印度橡胶榕叶枯病[33]等,引起芋头发生病害属首次报道,具体致病种及其致病机理有待进一步研究。
对植物病害的传统防治主要是针对病害本身,通过施用化学农药[6-7]或进行轮作、间作[14]等方法以达到防治病害的目的。生物防治被认为是目前比较有前景的控制措施,在芋软腐病的防治上亦有学者[15]通过筛选拮抗菌进行防治,但主要也只是在室内筛选等试验阶段,未能形成配套的技术应用于实际生产当中。研究表明,微生物菌剂在改善土壤环境、培肥地力、提高肥料利用率、促进植物生长、增强抗性、减少病虫害发生等方面表现出了良好的效果[34]。生物炭可以使土壤环境中微生物的多样化性增加,改变土壤的物理特性,促进作物生长[35-36]。王莹乐等[37]利用生物炭与生防菌Bacillus amyloliquefaciensP4 结合防控香芋软腐病取得了良好的生防效果。本研究在王莹乐等[37]的基础上,以芋植物健康为关注点,用脱毒种苗进行栽培可保证种源无病害;在芋头脱毒种苗假植时,人工提前补充微生物菌剂,可在芋头根际形成优势菌群;定植时再补充微生物菌剂,并在土壤中添加生物炭,可增加土壤有益微生物含量,抑制病原菌,还可调整根际微生物菌群结构,改良土壤微生态;定植后再定期向土壤中补充微生物菌剂,保证了有益微生物对病害的控制能力。
3.2 结论
本研究从广东炭步文冈槟榔香芋中共分离到3 株致病菌,菌株T2202 属胡萝卜软腐果胶杆菌,为广东炭步文冈槟榔香芋软腐病的致病菌;菌株S1905 和S1910 属假单胞菌,可导致芋头内部空洞、干燥发黑。将脱毒种苗与微生物菌剂、生物炭结合,通过土壤微生物菌群重建和根际微生物调控可以有效控制芋头软腐病的发生,该技术对软腐病的防治不仅安全有效,还可保证芋头的品质,可进一步示范推广。
