lncRNA SNHG1靶向miR-145-5p/PDCD4轴对缺氧/复氧诱导的心肌细胞凋亡的影响
2023-11-01李红英张会军王军穆秀娥李红方
李红英,张会军,王军,穆秀娥,李红方
(河北医科大学第一医院心脏外科,石家庄 050031)
急性心肌梗死 (acute myocardial infarction,AMI)是一种常见的心血管疾病,死亡率高,及时、有效的再灌注是减少AMI后心肌损伤的重要治疗选择[1]。研究[2]报道,心肌细胞凋亡、氧化应激参与了AMI的发病机制。心肌缺氧/复氧 (hypoxia/reoxygenation,H/R) 损伤与心血管外科手术高度相关[3],预防H/R诱导的心肌细胞凋亡可能为AMI提供新的治疗策略。越来越多的研究表明,长链非编码RNA (long noncoding RNA,lncRNA) 在包括AMI在内的心血管疾病的生理和病理过程中发挥重要作用。核内小RNA宿主基因1 (small nucleolar RNA host gene 1,SNHG1) 作为一种lncRNA,已有研究[4]显示,下调SNHG1可以抑制心肌缺血/再灌注损伤小鼠的心肌细胞凋亡。但其具体分子机制尚不完全明确。研究[5]显示,过表达miR-145通过靶向下调程序性细胞死亡因子4 (programmed cell death 4,PDCD4) 抑制H/R诱导心肌细胞凋亡。生物信息学分析显示,SNHG1与miR-145-5p存在靶向关系。而SNHG1能否通过调控miR-145-5p/PDCD4轴影响H/R诱导的心肌细胞凋亡尚不明确。因此,本研究主要探讨了SNHG1对H/R诱导的心肌细胞凋亡的影响及其作用的分子机制。
1 材料与方法
1.1 材料
1.1.1 细胞:大鼠心肌细胞H9c2购自浙江美森细胞科技有限公司。
1.1.2 主要试剂:SNHG1小干扰RNA (si-SNHG1) 及其阴性对照 (si-NC)、miR-145-5p模拟物 (miR-145-5p mimic) 及其阴性对照 (mimic NC)、miR-145-5p抑制物 (miR-145-5p inhibitor) 及其阴性对照 (inhibitor NC),均购自赛默飞世尔科技 (中国) 有限公司;CCK-8试剂盒,购自上海继和生物科技有限公司;Annexin V-FITC/PI细胞凋亡试剂盒,购自无锡云萃生物科技有限公司;大鼠超氧化物歧化酶 (superoxide dismutase,SOD)、丙二醛 (malondialdehyde,MDA) 试剂盒,购自上海广锐生物科技有限公司;兔源一抗PDCD4、caspase 3、Bcl-2、Bax、GAPDH及过氧化物酶标记的羊抗兔IgG二抗,均购自英国Abcam公司。
1.2 方法
1.2.1 细胞培养、H/R细胞模型的构建及实验分组:将H9c2细胞在含有10%胎牛血清的DMEM培养基中培养,培养条件为37 ℃和5% CO2。
H/R细胞模型的构建[6]:将H9c2细胞在缺氧培养箱 (37 ℃、94% N2、1% O2、5% CO2) 中培养24 h,再在复氧培养箱 (37 ℃、95%空气、5% CO2) 中复氧1 h。
将H9c2细胞分为H/R组、si-NC组、si-SNHG1组、mimic NC组、miR-145-5p mimic组、si-SNHG1+inhibitor NC组、si-SNHG1+miR-145-5p inhibitor组。上述各组细胞进行相应的转染处理48 h后,再进行缺氧24 h、复氧1 h。si-NC组、si-SNHG1组、mimic NC组、miR-145-5p mimic 组H9c2细胞分别转染si-NC、si-SNHG1、mimic NC、miR-145-5p mimic,si-SNHG1+inhibitor NC组H9c2细胞同时转染si-SNHG1和inhibitor NC,si-SNHG1+miR-145-5p inhibitor组H9c2细胞同时转染si-SNHG1和miR-145-5p inhibitor。同时取正常培养的H9c2细胞作为对照组 (NC组)。上述处理结束后,收集各组细胞用于后续实验。
1.2.2 实时定量PCR (real-time quantitative PCR,qRTPCR) 检测细胞中SNHG1、miR-145-5p表达:使用TRIzol试剂提取H9c2细胞中的总RNA,将总RNA逆转录为cDNA,以cDNA为模板进行定量PCR。GAPDH、U6分别作为SNHG1、miR-145-5p内参。采用2-ΔΔCt法计算SNHG1、miR-145-5p相对表达量。引物序列:GAPDH,正向5’-CACCATTGGCAATGAGCGGTTC-3’,反向 5’-CACCATTGGCAATGAGCGGTTC-3’;SNHG1,正向5’-AACTTCCCATAACTCCACTTC-3’,反向5’-ACAACCAACACAGCAACAC-3’;miR-145-5p,正向5’-TCGGCAGGGTCCAGTTTTCCCA-3’,反向5’-CTCAAC TGGTGTCGTGGA-3’;U6,正向5’-CTCGCT TCGGCAGCACA-3’,反向5’-AACGCTTCACGAATTT GCGT-3’。
1.2.3 CCK-8检测细胞增殖:将各组H9c2细胞以1×104/孔的密度接种到96孔板中,培养48 h后,将10 μL CCK-8 试剂添加到96孔板的每个孔中,将96孔板在37 ℃下孵育1.5 h,使用酶标仪在450 nm处读取光密度值 (optical density,OD)。
1.2.4 流式细胞术检测H9c2细胞凋亡:将各组H9c2细胞用预冷的PBS洗涤2次,重悬于1×结合缓冲液中,然后在室温下依次与 5 μL Annexin V-FITC、5 μL碘化丙啶在黑暗条件下孵育5 min。使用流式细胞仪检测细胞凋亡。
1.2.5 试剂盒检测H9c2细胞中SOD活性、MDA含量:按照试剂盒说明书检测H9c2细胞中SOD活性、MDA含量。
1.2.6 Western blotting检测H9c2细胞中PDCD4、Bcl-2、caspase 3、Bax蛋白表达:RIPA裂解缓冲液裂解H9c2细胞并提取蛋白质,蛋白质经定量、电泳、转膜、封闭后,将膜与一抗PDCD4 (1 ∶2 000)、Bcl-2 (1 ∶2 000)、caspase 3 (1 ∶2 000)、Bax (1 ∶1 000)、GAPDH(1 ∶2 000) 在4 ℃下孵育过夜。随后,将膜与辣根过氧化物酶标记的山羊抗兔二抗 (1 ∶1 000) 在室温下孵育 1 h,再次用TBST缓冲液洗涤膜3次,加入ECL试剂,观察蛋白质条带,使用ImageJ 分析蛋白灰度值。1.2.7 双荧光素酶报告基因实验:分别构建SNHG1野生型质粒 (SNHG1-WT) 和突变型质粒 (SNHG1-MUT),将SNHG1-WT和SNHG1-MUT分别与mimic NC或miR-145-5pmimic共转染于H9c2细胞,48 h后观察荧光素酶活性变化。
分别构建PDCD4野生型质粒 (PDCD4-WT) 和突变型质粒 (PDCD4-MUT),将PDCD4-WT和PDCD4-MUT分别与mimic NC或miR-145-5pmimic共转染于H9c2细胞,48 h后观察荧光素酶活性变化。
1.3 统计学分析
采用SPSS 22.0软件处理数据。计量资料以x-±s表示,多组数据的比较采用单因素方差分析,进一步2组数据的比较采用SNK-q检验。P< 0.05为差异有统计学意义。
2 结果
2.1 各组H9c2细胞中SNHG1、miR-145-5p、PDCD4蛋白表达比较
与NC组比较,H/R组H9c2细胞中SNHG1、PDCD4蛋白表达升高,miR-145-5p表达降低 (P< 0.05)。与H/R组、si-NC组比较,si-SNHG1组H9c2细胞中SNHG1、PDCD4蛋白表达降低,miR-145-5p表达升高 (P<0.05)。与H/R组、mimic NC 组比较,miR-145-5p mimic组H9c2细胞中SNHG1表达变化的差异无统计学意义 (P> 0.05),miR-145-5p表达升高,PDCD4蛋白表达降低 (P< 0.05)。与si-SNHG1组、si-SNHG1+inhibitor NC组比较,si-SNHG1+miR-145-5p inhibitor组H9c2细胞中SNHG1表达变化的差异无统计学意义 (P> 0.05),miR-145-5p表达降低,PDCD4蛋白表达升高 (P<0.05)。见图1、表1。
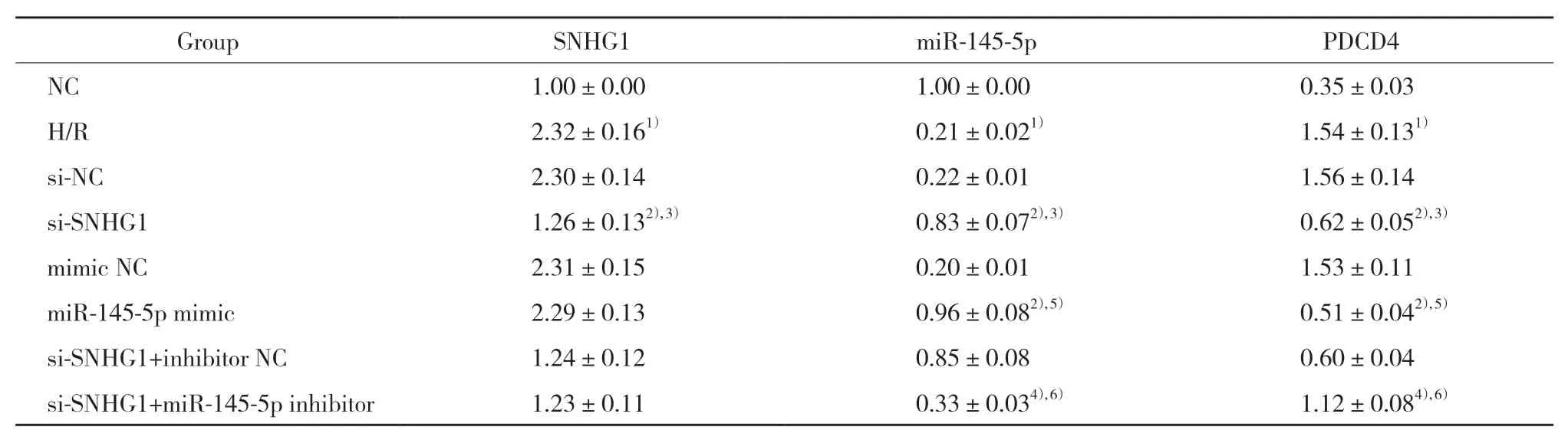
表1 各组细胞中SNHG1、miR-145-5p、PDCD4蛋白表达比较 (n = 6)Tab.1 Cellular expressions of SNHG1,miR-145-5p,and PDCD4 protein by study group (n = 6)
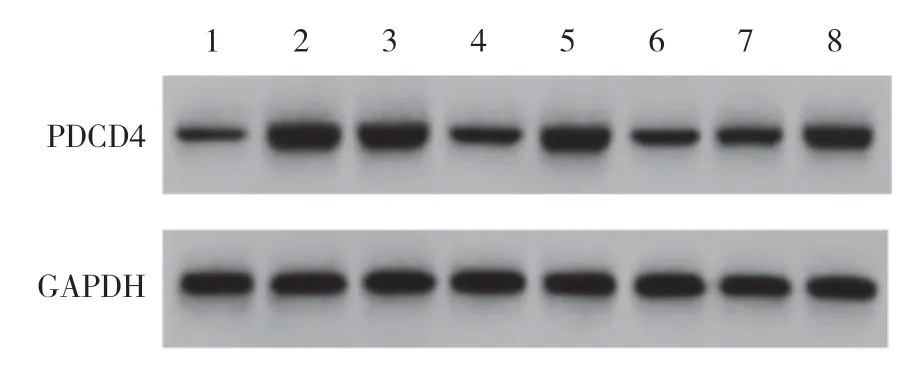
图1 Western blotting检测各组细胞中PDCD4蛋白的表达Fig.1 PDCD4 protein expression detected by Western blotting in each study group
2.2 各组H9c2细胞增殖能力比较
NC组、H/R组、si-NC组、si-SNHG1组、mimic NC组、miR-145-5p mimic组、si-SNHG1+inhibitor NC组、si-SNHG1+miR-145-5p inhibitor组H9c2细胞OD450值分别为0.87±0.07、0.31±0.02、0.29±0.01、0.69±0.05、0.30±0.03、0.72±0.06、0.70±0.06、0.38±0.03。与NC组比较,H/R组H9c2细胞OD450值降低 (P< 0.05);与H/R组、si-NC组比较,si-SNHG1组H9c2细胞OD450值升高 (P< 0.05);与H/R组、mimic NC组比较,miR-145-5p mimic组H9c2细胞OD450值升高 (P< 0.05);与si-SNHG1组、si-SNHG1+inhibitor NC组比较,si-SNHG1+miR-145-5p inhibitor组H9c2细胞OD450值降低 (P<0.05)。
2.3 各组H9c2细胞凋亡能力比较
NC组、H/R组、si-NC组、si-SNHG1组、mimic NC组、miR-145-5p mimic组、si-SNHG1+inhibitor NC组、si-SNHG1+miR-145-5p inhibitor组H9c2细胞凋亡率分别为 (3.79±0.14) %、 (18.86±1.15) %、 (18.72±1.12) %、(6.78±0.34) %、 (18.80±1.07) %、 (5.49±0.26) %、(6.69±0.29) %、 (13.34±1.17) %。与NC组比较,H/R组H9c2细胞凋亡率升高 (P< 0.05);与H/R组、si-NC组比较,si-SNHG1组H9c2细胞凋亡率降低 (P< 0.05);与H/R组、mimic NC组比较,miR-145-5p mimic组H9c2细胞凋亡率降低 (P< 0.05);与si-SNHG1组、si-SNHG1+inhibitor NC组比较,si-SNHG1+miR-145-5p inhibitor组H9c2细胞凋亡率升高 (P< 0.05)。见图2。
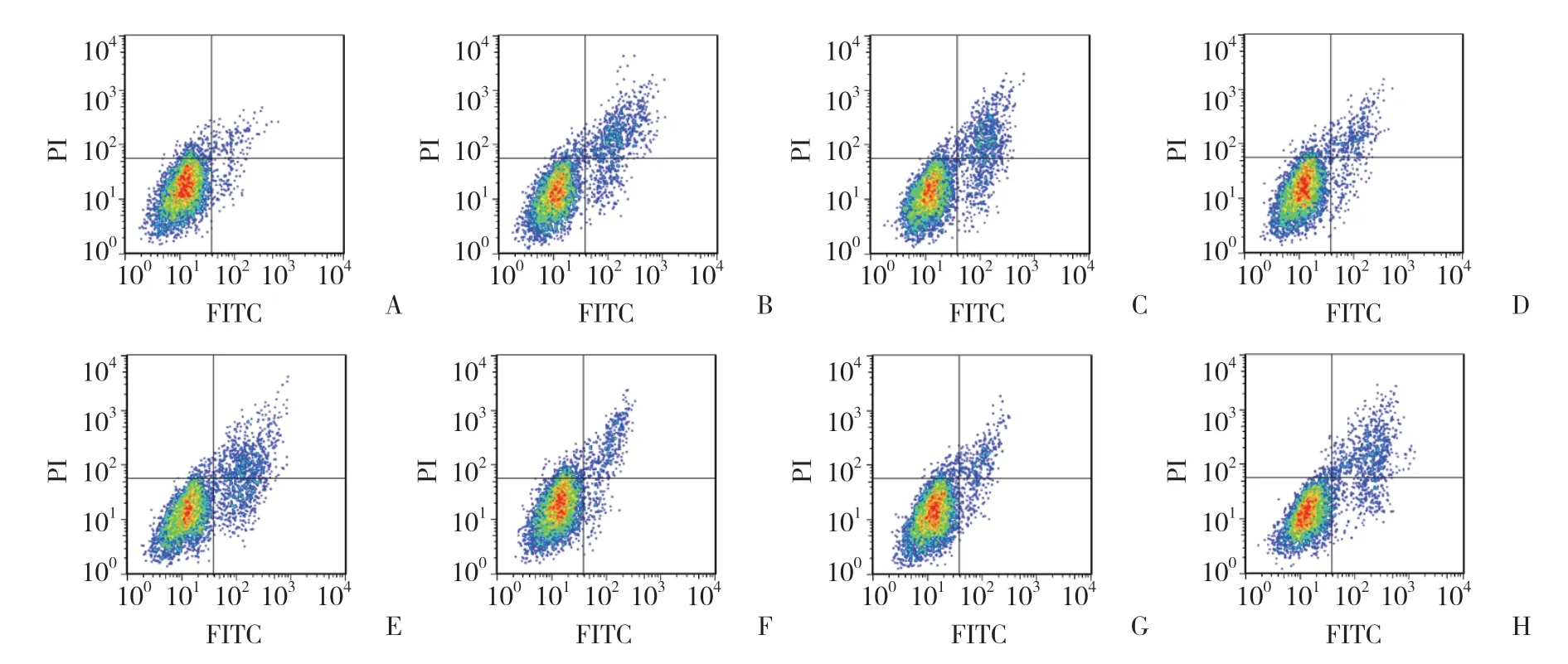
图2 流式细胞术检测H9c2细胞凋亡Fig.2 H9c2 cell apoptosis detected by flow cytometry
2.4 各组H9c2细胞中SOD活性、MDA含量比较
与NC组比较,H/R组H9c2细胞中SOD活性降低,MDA含量升高 (P< 0.05);与H/R组、si-NC组比较,si-SNHG1组H9c2细胞中SOD活性升高,MDA含量降低 (P< 0.05);与H/R组、mimic NC 组比较,miR-145-5p mimic 组H9c2细胞中SOD活性升高,MDA含量降低(P< 0.05);与si-SNHG1组、si-SNHG1+inhibitor NC组比较,si-SNHG1+miR-145-5p inhibitor组H9c2细胞中SOD活性降低,MDA含量升高 (P< 0.05)。见表2。

表2 各组H9c2细胞中SOD活性、MDA含量比较 (n = 6)Tab.2 SOD activity and MDA content of H9c2 cells by study group (n = 6)
2.5 各组H9c2细胞中Bax、Bcl-2、caspase 3蛋白表达比较
与NC组比较,H/R组H9c2细胞中Bax、caspase 3蛋白表达升高,Bcl-2蛋白表达降低 (P< 0.05);与H/R组、si-NC组比较,si-SNHG1组H9c2细胞中Bax、caspase 3蛋白表达降低,Bcl-2蛋白表达升高 (P<0.05);与H/R组、mimic NC 组比较,miR-145-5p mimic组H9c2细胞中Bax、caspase 3蛋白表达降低,Bcl-2蛋白表达升高 (P< 0.05);与si-SNHG1组、si-SNHG1+inhibitor NC组比较,si-SNHG1+miR-145-5p inhibitor组H9c2细胞中Bax、caspase 3蛋白表达升高,Bcl-2蛋白表达降低 (P< 0.05)。见图3、表3。

表3 各组H9c2细胞中Bax、Bcl-2、caspase 3蛋白表达比较 (n = 6)Tab.3 Bax,Bcl-2,and caspase 3 protein expression of H9c2 cells by study group (n = 6)
2.6 SNHG1靶向调控miR-145-5p /PDCD4轴
在Starbase (http://starbase.sysu.edu.cn/)、Target Scan (https://www.targetscan.org/vert_72/) 网站分别预测lncRNA SNHG1与miR-145-5p、miR-145-5p与PDCD4的结合位点,见图4。与mimic NC和 SNHG1-WT共转染组比较,miR-145-5p mimic和 SNHG1-WT共转染组的荧光素酶活性降低 (分别为1.05±0.12和0.23±0.01,P< 0.05);与mimic NC和SNHG1-MUT共转染组比较,miR-145-5p mimic和 SNHG1-MUT共转染组荧光素酶活性无显著变化 (分别为1.03±0.11和1.02±0.10,P> 0.05);与mimic NC和PDCD4-WT共转染组比较,miR-145-5p mimic和PDCD4-WT共转染组的荧光素酶活性降低 (分别为1.03±0.10和0.29±0.02,P< 0.05);与mimic NC和PDCD4-MUT共转染组比较,miR-145-5p mimic和PDCD4-MUT共转染组荧光素酶活性无显著变化 (分别为0.97±0.08和1.01±0.09,P> 0.05)。
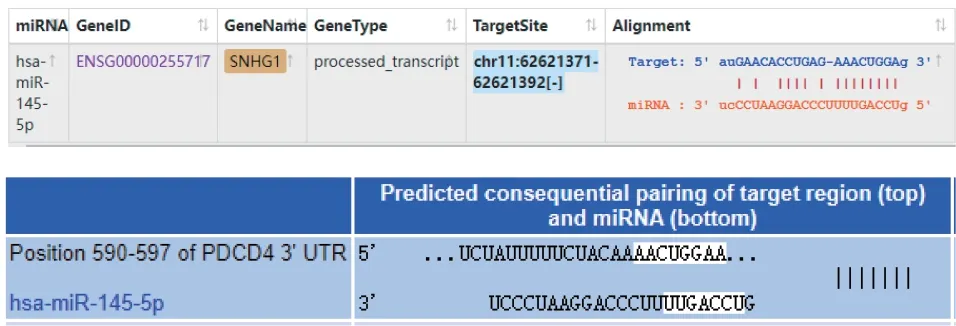
图4 Starbase、TargetScan网站分别预测lncRNA SNHG1与miR-145-5p、miR-145-5p与PDCD4的结合位点Fig.4 Binding sites of lncRNA SNHG1 and miR-145-5p as well as of miR-145-5p and PDCD4 predicted at Starbase and TargetScan websites
3 讨论
AMI是冠状动脉急性闭塞引起的心肌损伤,严重威胁人类生命健康。尽管 AMI 的诊断和治疗在过去几十年中有所进展,但全世界其发病率和死亡率仍在上升[7]。因此,早期发现和干预对于减少心肌损伤和改善患者预后是必要的。
SNHG1是一种新发现的lncRNA,研究[8]报道,沉默SNHG1可抑制脓毒症小鼠心肌损伤;敲低SNHG1可抑制脂多糖诱导的PC12细胞凋亡[9]。以上研究表明,SNHG1在调控细胞凋亡和心肌损伤方面具有重要作用。SOD和MDA是氧化应激的标志物;Bax、Bcl-2、caspase 3是常用于评估细胞凋亡的蛋白,Bcl-2是一种抗凋亡蛋白,而Bax、caspase 3是促凋亡效应蛋白。本研究显示,SNHG1在H/R诱导的H9c2细胞中高表达,沉默SNHG1可抑制H/R诱导的H9c2细胞凋亡和氧化应激,提示SNHG1可能是治疗AMI的潜在有效靶点。
lncRNA可通过海绵化微RNA (microRNA,miRNA)发挥作用。本研究通过生物信息学分析和双荧光素酶报告基因实验,证实SNHG1与miR-145-5p 存在靶向关系。miR-145-5p作为一种miRNA,已有研究报道,下调miR-145-5p可加重心肌梗死小鼠心肌损伤[10],过表达miR-145-5p可减轻心肌缺血/再灌注损伤中的细胞凋亡[11]。以上研究表明,miR-145-5p在AMI进展中发挥重要调控作用。本研究结果与上述研究结果一致,本研究显示,miR-145-5p在H/R诱导的H9c2细胞中低表达,过表达miR-145-5p可抑制H/R诱导的H9c2细胞凋亡和氧化应激。此外,本研究还发现沉默SNHG1可上调H/R诱导的H9c2细胞中miR-145-5p表达,推测沉默SNHG1可能通过上调miR-145-5p抑制H/R诱导的H9c2细胞凋亡和氧化应激。为了验证这一推测,本研究在沉默SNHG1的基础上应用miR-145-5p inhibitor干预H/R诱导的H9c2细胞,结果显示,miR-145-5p inhibitor减弱了沉默SNHG1对H/R诱导的H9c2细胞凋亡和氧化应激的影响。本研究证实了这一推测,即沉默SNHG1可能通过上调miR-145-5p抑制H/R诱导的H9c2细胞凋亡和氧化应激。
miRNA是一类非编码RNA,通过与其靶基因mRNA的3’非翻译区结合,在转录后水平负调控基因表达。本研究证实了PDCD4为miR-145-5p的靶基因。PDCD4基因定位于染色体10q24上[12]。研究显示,沉默PDCD4能够减弱H/R诱导的心肌细胞凋亡和氧化应激损伤[13],抑制PDCD4可抑制阿霉素诱导的大鼠心肌细胞凋亡[14]。以上研究表明,PDCD4在调控心肌细胞凋亡和氧化应激方面发挥重要作用。本研究显示,PDCD4蛋白在H/R诱导的H9c2细胞中高表达,沉默SNHG1后,H/R诱导的H9c2细胞中miR-145-5p表达升高,而PDCD4蛋白表达降低,双荧光素酶报告基因实验证实了SNHG1与miR-145-5p、miR-145-5p与PDCD4存在靶向关系。证实了沉默SNHG1可能通过调控miR-145-5p/PDCD4轴,抑制H/R诱导的H9c2细胞凋亡和氧化应激。
综上所述,沉默SNHG1可能通过上调miR-145-5p来抑制PDCD4表达,进而抑制H/R诱导的H9c2细胞凋亡和氧化应激。本研究尚存在不足之处,仅进行了体外实验,未进行体内实验探究SNHG1对H/R诱导的H9c2细胞凋亡的影响,后期将进行进一步体内研究。
