绵羊肺腺瘤病毒SU蛋白与Hyal-2蛋白的结合域研究
2016-05-10张月梅赵世华么宏强马学恩
张月梅,赵世华,么宏强,马学恩
(1.内蒙古农业大学兽医学院,内蒙古呼和浩特 010018; 2.内蒙古农牧业科学院兽医研究所,内蒙古呼和浩特 010031)
绵羊肺腺瘤病毒SU蛋白与Hyal-2蛋白的结合域研究
张月梅1,2,赵世华2,么宏强1*,马学恩1*
(1.内蒙古农业大学兽医学院,内蒙古呼和浩特 010018; 2.内蒙古农牧业科学院兽医研究所,内蒙古呼和浩特 010031)
摘要:试验证明绵羊的Hyal-2不仅可以与绵羊肺腺瘤病毒的囊膜蛋白Env结合,也可以单独与绵羊肺腺瘤病毒SU蛋白亚基结合。为了进一步研究绵羊Hyal-2与SU蛋白可能结合的区域,应用在线生物学软件预测了SU蛋白的膜外区(对应编码基因序列238 bp~867 bp)将之前已经构建的缺失型SU蛋白真核表达载体pEGFP-C1-(su1-su5)与pDsRed-monomer-N1-hyal-2共转染293T细胞,运用激光共聚焦方法结合免疫共沉淀方法确定SU蛋白和Hyal-2蛋白可能结合区域。激光共聚焦显微镜观察结果表明,SU1-SU5与Hyal-2均存在细胞内共定位。免疫共沉淀方法检测缺失型蛋白SU1-SU5与绵羊Hyal-2均不存在相互作用。su基因所缺失区域238 bp~867 bp对于SU蛋白与受体的结合都是必不可少的。
关键词:绵羊肺腺瘤病毒;SU蛋白;Hyal-2蛋白;结合区域
绵羊肺腺瘤病(OPA)是由绵羊肺腺瘤病毒(Ovine pulmonary adenomatosis virus,OPAV)引起的自然发生的一种慢性进行性接触传染性的支气管肺泡腺癌[1-2],其特点是肺泡上皮细胞增殖和肺液的过量产生。该病毒的本质是一种逆转录病毒,并且它是已知的唯一在自然条件下可以引起绵羊肺腺瘤的病毒[1]。OPAV的细胞受体是一个糖基化磷脂酰肌醇(gycosylphosphatidylinositol,GPI)-锚定蛋白,称为透明质酸酶2(Hyal-2)。对应于人类染色体3p21.3,这是一个肿瘤抑制区[3-4]。在绵羊、人、猴、牛、狗、兔细胞中,OPAV能够利用Hyal-2作为受体,但在大鼠、小鼠或者仓鼠不能使用Hyal-2作为受体[5]。与透明质酸酶其他家庭成员相比,Hyal-2具有非常弱的活性,但是作为外源性OPAV和内源性OPAV的 Env蛋白的一个有效受体起作用[4,6]。外源性OPAV的SU结构域在体外可以直接与人类Hyal-2相互作用介导病毒进入人类和大鼠的细胞[7]。为了验证绵羊的Hyal-2与SU相互作用时SU可能参与的结合区域,本试验运用激光共聚焦结合免疫共沉淀法验证了SU与Hyal-2可能结合的区域。
1材料与方法
1.1材料
1.1.1模板及细胞真核表达载体pEGFP-C1-(su1-su5)和pDsRed-monomer-N1-hyal-2载体,内蒙古农业大学病理实验室保存;293T细胞,内蒙古农业大学病理实验室保存。
1.1.2主要试剂与仪器 Lipofectamine 2000、DMEM细胞培养液,购自Invitrogen公司;胎牛血清,购自TBD公司。Pierce Co-Immunoprecipitation (Co-IP) Kit、Anti-RFP(RF5R) mouse antibody,购自Thermo公司;Anti-GFP mouse antibody、Goat-anti mouse IgG HRP 抗体,购自EARTH OX公司。
电子天平,赛多利斯科学仪器有限公司产品;PCR仪,Biometra公司产品;迷你离心机,其林贝尔公司产品;凝胶成像系统,Sagecreation公司产品;电泳仪,Bio-Rad公司产品;离心机,Thermo公司产品;电热恒温水浴锅,北京长安科学仪器厂产品;多功能酶标仪,GE Healthcare公司产品;超纯水仪,Elga公司产品;恒温水平摇床,太仓市实验设备厂产品;制冰机,Graxt公司产品;微量移液器,Eppendorf公司产品;-80℃超低温箱,Haier公司产品;超净工作台,Boxun公司产品;微波炉,格兰仕公司产品;震荡仪,Thermo公司产品;电热恒温培养箱、电热鼓风干燥箱,上海一恒科技有限公司产品;灭菌锅,Hirayama制造公司产品;核酸电泳仪,北京市六一仪器厂产品;荧光倒置显微镜、激光共聚焦显微镜,Olympus公司产品。
1.2方法
1.2.1激光共聚焦显微镜观察蛋白的共表达情况 pEGFP-C1-(su1-su5)真核表达载体为运用生物信息学软件预测SU蛋白膜外区后,按照蛋白多肽从N端到C端顺序分别缺失150个碱基(50个氨基酸)后,再通过重叠PCR连接缺失后两个片段而构建的一系列真核表达载体。pDsRed-monomer-N1-hyal-2真核表达载体为运用重叠PCR方法扩增出hyal-2基因后构建的表达hyal-2的真核表达载体[8]。
转染前24 h将状态良好的293T细胞,用胰酶消化4 min左右,待细胞在镜下观察成为单个圆形后,迅速吸出胰酶,加入DMEM高糖含血无双抗培养基,吹打均匀后,铺细胞于激光共聚焦显微镜专用培养皿,第2天观察细胞汇合度达80%以上进行共转染试验,于48 h后将细胞固定及核染,然后观察细胞内目的蛋白的共表达及定位情况。共转染的设计:
未转染的细胞为阴性对照;pDsRed-monomer-N1-hyal-2和pEGFP-C1共转染;pDsRed-monomer-N1和pEGFP-C1-su1共转染;pDsRed-monomer-N1和pEGFP-C1-su2共转染;pDsRed-monomer-N1和pEGFP-C1-su3共转染;pDsRed-monomer-N1和pEGFP-C1-su4共转染;pDsRed-monomer-N1和pEGFP-C1-su5共转染;pEGFP-C1-su1和pDsRed-monomer-N1-hyal-2共转染;pEGFP-C1-su2和 pDsRed-monomer-N1-hyal-2共转染; pEGFP-C1-su3和 pDsRed-monomer-N1-hyal-2共转染;pEGFP-C1-su4和 pDsRed-monomer-N1-hyal-2共转染;pEGFP-C1-su5和 pDsRed-monomer-N1-hyal-2共转染;每个共转染孔两个重复。于48h后在荧光显微镜下观察荧光强度(结果略)。
之后应用免疫共沉淀试剂盒进行免疫共沉淀。
1.2.2免疫共沉淀法检测蛋白相互作用将状态良好的293T细胞,用胰酶消化4 min左右,待细胞在镜下观察成为单个圆形后,迅速吸出胰酶,加入DMEM高糖含血无双抗培养基,吹打均匀后,将细胞铺于10 cm细胞培养皿(每个样品需3个),次日待细胞融合度为80%左右,运用脂质体法进行转染。
将构建好的缺失型真核表达载体pEGFP-C1-(su1-su5)分别与pDsRed- monomer-N1-hyal-2共转染入24 h前铺好的细胞培养皿,每组组合需要3个10 cm细胞培养皿。试验分组设计原则同上,免疫共沉淀试验步骤详见Pierce Co-Immunoprecipitation (Co-IP) Kit说明书。
2结果
2.1共转染的激光共聚焦显微镜的荧光观察
由图1可知,对照组的共转染后细胞内的2种蛋白均不存在蛋白的细胞内共定位,即pEGFP-C1-(su1-su5)和pDsRed-monomer-N1共转染的对照组和pEGFP-C1和pDsRed-monomer-N1-hyal-2共转染的对照组均不存在细胞内蛋白的共定位。而pEGFP-C1-(su1-su5)和pDsRed-monomer-N1-hyal-2共转染的样品组存在蛋白的细胞内共定位情况。
2.2免疫共沉淀检测结果
由图2和图3可知,用Anti-RFP(RF5R) mouse antibody作为检测共转染后免疫共沉淀试验的检测抗体检测Hyal-2融合蛋白,发现除了共转染pDsRed-monomer-N1-hyal-2和pEGFP-C1-su1的蛋白裂解液在81 ku出现阳性条带,其他对照组和样品组均未出现阳性条带。
3讨论
将构建好的缺失型真核表达载体pEGFP-C1-(su1-su5)与Hyal-2真核表达载体共同转染293T细胞,由于Hyal-2真核表达载体pDsRed-monomer-N1-hyal-2中融合有红色荧光蛋白DsRed,而缺陷型SU蛋白真核表达载体pEGFP-C1中融合有绿色荧光蛋白EGFP,可以在两种携带目的基因的真核表达载体共转后,在不同的激发光下观察荧光的发生,从而确定两种真核表达载体表达的目的蛋白是否能共表达在细胞中,以及通过激光共聚焦显微镜观察共表达的目的蛋白的共定位情况。试验结果表明,将pEGFP-C1-(su1-su5)真核表达载体与pDsRed-monomer-N1-hyal-2共转染后均存在蛋白的细胞内共定位情况。但是从之前的试验结果中pDsRed-monomer-N1-hyal-2单独转染后目的蛋白细胞内定位观察及pEGFP-C1-(su1-su5)单独转染后目的蛋白的细胞内定位不难发现,无论是Hyal-2蛋白还是SU1-SU5蛋白均定位于细胞质中[8],因此,相同的亚细胞定位并不能证明蛋白发生了相互作用。蛋白是否存在相互作用还需进行免疫共沉淀反应。最后通过SDS-PAGE和蛋白质免疫印迹方法鉴定蛋白是否存在相互作用。试验结果表明,su1-su5基因所缺失的碱基序列均对于SU蛋白与Hyal-2蛋白的结合是必须的,即su基因的238 bp~867 bp对于与受体的结合都是必不可少的,这与Miller A D[9]的报道略有差异,可能是分段方法的不同引起的。
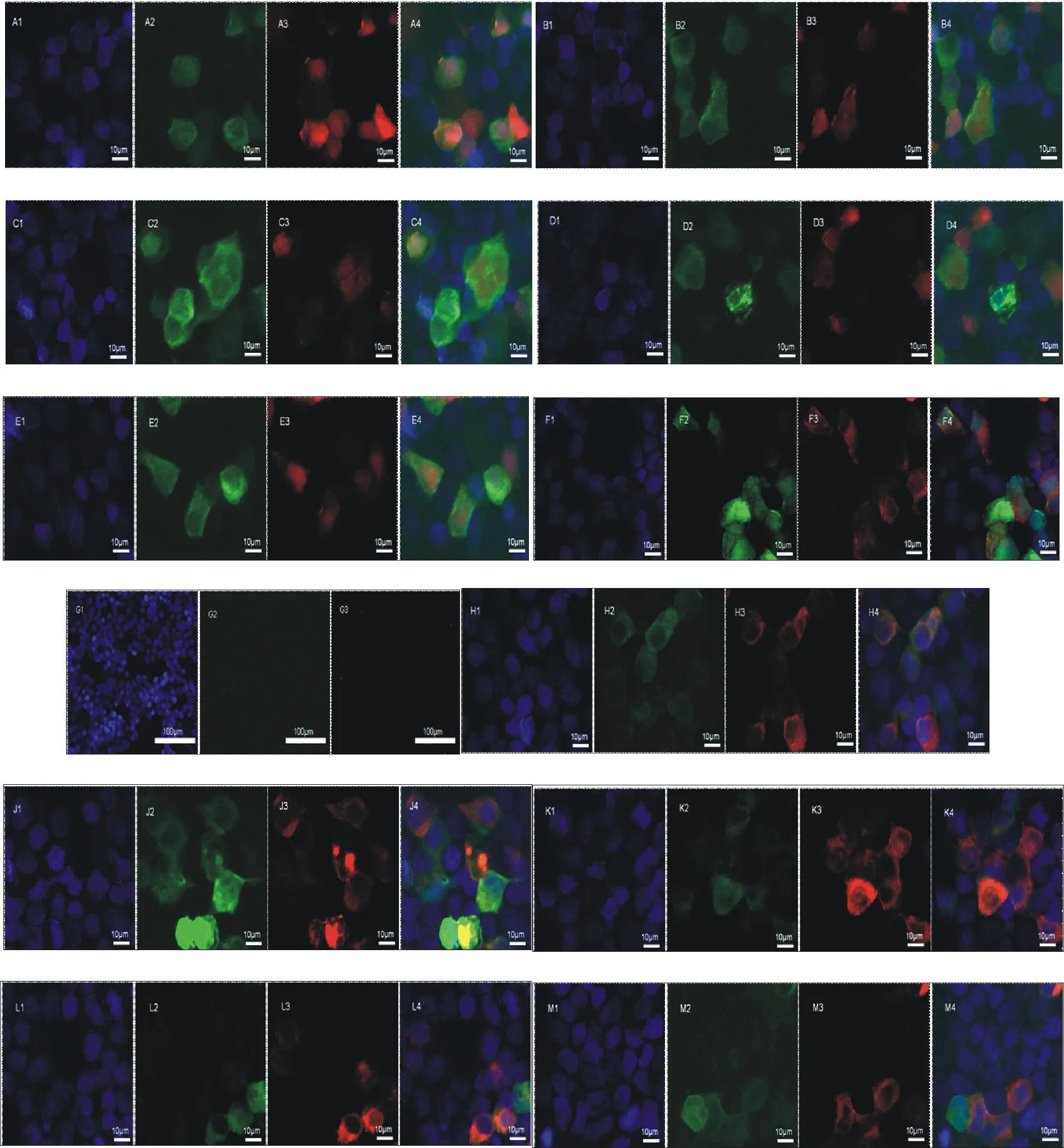
A1~A4.pDsRed-monomer-N1和pEGFP-C1-su1共转染;B1~B4.pDsRed-monomer-N1和pEGFP-C1-su2共转染;C1~C4.pDsRed-monomer-N1和pEGFP-C1-su3共转染;D1~D4.pDsRed-monomer-N1和pEGFP-C 1-su4共转染;E1~E4.pDsRed-monomer-N1和pEGFP-C1-su5共转染;F1~F4.pDsRed-monomer-N1-hyal-2和pEGFP-C1共转染;G1~G3.未转染细胞(阴性对照);H1~h1.pEGFP-C1-su1和pDsRed-monomer-N1-hyal-2共转染;J1~J4.pEGFP-C1-su2和pDsRed-monomer-N1-hyal-2共转染;K1~K4.pEGFP-C1-su3和pDsRed-monomer-N1-hyal-2共转染;L1~L4.pEGFP-C1-su4和pDsRed-monomer-N1-hyal-2共转染;M1~M4.pEGFP-C1-su5和pDsRed-monomer-N1-hyal-2共转染
A1-A4.Cotransfection of pDsRed-monomer-N1 and pEGFP-C1-su1;B1-B4.Cotransfection of pDsRed-monomer-N1 and pEGFP-C1-su2;C1-C4.Cotransfection of pDsRed-monomer-N1 and pEGFP-C1-su3;D1-D4.Cotransfection of pDsRed-monomer-N1 and pEGFP-C1-su4;E1-E4.Cotransfection of pDsRed-monomer-N1 and pEGFP-C1-su5;F1-F4.Cotransfection of pDsRed-monomer-N1-hyal-2 and pEGFP-C1;G1-G3.Negative control;H1-h1.Cotransfection of pEGFP-C1-su1 and pDsRed-monomer-N1-hyal-2;J1-J4.Cotransfection of pEGFP-C1-su2 and pDsRed-monomer-N1-hyal-2;K1-K4.Cotransfection of pEGFP-C1-su3 and pDsRed-monomer-N1-hyal-2;L1-L4.Cotransfection of pEGFP-C1-su4 and pDsRed-monomer-N1-hyal-2;M1-M4.Cotransfection of pEGFP-C1-su5 and pDsRed-monomer-N1-hyal-2
图1激光共聚焦显微镜的荧光观察
Fig.1Fluorescent observation with laser confocal microscope
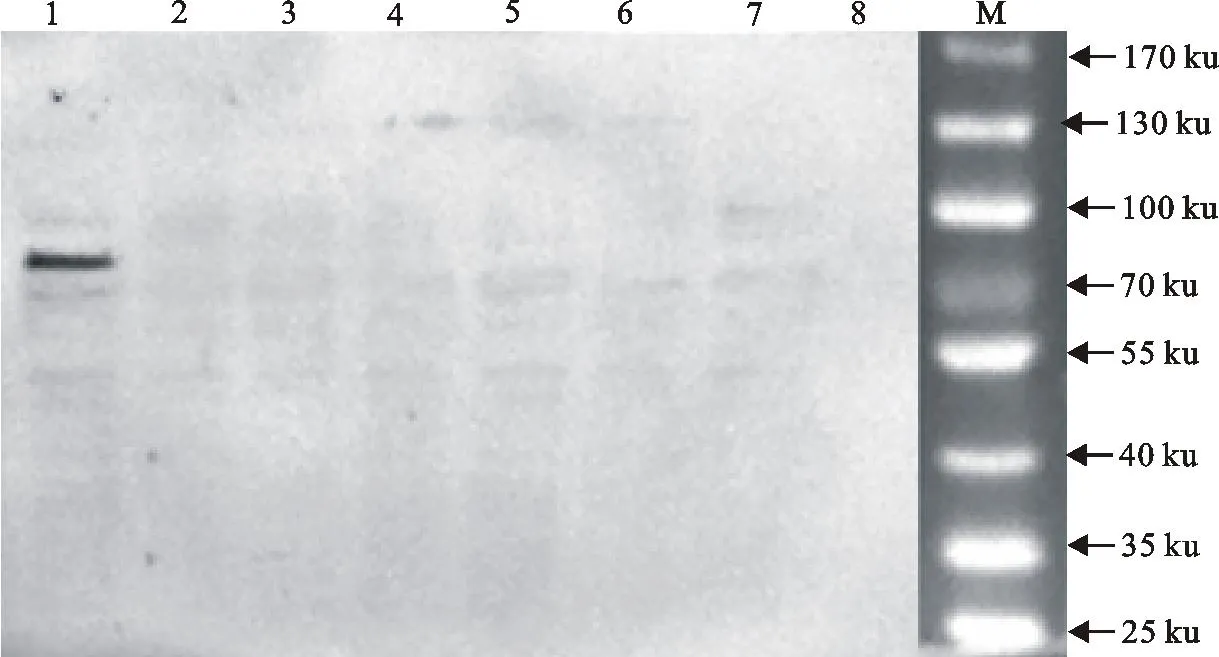
1.共转染pDsRed-monomer-N1-hyal-2和pEGFP-C1-su1的蛋白裂解液;2.偶联山羊抗鼠IgG对照,含有共转染hyal-2-pDsRed-monomer-N1和pEGFP-C1-su1的蛋白裂解液;3.pEGFP-C1和pDsRed-monomer-N1-hyal-2共转染蛋白免疫共沉淀对照;4.pEGFP-C1-su1和pDsRed-monomer-N1共转染蛋白免疫共沉淀对照;5. pEGFP-C1-su2和pDsRed-monomer-N1共转染蛋白免疫共沉淀对照;6.pEGFP-C1-su3和pDsRed-monomer-N1共转染蛋白免疫共沉淀对照;7.pEGFP-C1-su4和pDsRed-monomer-N1共转染蛋白免疫共沉淀对照;8.pEGFP-C1-su5和pDsRed-monomer-N1共转染蛋白免疫共沉淀对照;M.蛋白分子质量标准
1.Lysis buffer of pDsRed-monomer-N1-hyal-2 and pEGFP-C1-su1 cotransfected in cells;2.Control of goat anti-mouse IgG;3.Co-immunoprecipitation control of pEGFP-C1and pDsRed-monomer-N1 cotransfected in cells;4.Co-immunoprecipitation control of pEGFP-C1-su1 and pDsRed-monomer-N1 cotransfected in cells;5.Co-immunoprecipitation control of pEGFP-C1-su2 and pDsRed-monomer-N1 cotransfected in cells;6.Co-immunoprecipitation control of pEGFP-C1-su3 and pDsRed-monomer-N1 cotransfected in cells;7.Co-immunoprecipitation control of pEGFP-C1-su4 and pDsRed-monomer-N1 cotransfected in cells;8.Co-immunoprecipitation control of pEGFP-C1-su5 and pDsRed-monomer-N1 cotransfected in cells;M.Protein molecular weight Marker
图2免疫共沉淀检测结果(1)
Fig.2Detection results of co-immunoprecipitation (1)

1.偶联山羊抗兔IgG对照,共转染hyal-2-pDsRed-monomer-N1和pEGFP-C1-su2的蛋白裂解液;2.共转染hyal-2-pDsRed-monomer-N1和pEGFP-C1-su1的蛋白裂解液;3.pEGFP-C1-su1和pDsRed-monomer-N1-hyal-2共转染蛋白免疫共沉淀;4.pEGFP-C1-su2和pDsRed-monomer-N1-hyal-2共转染蛋白免疫共沉淀;5.pEGFP-C1-su3和pDsRed-monomer-N1-hyal-2共转染蛋白免疫共沉淀;6.pEGFP-C1-su4和pDsRed-monomer-N1-hyal-2共转染蛋白免疫共沉淀;7.pEGFP-C1-su5和pDsRed-monomer-N1-hyal-2共转染蛋白免疫共沉淀;M.蛋白分子质量标准
1.Control of goat anti-miouse IgG;2.Lysis buffer of pDsRed-monomer-N1-hyal-2 and pEGFP-C1-su1 cotransfected in cells;3.Co-immunoprecipitation results of pEGFP-C1-su1and pDsRed-monomer-N1-hyal-2 cotransfected in cells;4.Co-immunoprecipitation results of pEGFP-C1-su2 and pDsRed-monomer-N1-hyal-2 cotransfected in cells;5.Co-immunoprecipitation results of pEGFP-C1-su3 and pDsRed-monomer-N1-hyal-2 cotransfected in cells;6.Co-immunoprecipitation results of pEGFP-C1-su4 and pDsRed-monomer-N1-hyal-2 cotransfected in cells;7.Co-immunoprecipitation results of pEGFP-C1-su5 and pDsRed-monomer-N1-hyal-2 cotransfected in cells;M.Protein molecular weight Marker
图3免疫共沉淀检测结果(2)
Fig.3Detection results of co-immunoprecipitation (2)
本试验通过将缺失型pEGFP-C1-(su1-su5)真核表达载体,与pDsRed-monomer-N1-hyal-2共转染将其转入293T细胞中,实现了pEGFP-C1-(su1-su5)与pDsRed-monomer-N1-hyal-2在细胞内的共表达;运用激光共聚焦显微镜观察到了各种组合下蛋白的细胞内定位情况,结果表明,SU1-SU5与Hyal-2均存在细胞内共定位。免疫共沉淀法结果证明,su1-su5基因所缺失的碱基序列238 bp~867 bp对于SU蛋白与Hyal-2蛋白的结合是必须的。
参考文献:
[1]马学恩.家畜病理学[M].4版.北京:中国农业出版社,2007:385-386.
[2]荆文魁,王颖,张怀宇.绵羊肺腺瘤病[J].中国兽医杂志,2010,46(5):88-89.
[3]Rai S K,DeMartini J C,Miller A D.Retrovirus vectors bearing Jaagsiekte sheep retrovirus Env transduce human cells by using a new receptor localized to chromosome 3p21.3[J].J Virol,2000,74(10):4698-4704.
[4]Rai S K,Duh F M,Vigdorovich V,et al.Candidate tumor sup
pressor HYAL2 is a glycosylphosphatidylinositol (GPI)-anchored cell-surface receptor for Jaagsiekte sheep retrovirus,the envelope protein of which mediates oncogenic transformation[J].Proc Natl Acad Sci U S A,2001,98(8):4443-4448.
[5]Dakessian R M,Fan H.Specificinvivoexpression in type II pneumocytes of the Jaagsiekte sheep retrovirus long terminal repeat in transgenic mice[J]. Virology,2008,372(2):398-408.
[6]Spencer T E,Mura M,Gray C A,et al.Receptor usage and fetal expression of ovine endogenous betaretroviruses: implications for coevolution of endogenous and exogenous retroviruses[J].J Virol,2003,77(1):749-753.
[7]Liu S L,Duh F M,Lerman M I,et al.Role of virus receptor Hyal-2 in oncogenic transformation of rodent fibroblasts by sheep betaretrovirus env proteins[J].J Virol,2003,77(5):2850-2858.
[8]张月梅.绵羊肺腺瘤病毒囊膜蛋白与绵羊透明质酸酶2相互作用初探[D]. 内蒙古呼和浩特:内蒙古农业大学,2014.
[9]Miller A D.Identification of Hyal-2 as the cell-surface receptor for Jaagsiekte sheep retrovirus and ovine nasal adenocarcinoma virus[J].Curr Top Microbiol Immunol,2003,275:179-199.
Study on Possible Binding Region Between SU Protein of Ovine Pulmonary Adenomatosis Virus and Hyal-2 Protein
ZHANG Yue-mei1,2, ZHAO Shi-hua2,YAO Hong-qiang1, MA Xue-en1
(1.CollegeofVeterinaryMedicine,InnerMongoliaAgriculturalUniversity,Huhhot,InnerMongolia,010018,China;2.InstituteofVeterinaryMedicine,InnerMongoliaAcademyofAgriculturalandAnimalHusbandry,Huhhot,InnerMongolia,010031,China)
Abstract:The experimental results have shown that the Hyal-2 can not only be combined with the Env protein of Ovine pulmonary adenomatosis virus(OPAV),but also can be combined with the SU protein of OPAV.To design the experiment for further studying the possible binding regions of Hyal-2 and SU protein,the extracellular domain of SU protein was predicted by using online biology software(238 bp-867 bp). pEGFP-C1- (su1-su5) and pDsRed-monomer-N1-hyal-2 vectors were cotransfected into 293T cells.The possible binding area between SU protein and Hyal-2 protein by using laser confocus and co-immunoprecipitation methods was determined.The results showed that SU1-SU5 and Hyal-2 were co-located in the cells,there was no interaction between the SU1-SU5 and the Hyal-2 of sheep by using the method of co-immunoprecipitation.The deleted region 238 bp-867 bp of the su gene is essential for the binding of SU with the receptor.
Key words:ovine pulmonary adenomatosis virus;SU protein;Hyal-2 protein;binding region
文章编号:1007-5038(2016)04-0049-05
中图分类号:S852.65;Q789
文献标识码:A
作者简介:张月梅( 1982- ) ,女,内蒙古呼和浩特人,助理研究员,博士,主要从事动物传染病相关研究。*通讯作者
基金项目:国家自然科学基金项目( 31101788)
收稿日期:2015-09-14
