聚乙烯农用地膜降解菌的筛选与鉴定
2023-10-08闵逸雯王小兵陈悦汪晓丽
闵逸雯,王小兵,2*,陈悦,汪晓丽
(1.扬州大学 环境科学与工程学院,江苏 扬州 225127;2.江苏省有机固废废弃物资源化协同创新中心,江苏 扬州 225127)
聚乙烯(Polyethylene,PE)因其生产成本低、耐水、耐用等优点,被广泛应用于农业(如农用地膜)、生活用品(如食品袋)、建筑(如管道)等领域,成为日常生活中不可替代的材料[1]。我国农业设施较多,农用聚乙烯薄膜应用也较多。目前,中国使用的农用塑料薄膜主要是12 μm以下的超薄薄膜,这种薄膜非常脆弱,容易破碎,难以回收利用[2]。据农业部门统计,中国耕地薄膜残留量以60~90 kg/hm2为主,最高达160 kg/hm2。中国地膜覆盖农作物已有40多年的历史,累计覆盖面积达2 000万km2,进入土壤的塑料薄膜超过2 000万t。中国农田塑料薄膜残留严重。
目前世界上处理这些极难自然分解的聚乙烯塑料的主要方法是填埋、焚烧[3]、堆肥等比较原始的方法。但这些方法都会造成生态环境的二次污染,填埋的塑料经过一段时间后会变成危害较大的微塑料[4]。当前研究认为塑料生物降解是塑料向矿物材料转化,增加土壤肥力,减少塑料垃圾向环境累积以及降低废物管理成本等方面的一种有效手段。所以利用生物降解这一环境友好处理手段能较好解决治理塑料垃圾污染问题。
从70年代开始就有研究报告PE塑料被微生物降解的情况,以PE是唯一碳源从土壤、垃圾填埋场、海洋、昆虫肠道及其他不同生境中分离到的部分菌株可用于塑料的生物降解[5-6]。以垃圾填埋场为例,已有研究得到2株假单胞菌RD1-3、N1-2,它们均能对PBAT塑料进行高效地降解[7]。这为PE塑料垃圾的治理提供一种新思路。
为了缓解残留农用地膜聚乙烯对设施农田土壤的影响,本论文以农用地膜塑料(聚乙烯,PE)为唯一碳源,采用富集培养法从设施农田土壤中筛选高效降解菌,并探索可能的降解机制,为缓解废弃农用地膜污染,改善农田生态环境提供理论支撑。
1 材料与方法
1.1 材料
本实验供试PE地膜购置于某农用市场厚度为0.004 mm的农用地膜。降解菌从高邮某设施大棚土壤中分离。
MSM培养基:MgSO40.20 g,CaCl20.02 g,KH2PO410.00 g,K2HPO41.00 g,NH4NO31.00 g,FeCl30.05 g,1.00 L蒸馏水,pH值7.00,121 ℃高压灭菌20 min。NA培养基:胰蛋白胨 10.00 g,牛肉粉 3.00 g,氯化钠 5.00 g,蒸馏水1.00 L,琼脂,pH值7.30,121 ℃高压灭菌20 min。
1.2 方法
1.2.1 PE降解菌的分离和筛选
农用地膜灭菌处理:将PE地膜剪成大小为2 cm×1.5 cm的片状,然后依次浸泡于2% SDS、75%乙醇、95%乙醇中4 h,再用无菌水冲洗干净,置于紫外灭菌灯下灭菌15 min。
采取高邮某设施大棚内1 g新鲜土壤,加入100 mL 无菌水充分摇匀,制得土壤稀释液;取20 μL稀释液接种到100 mL MSM培养基中并加入1片预处理过的PE地膜,于25 ℃、150 r/min培养,待菌液浓度上升并趋于稳定后,取1 mL菌液到100 mL NA培养基进行传代培养,每7 d进行一次传代,3次重复。取0.2 mL培养液涂布于NA培养基,放置于28 ℃恒温培养箱中培养,长出菌落后,按照菌落特征挑取单菌落,纯化多次直到获得纯菌株,用NA 斜面培养基4 ℃保存。
1.2.2 PE降解菌对PE地膜降解效率
PE降解菌对PE地膜降解效率采用PE地膜失重率来计算。从初筛的PE降解菌斜面培养基接种到50 mL NA液体培养基中摇瓶培养18 h,再以0.5 μL接种量分别接种到50 mL含0.1 g 灭菌的PE地膜的MSM培养基中。于35 ℃、150 r/min培养28 d,将不接种菌悬液的含有PE农用地膜的MSM培养基在相同条件下培养,作为空白对照(CK)。称重培养前处理过的PE地膜质量,记为m0。过滤回收降解实验后的PE地膜,采用70%乙醇进行四阶段清洗,放入50 ℃烘箱中过夜干燥后称重,记为m1。计算公式如下:
PE地膜失重率=(m0-m1)/m0×100%
(1)
1.2.3 以PE为唯一碳源培养基中降解菌生长曲线和pH值变化特征
取活化0.5 μL降解菌培养液接种于含有 2 g PE地膜的 100 mL MSM培养基中,27 ℃,120 r/min 振荡培养28 d,每隔3 d对培养基进行OD值和pH值测定。
1.2.4 降解菌对PE地膜的表面特征影响
将经降解菌处理 28 d 后的塑料地膜样品用蒸馏水洗涤 3 次,再用 75%乙醇冲洗,去除表面的细菌,使最大表面暴露出来,以便观察。在25 mA、0.3 MPa氩气气氛下溅射金微塑料涂层,使用S-4800扫描电子显微镜(SEM,株式会社日立制作所)进行分析。
1.2.5 降解菌对PE地膜的表面官能团的影响
用 Nexus 670 FTIR 光谱仪(美国 Nicolet)对PE地膜进行FTIR表征,长度范围为 4 000~400 cm-1,分辨率为 4 cm-1,扫描次数为 20 次。
1.2.6 降解菌株16S rDNA测定
降解菌基因组 DNA的提取方法均按常规方法操作[8]。用Power Soil DNA Isolation Kit(MO BIO)试剂盒提取降解菌DNA,采用微生物通用引物515FmodF(5'-GTGYCAGCMGCCGCGGTAA-3') 806RmodR(5'-GGACTACNVGGGTWTCTAAT-3') 对16S rRNA基因V4可变区进行PCR扩增,扩增程序如下:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),然后72 ℃稳定延伸10 min,最后在4 ℃进行保存,检测合格后使用Illumina Miseq平台测序。在EzBioCloud网站进行Blast序列比对系统发育树分析,鉴定菌株种属。基因测序委托南京生物医药科技有限公司完成。
2 结果与分析
2.1 PE降解菌的筛选
以PE农用地膜为唯一碳源,通过富集培养法从设施大棚土壤中获得四种不同菌落形态的菌株,将四株菌株命名为BP1、BP2、BP3和BP4。采用PE地膜失重率来计算PE降解菌对PE地膜降解效率,结果见图1。结果表明,BP1、BP2、BP3和BP4四株菌降解率分别为9.99%,6.98%,8.35%和6.43%。BP1降解效果显著高于其他三株菌株。
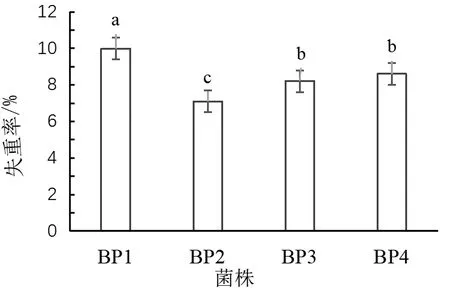
图1 不同菌株培养基中微塑料的降解率
在NA培养基上,BP1菌株菌落呈现出奶白色、湿润的圆形,表面光滑湿润且有光泽,边缘光滑,中心有凸起(图2)。
图2 BP1菌落形态
2.2 以PE为唯一碳源培养基中BP1菌株生长曲线和pH值变化特征
以PE地膜为唯一碳源,BP1生长曲线见图3。0~3 d,BP1菌株适应新的生长环境,开始代谢繁殖,增长较为缓慢;3~15 d,BP1菌株增长速率显著提高,说明细菌可以利用PE地膜作为唯一碳源来进行自身的生长繁殖;15~28 d,BP1繁殖速度下降,生物量趋于平缓。
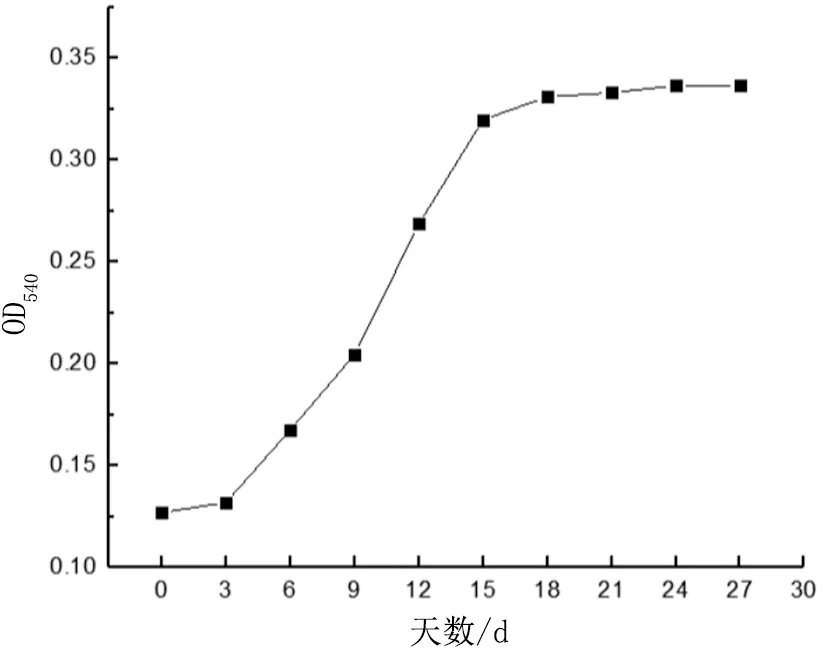
图3 降解过程中菌株生物量变化
pH值的变化表明细菌在进行新陈代谢,这使微生物能够继续生长。每隔3 d测量一次液体培养基的pH值,结果见图4。培养基在第14 d达到最低的pH值8.6,然后逐渐上升并稳定下来;Gong等人[9]认为,与塑料一起培养的微生物能逐渐缓慢地降解塑料,降解过程中改变了塑料聚合物基质的微观结构,分泌出酸性副产品,使培养基的pH值降低。而在这个过程具有代谢活性微生物分泌多种胞内和胞外酶到培养基中,这些酶可能在聚合物降解中发挥了作用。在聚合物降解过程中,复杂的聚合物首先被外酶分解成短链或单体,这些外酶足够小,可以穿透细胞壁,在解聚过程中被用作碳或能量来源[10]。
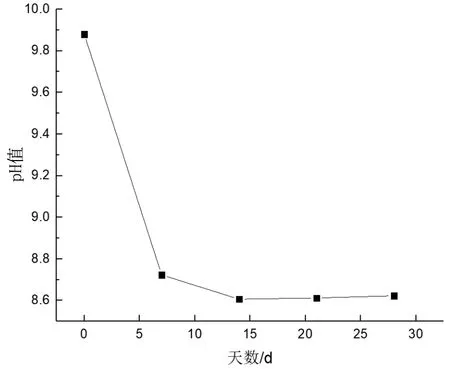
图4 实验过程中的pH值变化
2.3 微塑料表征
2.3.1 SEM结果分析
通过扫描电镜(SEM)分析降解菌BP1处理后PE农用地膜的表面变化情况。在经过BP1菌株处理28 d后,PE农用地膜表面发生一些凹槽、生物侵蚀,未经过BP1菌株处理PE地膜表面光滑平整(图5);从图5中很清楚可以看到有菌落黏附在薄膜表面,这可能是由于微生物菌种处理塑料薄膜后发生的酶解过程。经过BP1菌株处理后,薄膜的表面产生破损,增加了薄膜的粗糙度,表明降解菌已经对地膜进行了生物降解。

图5 PE地膜塑料降解前后表面形态特征
2.3.2 FTIR结果分析
FTIR可以观察到化学分子的变化,任何官能团的形成或消失,任何氧化剂或填充物的存在。通过FTIR对BP1降解菌处理前后PE农用地膜表明官能团变化进行分析(图6)。
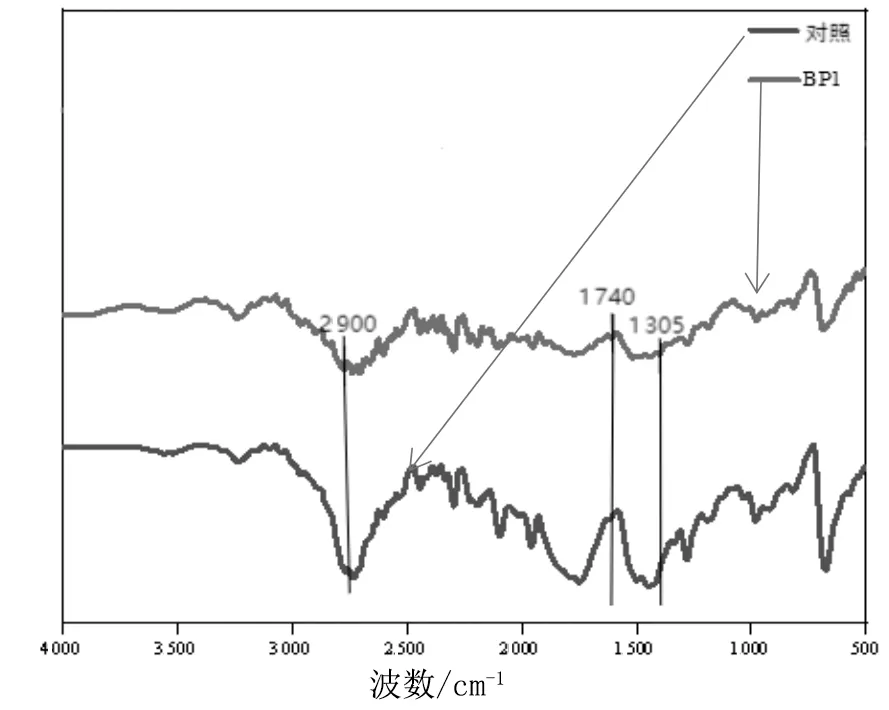
图6 PE地膜塑料降解前后FTIR光谱特征
当微生物引入氧化基团时,非极性键转化为极性键,导致不稳定性增加,并为微生物定居和酶断裂提供场所[11]。BP1菌株处理后的PE农用地膜与对照相比,出现一些波长峰的消减,从图6中可以发现,1 305,2 900 cm-1的振动峰有明显削弱和位置偏移,其中C-H伸缩振动峰在2 900 cm-1处削弱,1 740 cm-1处酯羰基指数降低。PE是一种线性饱和碳氢化合物,C-H 伸缩振动峰与酯羰基指数的变化间接说明降解菌株已在攻击利用PE而导致 C-H 减弱,表明接种菌株使PE农用地膜发生了生物降解,导致其表面的化学功能团发生了变化。
2.4 PE降解菌的分子生物学鉴定
将BP1进行了分子生物学鉴定。将扩增片段送往南京生物医药科技有限公司测序,显示扩增子序列长度为1 490 bp(获得序列登录号 ON545815),将所得序列在NCBI数据库中进行blast对比,利用MEGA11.0构建分子系统发育树如图7所示。结合BP1的形态特征与形态特性,结果表明BP1菌株为枯草芽孢杆菌(Bacillus subtilis)。鉴定该菌为芽孢杆菌属的一种。
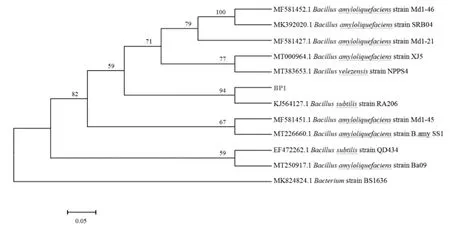
图7 BP1菌株系统发育树
3 结论
(1)以PE农用地膜为唯一碳源筛选到BP1、BP2、BP3和BP4四株PE降解菌,其中BP1菌株降解效率达到9.99%。
(2)经过BP1菌株降解后,PE农用地膜产生了孔洞、裂痕和凹坑,PE农用地膜表面酯羰基指数降低。
(3)通过形态学和分子生物学分析表明,BP1菌株为枯草芽孢杆菌(Bacillussubtilissp.),BP1菌株显著提高PE农用地膜的降解速率,这为缓解废弃农用地膜污染问题,改善农田生态环境提供理论支撑。
