化学发光酶免疫分析法检测黄瓜、青菜和水中的噻虫嗪残留
2023-09-03郭志慧宋天玮操海群方庆奎
郭志慧, 宋天玮, 钱 磊, 郑 康,操海群,3, 廖 敏,3, 方庆奎*,,3
(1.安徽农业大学 植物保护学院,合肥 230036;2.安徽农业大学 作物有害生物综合治理安徽省重点实验室,合肥 230036;3.安徽农业大学 农产品质量安全省级重点实验室,合肥 230036)
噻虫嗪是一种系统性、接触性的第二代新烟碱类杀虫剂[1-2]。噻虫嗪作为突触后尼古丁乙酰胆碱受体的激动剂,可以改变昆虫的行为,导致害虫死亡[3]。通过叶面喷雾及土壤灌根处理,对刺吸式害虫如蚜虫、飞虱、叶蝉、粉虱等有良好的防效[4],但与此同时在农产品和环境样品中可能会存在噻虫嗪残留[5-7],对人体健康和环境安全带来潜在的威胁[8-9]。因此,亟需研发一种灵敏、快速的噻虫嗪检测方法,以保障农产品质量安全和环境安全。
目前,已有较多的噻虫嗪残留分析方法,如高效液相色谱法[10]、气相色谱法[11-12]、高效液相色谱-串联质谱法[13-14]以及超高效液相色谱-串联质谱法[15-16]。然而,这些方法需要昂贵的设备、大量的时间、复杂的样品前处理和专业操作人员[17-18]。已有部分研究者建立了一些以抗体为基础的检测噻虫嗪残留的酶联免疫吸附测定法 (ELISA)[19-21],但是该方法不能满足人们日益提高的对分析灵敏度的要求。为了应对这些挑战,化学发光酶免疫(chemiluminescence enzyme immunoassay,CLEIA)方法应运而生。作为一种免疫分析技术,CLEIA方法除具有酶联免疫分析方法简单、快速的优势外,还可以检测更低的农药残留,灵敏度显著提高,在农药残留分析领域已引起较多的关注[22-23]。
本文的目的是研发一种灵敏、快速、可用于检测部分农产品和环境样品中噻虫嗪残留的CLEIA 分析方法。基于化学发光体系和酶联免疫分析,通过优化抗原和抗体工作浓度,封闭物种类、工作缓冲液中甲醇含量、钠离子浓度及pH值,建立噻虫嗪CLEIA 分析方法,并将该方法应用于黄瓜、青菜和水中的噻虫嗪的残留分析。
1 材料与方法
1.1 主要试剂及主要溶液配制
1.1.1 主要试剂和材料 农药标准品:噻虫嗪(thiamethoxam,纯度 ≥ 98%),上海源叶公司;啶虫脒(acetamiprid,纯度 ≥ 99%)、噻虫啉(thiacloprid,纯度 ≥ 99%)、吡虫啉(imidacloprid,纯度 ≥ 98%)、噻虫胺(clothianidin,纯度 ≥ 95%)、烯啶虫胺(nitenpyram,纯度 ≥ 97%)、氯噻啉(imidaclothiz,纯度 ≥ 98%)和呋虫胺(dinotefuran,纯度 ≥ 97%),德国Dr.Ehrenstorfer 公司。辣根过氧化物酶(horseradish peroxidase, HRP)标记的羊抗小鼠IgG 抗体,美国Bosterbio 公司;30% H2O2,中国医药集团有限公司;鲁米诺(luminol),美国Sigma-Aldrich 公司;4-碘苯酚,美国Acros 公司;明胶(gelatin)、脱脂奶粉,北京索莱宝科技有限公司;鸡卵清蛋白、胰蛋白胨,上海生工生物公司;酵母提取物,美国OXOID 公司;磷酸二氢钾、十二水合磷酸氢二钠和氯化钾 (均为分析纯),西陇科学公司;乙腈和甲醇(均为HPLC 级),美国TEDIA 公司;噻虫嗪包被原和抗噻虫嗪单克隆抗体,本实验室制备[24];黄瓜和青菜Brassica chinensis样品,分别购于合肥市肥西路徽商红府超市和合肥市蜀山区铜锣湾广场菜市场;池塘水样品,取自合肥市蜀山区杏花公园。
1.1.2 主要溶液配制 包被缓冲液(CBS):碳酸盐缓冲液(0.05 mol/L,pH 9.6);常规液(PBS):磷酸盐缓冲液(0.01 mol/L,pH 7.4);洗涤液(PBST):含体积分数0.05%Tween-20 的磷酸盐缓冲液;化学发光增强溶液 (现配现用):将鲁米诺溶液(0.01 mol/L 1.20 mL)、H2O2溶液(含体积分数0.255%H2O2的水溶液 267 μL)、4-碘苯酚溶液(0.05 mol/L 12 μL)和Tris-HCl 缓冲液(0.10 mol/L, pH 8.5)定容至12 mL。
1.2 主要仪器
Elx405TM型全自动洗板机,美国BioTek 公司;DH4000BII 型电热恒温培养箱,天津市泰斯特仪器公司;Nanodrop-1000 紫外分光光度仪,美国Thermo 公司;SpectraMaxM5 多功能酶标仪,美国Molecular Devices 公司;各规格单通道移液器、八通道移液器(100 μL)及高速离心机,德国Dr.Ehrenstorfer 公司;超高效液相色谱-串联质谱仪(ACQUITY UPLC, Xevo TQD MS, UPLC-MS/MS),美国Waters 公司;96 孔白色酶标板3922,美国Corning 公司;精密pH 试纸,英国Whatman公司;FA2004N 型万分之一天平,上海菁海仪器公司;HOKEE-A1-10 型纯水系统,合肥宏科科技公司。
1.3 化学发光读数波长和时间的选择
将化学发光增强液加入96 孔酶标板中,用多功能酶标仪扫描250~700 nm 波段,读取化学发光值,确定最适扫描波长;将化学发光增强液加入96 孔酶标板,每隔2 min 读取一次发光信号,记录发光信号值,确定最适读数时间。
1.4 间接竞争CLEIA 操作步骤
间接竞争CLEIA (Indirect competitive CLEIA,IC-CLEIA) 的操作步骤如下:
(1) 包被:用包被缓冲液将合适稀释梯度的包被原加入发光板,每孔50 μL,37 ℃孵育2 h;(2) 洗板:用洗涤液PBST 洗涤5 次,吸水纸拍干;(3) 封闭:每孔加入100 μL 封闭物,37 ℃孵育30 min;(4) 洗板:同 (2);(5) 加入噻虫嗪和抗噻虫嗪单克隆抗体混合物:每孔加入用工作缓冲液稀释的农药和单克隆抗体各25 μL,37 ℃孵育1 h;(6) 洗板:同 (2);(7) 加入酶标二抗:每孔加入50 μL 经1 : 5000 倍PBST 稀释的羊抗鼠HRP-IgG,37 ℃孵育1 h;(8) 洗板:同 (2);(9)加入发光底物:每孔加入100 μL 新配制的发光底物液,避光放置5 min;(10) 测定:终点法读取425 nm 波长下的发光值。
1.5 包被原浓度和抗体浓度的优化
用碳酸盐缓冲液稀释包被抗原,稀释倍数分别为1 : 8000、1 : 16 000、1 : 32 000、1 : 64 000、1 : 128 000 和1 : 256 000,固定抗体浓度不变,利用梯度浓度的噻虫嗪标准品溶液进行IC-CLEIA 法分析,筛选合适的包被原浓度。
用磷酸盐缓冲液稀释抗噻虫嗪单克隆抗体,稀释倍数分别为1 : 24 000、1 : 32 000、1 : 48 000、1 : 64 000、1 : 96 000 和1 : 128 000,固定抗原浓度不变,利用梯度浓度的噻虫嗪标准品溶液进行IC-CLEIA 法分析,筛选合适的抗体浓度。
1.6 工作体系的优化
1.6.1 封闭物质优化 选取质量浓度 (下同) 为5%的脱脂奶粉、2%酵母提取物、1%胰蛋白胨、1%明胶和1%鸡卵清蛋白5 种物质作为候选封闭物。首先将封闭物用磷酸盐缓冲液溶解,然后利用梯度浓度的噻虫嗪标准品溶液进行IC-CLEIA 法分析,研究5 种封闭物对减少非特异性吸附的影响。
1.6.2 pH 值优化 分别用pH 值为6.5、7.0、7.5、8.0 和8.5 的PBST 缓冲液稀释抗噻虫嗪单克隆抗体,利用梯度浓度的噻虫嗪标准品溶液进行IC-CLEIA 法分析,建立不同pH 值下的CLEIA 分析标准曲线,考察pH 值对免疫分析体系的影响。
1.6.3 甲醇含量优化 分别用甲醇体积分数为0%、5%、10%、15%、20%和25%的PBST 溶液稀释噻虫嗪标准品,并进行IC-CLEIA 法分析,建立不同甲醇含量下的CLEIA 分析标准曲线,考察甲醇含量对免疫分析体系的影响。
1.6.4 钠离子浓度优化 分别用含量为0、0.05、0.1、0.2、0.4 和0.8 mol/L 钠离子的PBST 缓冲液稀释抗噻虫嗪单克隆抗体,利用梯度浓度的噻虫嗪标准品溶液进行IC-CLEIA 法分析,建立不同钠离子浓度下的CLEIA 分析标准曲线,考察钠离子浓度对免疫分析体系的影响。
分析结果判定均以RLUmax(最大发光值)/IC50(半数抑制浓度)和IC50值作为评价标准,RLUmax/IC50越高,IC50值越低,灵敏度越高。
1.7 噻虫嗪化学发光酶免疫分析标准曲线的建立
用最优甲醇含量的PBST 溶液配制质量浓度分别为0.005、0.01、0.025、0.05、0.1、0.25、0.5、1、2.5、5、10、25、50、100、250、500 和1000 ng/mL 的噻虫嗪系列梯度标准溶液。在最优免疫分析条件下,建立基于抗噻虫嗪单克隆抗体CLEIA 法四参数Logistic 拟合标准曲线,计算IC50值、定量限(LOQ)[25]及检测范围。
1.8 交叉反应率测定
配制噻虫嗪结构类似化合物啶虫脒、噻虫啉、吡虫啉、噻虫胺、烯啶虫胺、氯噻啉和呋虫胺的浓度梯度标准溶液。在最优免疫分析条件下,采用CLEIA 法建立结构类似化合物的标准曲线,计算IC50值,并按公式 (1) 计算噻虫嗪结构类似物交叉反应率 (CR,%)。
式中:IC50T为噻虫嗪半数抑制浓度;IC50A为结构类似物半数抑制浓度。
1.9 添加回收试验
分别以黄瓜、青菜和池塘水为对象研究样品基质对CLEIA 法检测噻虫嗪残留的影响,供试样品均已利用UPLC-MS/MS 验证不含有噻虫嗪。将噻虫嗪分别添加到黄瓜、青菜和池塘水样品中进行添加回收试验,以评价建立的噻虫嗪残留CLEIA方法的可靠性。
1.9.1 样品制备 将黄瓜、青菜切成小块并匀浆。称取1 g 样品于15 mL 离心管中,加入5 mL含体积分数为5%甲醇的PBST 作为提取溶剂,用涡旋仪充分振荡提取2 min。将提取液经滤纸过滤后,4000 r/min 下离心5 min,取上清液待测;池塘水经滤纸过滤,待测。
1.9.2 基质效应评价 利用最优缓冲液直接稀释基质提取液是免疫分析中降低分析样品基质效应的常用方法。以5%甲醇的PBST 为稀释液稀释基质提取液,将黄瓜提取液分别进行10、20、30、40 倍稀释,将青菜提取液进行2、5、10、20 倍稀释,将池塘水样进行1、2、5、10 倍稀释。以不同稀释倍数的基质提取物为溶剂配制不同浓度的噻虫嗪标准溶液,并进行CLEIA 法测定。以最优缓冲液配制的噻虫嗪标准溶液测定的CLEIA 结果作为空白对照。
1.9.3 添加回收率测定和UPLC-MS/MS 方法验证
利用添加标准溶液的方式进行添加回收试验,以噻虫嗪的添加回收率和相对标准偏差 (RSD) 来评价CLEIA 法的可靠性。基于基质效应影响,黄瓜匀浆样品中分别添加100、250、500 和1000 ng/g,青菜匀浆样品中分别添加125、250、500、1250 ng/g,池塘水分别添加10、25、50 和100 ng/g 的噻虫嗪标准品,混匀后静置1 h,进行样品前处理。将提取液按一定倍数稀释后,用CLEIA 法测定回收率。为了验证CLEIA 法检测结果的准确性,黄瓜、青菜和池塘水样品添加标准品后用UPLCMS/MS 进行验证。UPLC-MS/MS 检测条件如下。
色谱条件:ACQUITY BEH C18色谱柱 (50 mm ×2.1 mm,1.7 μm),柱温为40 ℃;流动相A 为体积分数为0.1%的甲酸水溶液,流动相B 为乙腈,流速为0.2 mL/min;梯度程序:0.00~0.25 min,10% B;> 0.25~1.00 min,95% B;> 1.00~2.00 min,10% B;> 2.00~4.50 min,10% B。总运行时间为4.50 min。样品进样体积为5 μL。
质谱条件:电喷雾电离方式,正离子模式(ESI+);离子源温度为150 ℃,雾化气和辅助气的氮气流速分别为50 和1000 L/h。脱溶温度为500 ℃。质谱分析的离子跃迁、锥孔电压和碰撞电压如附表S1 所示。
1.10 真实样品采集与检测
分析样品从学校周边的超市和公园采集,按照1.9.1 节所述样品前处理方法将采集的青菜、黄瓜、池塘水样品进行前处理,处理好的样品根据基质效应评价中消除基质效应的稀释倍数进行稀释,将稀释后的样品进行CLEIA 法测定,同时用UPLC-MS/MS 进行验证。
2 结果与讨论
2.1 化学发光信号特征
经过多功能酶标仪扫描,得到鲁米诺的化学发光发射波谱如图1 所示。在波长425 nm 处,鲁米诺发光的信号响应最高 (图1A),故以其为最大发射波长。在该波长下扫描30 min,得到化学发光动力曲线 (图1B)。由图1B 可知,化学发光值随着时间的增加先升高后降低,在4~6 min 之间化学发光值达到峰值并趋于平衡,因此,本文选取5 min 进行读数。

图1 化学发光信号特征图谱Fig.1 Characteristic atlas of chemiluminescence signal
2.2 包被原浓度和单克隆抗体浓度的选择
为了获得较低的定量限和较好的重现性,需要对抗原抗体工作浓度进行优化。抗原浓度筛选采取固定抗体浓度,对抗原浓度进行梯度稀释,再进行IC-CLEIA 分析,结果如图2A 所示。依据结果判定标准,随着包被抗原稀释倍数的提高,IC50值呈现逐渐降低的趋势,而RLUmax/IC50则呈现先增加后降低的趋势。在稀释64 000 倍时IC50值较低,RLUmax/IC50较高,灵敏度达到最高。因此,选择抗原稀释64 000 倍作为最优包被原工作浓度,即0.075 mg/L。
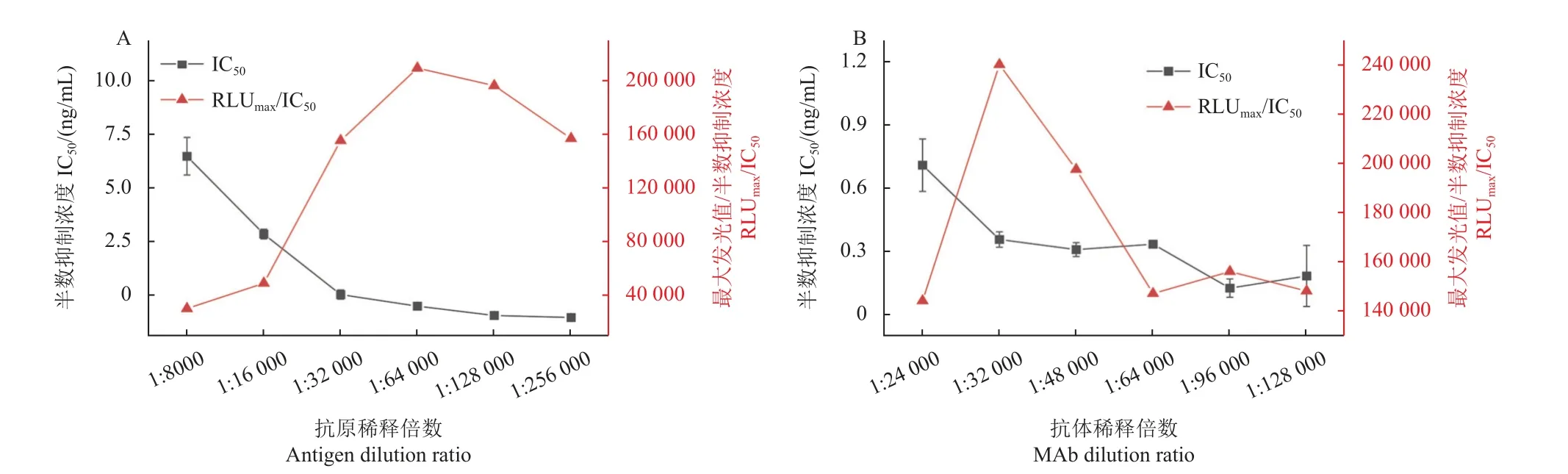
图2 包被抗原和抗体的浓度优化 (n = 3)Fig.2 Concentration optimization of coating antigen and anti-thiamethoxam monoclonal antibodies (n = 3)
抗噻虫嗪单克隆抗体工作浓度的筛选采取固定抗原浓度,对抗体浓度进行系列稀释,再进行IC-CLEIA 分析,结果如图2B 所示。依据结果判定标准,随着抗噻虫嗪单克隆抗体稀释倍数的提高,IC50值呈现逐渐降低的趋势,而RLUmax/IC50还是呈现先增加再降低的趋势。在稀释32 000 倍时IC50值较低,RLUmax/IC50较高,灵敏度达到最高。因此,选择抗体稀释32 000 倍作为最优抗体工作浓度,即0.0304 mg/L。
2.3 工作体系的优化
封闭物可以减少免疫分析中的非特异性吸附,一般是明胶或其他惰性蛋白。封闭物通过结合固相载体的空余位点,进而减少或避免发生非特异性吸附。依据质量浓度为5% 的脱脂奶粉、2%酵母提取物、1%胰蛋白胨、1%明胶和1%鸡卵清蛋白5 种封闭物的IC-CLEIA 分析结果,由图3A 可知,以1% 明胶封闭时具有较好的灵敏度。因此,选择1% 明胶作为CLEIA 分析的封闭物。
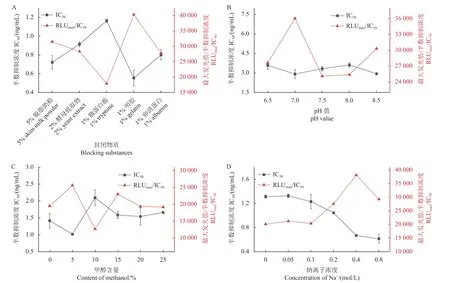
图3 工作体系的优化 (n = 3)Fig.3 Optimization of working system (n = 3)
pH 值对分析方法的影响如图3B 所示,随着工作缓冲液的pH 值升高,IC50值呈现先降低后增加再降低的趋势,RLUmax/IC50也受到影响而波动。依据结果判定标准,当pH = 7.0 时,方法的灵敏度达到最高。因此,选择pH7.0 的PBST 缓冲液作为最优pH 值工作缓冲液。
有机溶剂可以提升噻虫嗪标准品在工作缓冲液中的溶解效果,但可能会影响免疫反应的灵敏度。在甲醇含量分别为0%、5%、10%、15%、20%和25%的PBST 缓冲液体系中 (图3C),随着甲醇含量升高,IC50值先降低再增加,后又平缓降低,依据结果判定标准,当甲醇含量为5%时,方法的灵敏度达到最高。因此,选择含5%甲醇的PBST缓冲液作为最优甲醇浓度工作缓冲液。
钠离子浓度对分析方法的影响如图3D 所示,随着工作缓冲液中钠离子浓度的升高,IC50值不断降低,RLUmax/IC50先升高后降低。依据结果判定标准,当钠离子工作浓度为0.4 mol/L 时,方法的灵敏度达到最高。因此,选择含0.4 mol/L 钠离子的PBST 缓冲液作为最优钠离子浓度工作缓冲液。
2.4 CLEIA 方法的建立
在上述最优的分析条件下,进行噻虫嗪ICCLEIA 分析。用Origin Pro 软件分析数据并绘制标准曲线。以噻虫嗪浓度的对数为横坐标,以结合率为纵坐标,建立CLEIA 检测噻虫嗪标准抑制曲线 (图4)。标准曲线线性方程为y= -0.4418x+0.5014 (R2= 0.9842),线性范围为0.125~12.5 ng/mL,IC50值为1.007 ng/mL,方法的定量限 (LOQ) 为0.125 ng/mL。结果表明该方法线性范围较宽,具有较好的分析灵敏度。
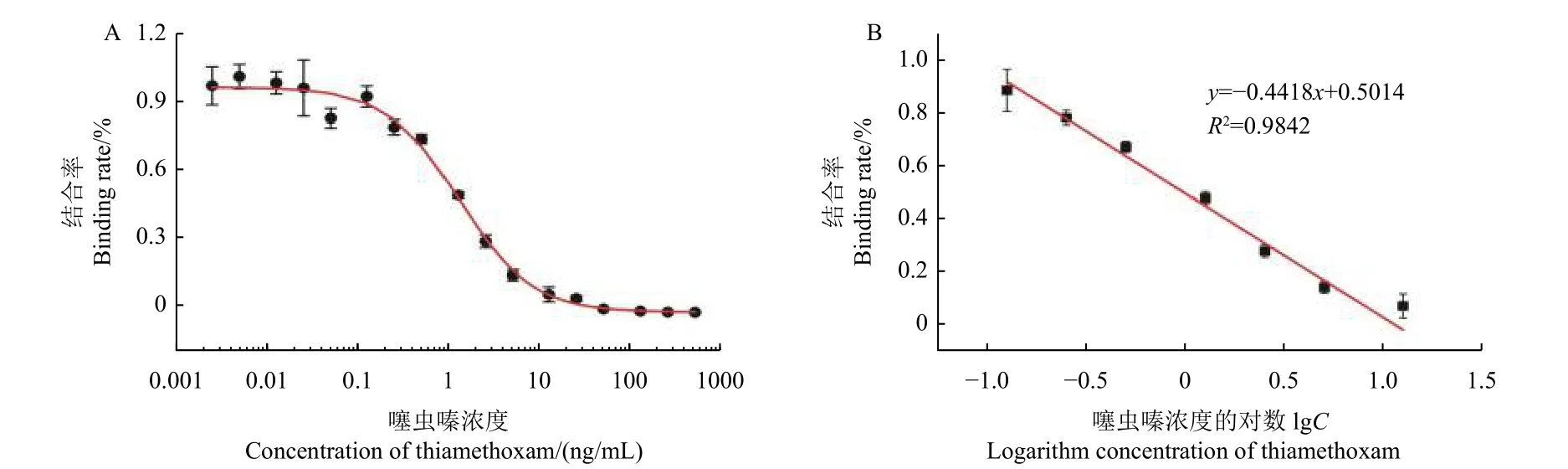
图4 CLEIA 检测噻虫嗪的标准曲线 (n = 3)Fig.4 Standard curve for CLEIA detection of thiamethoxam (n = 3)
2.5 交叉反应率测定
利用IC-CLEIA 方法对7 种噻虫嗪结构类似物进行检测,类似物的IC50值和交叉反应率 (表1)显示,噻虫嗪结构类似物的交叉反应率均不高于0.3%,表明本文建立的IC-CLEIA 方法具有较高的特异性。
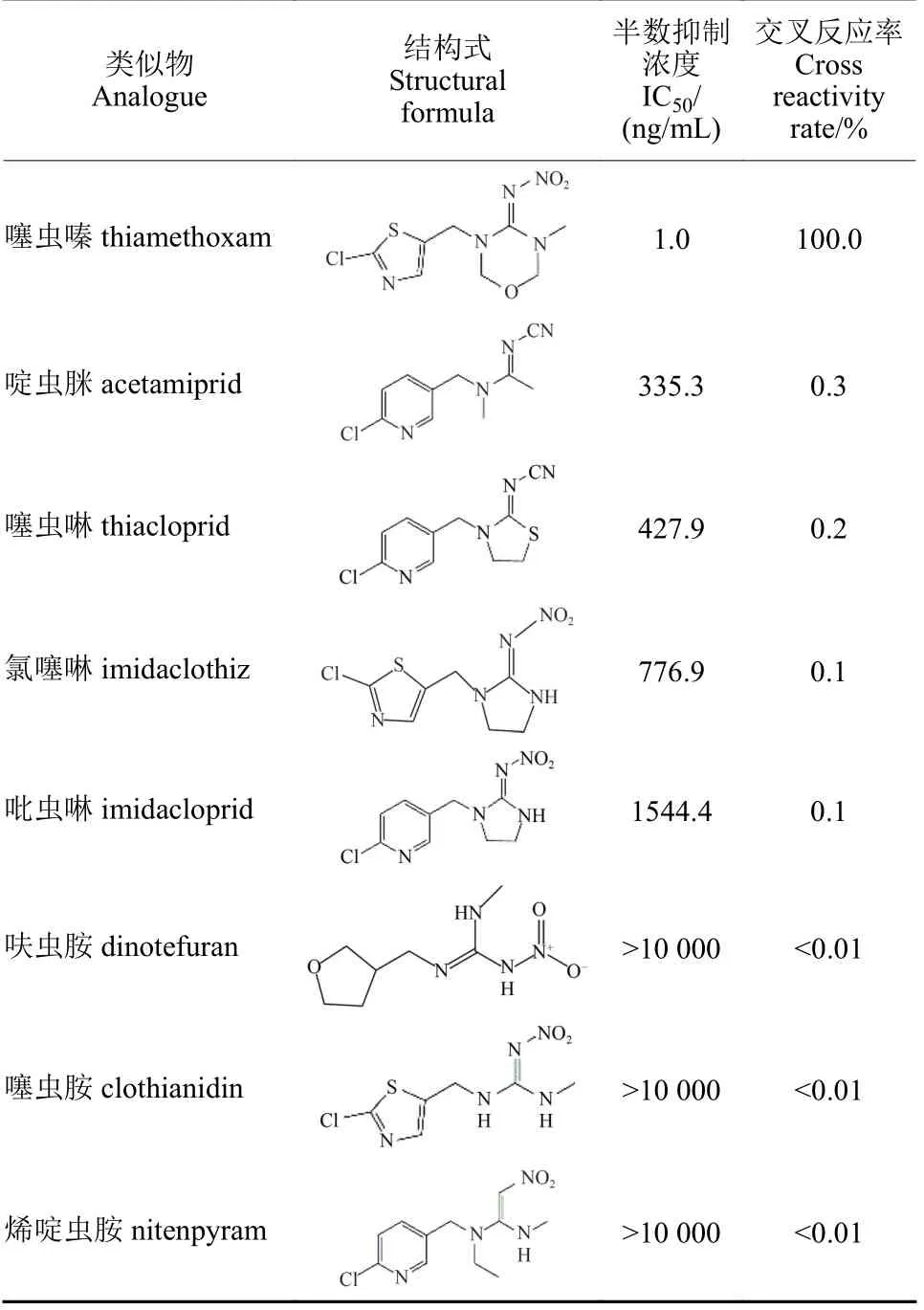
表1 基于CLEIA 测定噻虫嗪结构类似物的交叉反应性 (n = 3)Table 1 Cross-reactivity of analogues structurally related to thiamethoxam determined by CLEIA (n = 3)
2.6 基质效应评价
为减少样品基质中的色素、酚类、脂类和重金属等干扰成分影响,提高免疫分析结果的可靠性,本研究利用最优工作缓冲液稀释样品基质提取液,进而实现减小样品基质影响,结果如附图1所示。通过与空白对照 (最优缓冲液,不含有样品基质提取物) 结果比较可知,黄瓜提取物稀释20 倍、青菜提取物稀释20 倍时与空白对照接近且稀释倍数最低,池塘水稀释10 倍时与空白对照最接近。根据分析结果,选择黄瓜样品20 倍稀释、青菜样品20 倍稀释和池塘水样品10 倍稀释处理进行下一步试验。
2.7 添加回收试验结果
黄瓜、青菜和池塘水样品添加回收结果如表2所示。噻虫嗪的添加浓度以最终工作浓度落在检测线性范围内为依据。噻虫嗪在黄瓜、青菜和池塘水样品的添加回收率为86%~108%,RSD 为2.6%~9.1%。UPLC-MS/MS 法是具有法律效力的定性定量确证工具,通过UPLC-MS/MS 检测结果与CLEIA 检测结果相比较,可以确证检测结果的可靠性。结果表明,UPLC-MS/MS 方法的回收率为82%~120%,RSD 为2.0%~10.4%,两种方法分析结果具有良好的一致性。根据GB 2763—2021《食品安全国家标准食品中农药最大残留限量》的规定[26],噻虫嗪在黄瓜上的最大残留限量 (MRL) 值为0.5 mg/kg,因此,该方法能够满足我国农药残留限量标准的要求,适用于噻虫嗪农药在黄瓜、青菜和池塘水等样品中的残留检测。
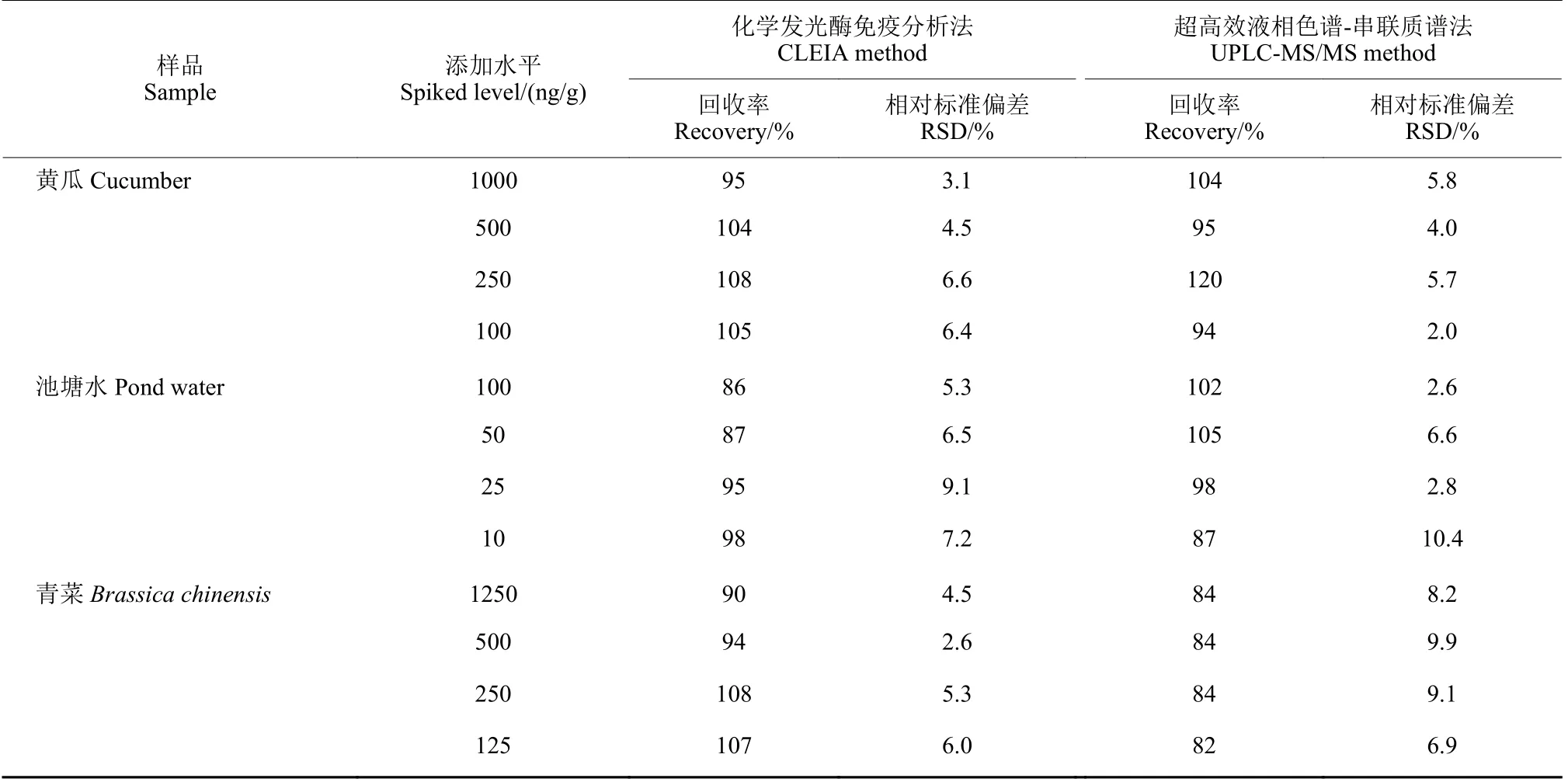
表2 CLEIA 和UPLC-MS/MS 检测添加噻虫嗪样品的回收率和相对标准偏差 (n = 3)Table 2 Recovery studies and relative standard deviation of sample spiked with thiamethoxam by CLEIA and UPLC-MS/MS (n = 3)
2.8 真实样品分析
黄瓜、青菜、池塘水样品的CLEIA 和UPLCMS/MS 检测结果如附表2 所示。结果显示,实验采集的3 份黄瓜样品、3 份青菜样品、1 份池塘水样品中噻虫嗪残留均低于两种方法的检出限,表明市场销售的黄瓜和青菜样品以及环境中的池塘水样品中噻虫嗪残留风险较低。
3 结论与讨论
噻虫嗪作为第2 代新烟碱类杀虫剂的代表,具有持效期长、施药方式灵活、杀虫谱广和相对低毒等特点,但相关研究表明其慢性毒性仍需引起关注。免疫分析方法是重要的快速筛查手段之一,为保障农产品安全和环境安全提供了重要的技术支撑。本研究以酶免疫反应为基础,引入化学发光体系放大反应信号响应,通过分析方法的优化,首次建立了噻虫嗪CLEIA 分析方法。通过与已经报道的噻虫嗪ELISA 分析方法 (如表3 所示) 相比较,该方法具有较高的分析灵敏度和较宽的线性范围。同时,由于使用含5%甲醇的PBST 最优缓冲液提取样品即可实现准确分析检测样品中的噻虫嗪残留,因此,该方法简化了样品前处理环节,显著减少了有机溶剂的使用。因此,本文建立了一种前处理简单、环境友好、灵敏度高的CLEIA 分析方法,符合我国现行的噻虫嗪最大残留限量要求,为噻虫嗪残留检测提供了新的技术支持。然而,由于本文建立的方法能够特异性识别噻虫嗪的六元杂环,所以对噻虫嗪的主要代谢产物噻虫胺几乎不识别 (交叉反应率小于0.01%),造成该方法在分析环境和农产品中的噻虫嗪及其代谢物残留时具有一定的局限性。
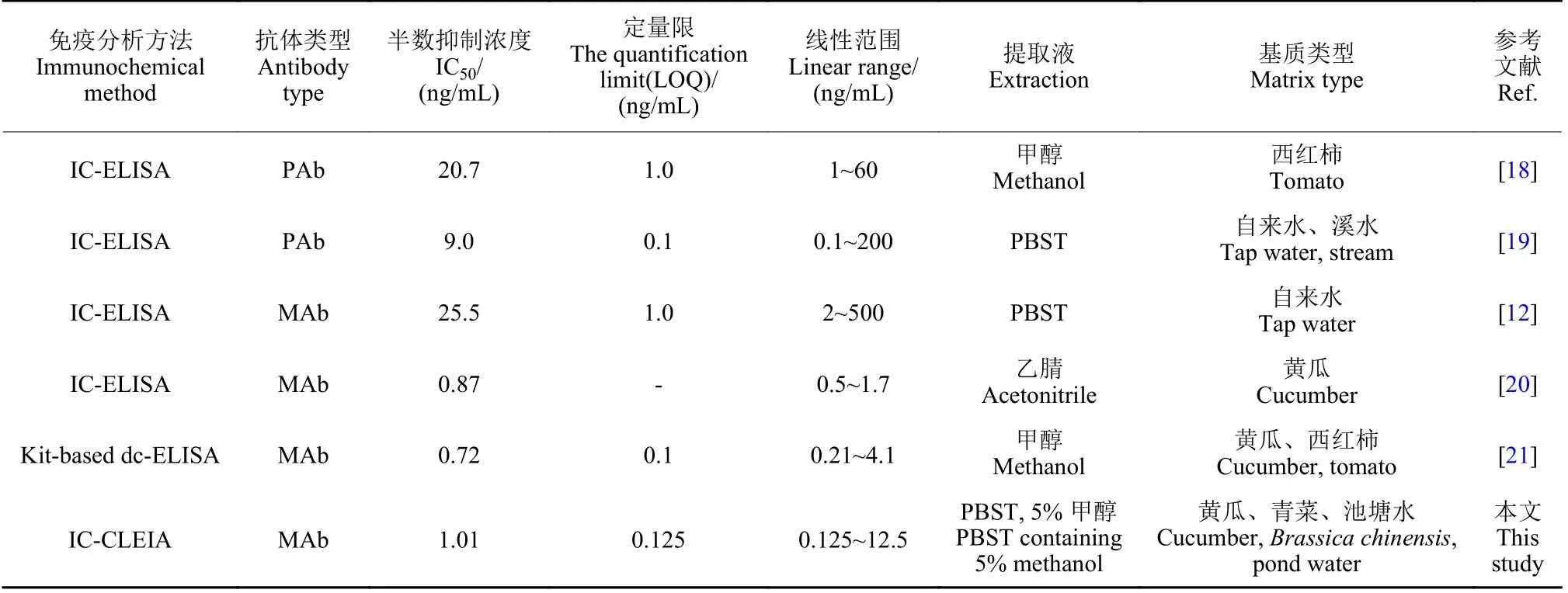
表3 CLEIA 方法和ELISA 方法检测噻虫嗪的性能比较Table 3 Comparison of performance between CLEIA method and ELISA method in the detection of thiamethoxam
