新型2,6-二氟苯甲酰脲类化合物对草地贪夜蛾的生物活性及其几丁质合成的影响
2023-09-03陈金鹏南晓慧孙然锋
陈金鹏, 谢 佳, 赵 柯, 胡 展, 张 羲, 南晓慧, 孙然锋
(海南大学 植物保护学院,热带农林生物灾害绿色防控教育部重点实验室,海口 570228)
草地贪夜蛾Spodoptera frugiperda属于鳞翅目夜蛾科灰翅夜蛾属,原产于南美洲与北美洲的南部与中部,于2019 年1 月首次从云南省侵入我国,其寄主范围广泛,同时还具有强大的迁飞能力和繁殖能力,可致使农作物大幅度减产并造成难以估量的经济损失[1]。传统化学农药在对草地贪夜蛾的防治中仍占据重要地位,农业农村部推荐的用于草地贪夜蛾应急防治的化学农药单剂共有11 种,分别为:甲氨基阿维菌素苯甲酸盐、茚虫威、四氯虫酰胺、氯虫苯甲酰胺、高效氯氟氰菊酯、氟氯氰菊酯、甲氰菊酯、溴氰菊酯、乙酰甲胺磷、虱螨脲和虫螨腈 (http://www.gov.cn/xinwen/2019-06/10/content_5398774.htm),其中,虱螨脲属于苯甲酰脲类杀虫剂,结构式见图式1。作为几丁质合成抑制剂,苯甲酰脲类杀虫剂因具有独特的作用机制、较高的环境安全性及对鳞翅目高效的杀虫活性等特点得到了广泛关注和应用及对此类化合物的结构改造一直是农药学研究的热点[2]。
目前对苯甲酰脲类化合物的改造主要围绕苯甲酰基部分 (A 环)、脲桥 (C) 和苯基部分 (B 环)3 部分进行[3](图式1),通过改造各部分的取代基,使其电子效应、空间位阻发生改变,从而影响杀虫活性[4-6]。多数研究表明,在A 环部分,2,6-二氟取代优于2,6-二氯取代,如2,6-二氟苯甲酰脲的杀虫活性是2,6-二氯苯甲酰脲的20 倍;而苯甲酰环被芳香杂环或环烷基取代,其杀虫活性会降低[7-9];在B 环部分,2,6 位上有大分子基团不利于杀虫活性,4 位上有吸电子基团则有利于杀虫活性[3]。
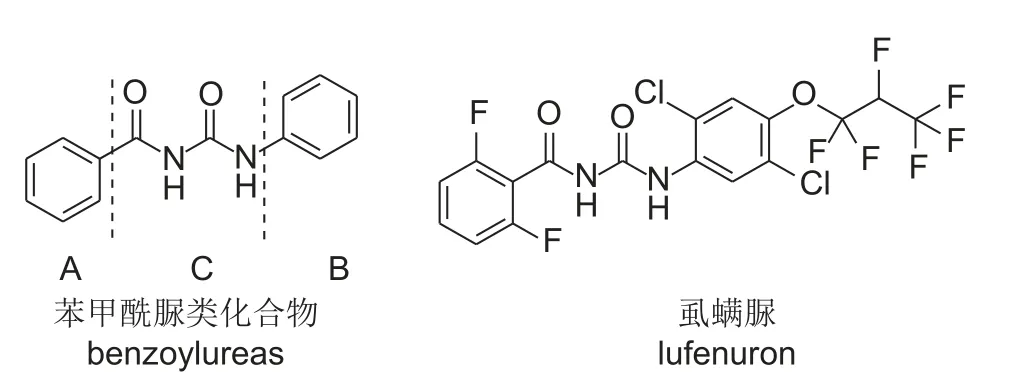
图式1 苯甲酰脲类化合物和虱螨脲的结构Scheme 1 Structures of benzoylurea compounds and lufenuron
Wang 等报道了肟醚类苯甲酰脲类化合物NK-17 (图式2) 对鳞翅目害虫具有优异的杀虫活性[10]。为了提高其脂溶性以便于其更好地开发利用,本研究设计合成了化合物(E)-N-((4-((叔丁氧亚氨基)甲基)苯基)甲氨基甲酰基)-2,6-二氟苯甲酰胺(HN-21),并评价了其对草地贪叶蛾幼虫的生物活性。目标化合物的设计见图式2,合成路线见图式3。

图式2 化合物HN-21 的设计Scheme 2 Design of compound HN-21
另外,苯甲酰脲类化合物通过抑制昆虫体内几丁质的合成和沉积影响昆虫的生长发育过程已十分确定,处理受试昆虫后使其体内几丁质含量降低,在蜕皮过程中死亡[3,11-13]。对其候选分子靶标之一几丁质合成酶1 (chitin synthase 1,CHS1)的影响的研究显示,除虫脲对厩螫蝇Stomoxys calcitrans蛹的CHS 活力几乎没有影响[14];而用0.5 mg/L 除虫脲处理四斑按蚊Anopheles quadrimaculatus24 h 后CHS1的表达量显著升高[15];用除虫脲、氟铃脲和氟苯脲处理鲑鱼虱Lepeophtheirussalmonis若虫后CHS1表达量却在中期微弱下调[16]。表明不同化合物对不同生物几丁质合成的影响存在差异,而不同活性的化合物对昆虫几丁质合成通路的影响差异却鲜有系统研究。因此,本研究以新型苯甲酰脲类化合物HN-21 为例,探究其对草地贪夜蛾幼虫的杀虫活性,并从海藻糖含量、几丁质含量和基因表达量等多个层面与推荐用药虱螨脲对几丁质合成过程的影响进行比较,旨在阐明杀虫机理与杀虫活性之间的关联,为苯甲酰脲类化合物更好地开发利用提供理论依据。
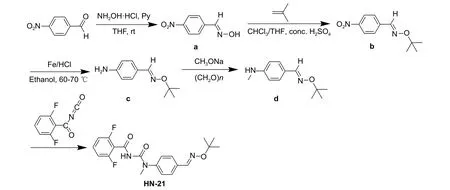
图式3 化合物HN-21 合成路线Scheme 3 Synthetic route of compound HN-21
1 材料与方法
1.1 昆虫饲养
供试草地贪夜蛾源自于海南大学植物保护学院,饲养于海南大学植物保护学院生物测定中心。饲养环境条件为温度 (27 ± 1) ℃,相对湿度 (70 ± 5)%,光照周期为16L : 8D。幼虫饲喂改良的人工饲料[17],成虫以10%蜂蜜水喂养。
1.2 主要试剂与仪器
化学试剂均为分析纯,购自西陇化工有限公司;生物试剂,均购自上海碧云天生物科技有限公司;虱螨脲 (lufenuron,有效成分含量5%,剂型:乳油),购自欣丰农业科技有限公司。
主要仪器:ABI Q5 型荧光定量PCR 仪 (美国赛默飞世尔科技公司);Infinite M200 PRO 型全波长酶标仪 (瑞士TECAN 公司);HC110-Pro 型金属浴 (北京大龙兴创实验仪器股份公司);X-4 型数字显示显微熔点仪 (北京泰克仪器有限公司);Bruker Avance 400 型核磁共振分析仪 (瑞士Bruker 公司);质谱分析仪Agilent 6210 ESI/TOF MS (美国安捷伦科技公司)。
1.3 HN-21 的合成及溶解能力测定
1.3.1 4-硝基苯甲醛肟 (a) 的合成 参考文献[18]的方法进行。在250 mL 三口烧瓶中加入80 mmol对硝基苯甲醛,加入80 mL 无水四氢呋喃使其溶解,再加入96 mmol 盐酸羟胺,用恒压滴液漏斗缓慢加入88 mmol 吡啶。滴加完毕,室温搅拌4 h,薄层色谱 (TLC,V(石油醚) :V(乙酸乙酯) = 5 : 1)监测至原料反应完全。加水停止反应,用乙酸乙酯萃取。有机相依次用2%稀盐酸、饱和碳酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥,滤液经旋转蒸发仪减压旋除溶剂后得黄色固体。用V(石油醚) :V(乙酸乙酯) = (10~20) : 1 混合溶剂重结晶得淡黄色针状晶体a,收率为90.5%。
1.3.2 (E)-O-叔丁基-4-硝基苯甲醛肟 (b) 的合成参考文献[18]的方法,在250 mL 三口瓶中加入19.2 mmol 化合物a,用10 mL 无水四氢呋喃溶解后加入50 mL 氯仿,升温至50~60 ℃,通入新制得的异丁烯气体,缓慢滴加1.8 mL 浓硫酸。滴加完毕,保持该温度反应,TLC (V(石油醚) :V(乙酸乙酯) = 10 : 1) 监测至原料反应完全。停止反应,冷却至室温,用水洗涤2 次,有机相用饱和碳酸氢钠溶液洗涤至中性,无水硫酸钠干燥。经柱层析 (石油醚) 分离出黄色固体b,产率为85.4%。
1.3.3 (E)-O-叔丁基-4-氨基苯甲醛肟 (c) 的合成
参考文献[19] 的方法,在100 mL 三口瓶中,加入6.8 mmol 化合物b、30 mL 乙醇和5 mL 水,加热使其溶解,在60~70 ℃下加入1 mL 浓盐酸,并分4 批加入23.8 mmol 还原铁粉,每隔20 min 补加50 μL 浓盐酸,使溶液保持酸性,TLC (V(石油醚) :V(乙酸乙酯) = 3 : 1) 检测至原料反应完全。停止加热,趁热过滤,用乙醇洗涤固体,滤液用氢氧化钠调节pH 至9~10,有深蓝色沉淀析出;再次过滤,滤液加水后用乙酸乙酯萃取,有机相用饱和食盐水洗涤,无水硫酸钠干燥。经柱层析(V(石油醚) :V(乙酸乙酯) = 3 : 1) 分离,得红色液体c,产率为78.9%。
1.3.4 (E)-N-甲基-O-叔丁基-4-氨基苯甲醛肟 (d)的合成 在250 mL 三口瓶中,加入10.6 mmol 化合物c 和70 mL 无水甲醇,再加入53 mmol 甲醇钠,室温搅拌下加入53 mmol 多聚甲醛,加热回流2 h。冷却至室温,加入53 mmol 硼氢化钠,加热回流2 h,停止反应。冷却,旋转蒸发除去大部分甲醇,加入饱和碳酸氢钠溶液,用乙醚萃取3 次,合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥,过滤,旋转蒸发除去溶剂,经柱层析 (V(石油醚) :V(乙酸乙酯) = 4 : 1) 分离得到化合物d,收率为72.8%。
1.3.5 目标化合物HN-21 的合成 在50 mL 三口瓶中,加入5.4 mmol 化合物d 和10 mL 二氯甲烷,室温下用恒压滴液漏斗缓慢加入含有5.6 mmol 2,6-二氟苯甲酰基异氰酸酯的二氯甲烷溶液。滴加完毕,室温搅拌8 h 至反应完全。先经柱层析(V(石油醚) :V(乙酸乙酯) = 3 : 1) 分离,再用V(石油醚) :V(乙酸乙酯) = (10~20) :1 混合溶剂重结晶得到化合物HN-21,收率为73.1%。随后测定化合物HN-21 溶解能力,并与NK-17 的溶解能力作比较。
1.4 生物活性测定
采用叶片药膜法[20]测定化合物HN-21 对于草地贪夜蛾2 龄1 d 幼虫的杀虫活性。准确称量5 mg HN-21,用1 mLN,N-二甲基甲酰胺 (DMF) 溶解,得到5000 mg/L 的HN-21 母液,备用。
用体积分数为0.2‰ 的DMF 水溶液将HN-21母液稀释至1.5、1.0、0.50、0.25、0.10 mg/L,将合适大小的玉米叶片在药剂中浸泡20 s,取出晾干,置于培养皿中,并接入饥饿处理后的草地贪夜蛾幼虫1 头,每处理组20 头幼虫,每处理重复3 次。以无菌水为空白对照组,以0.2‰ DMF 水溶液为阴性对照组,以10.052 mg/L (经测定所得虱螨脲的致死中浓度 (LC50值) ) 的虱螨脲溶液为阳性对照组。每隔12 h 观察一次结果,用毛笔轻触试虫,试虫无反应视为死亡。所测数据用IBM SPSS Statistics 26 求得毒力回归方程,并计算LC50值。
1.5 草地贪夜蛾幼虫总RNA 的提取及cDNA 的合成
以无菌水为空白对照,以体积分数为0.2‰ 的DMF 水溶液为阴性对照,分别以虱螨脲0.681 mg/L(化合物HN-21 LC50同等浓度)、虱螨脲10.052 mg/L作为阳性对照-1 组和阳性对照-2 组,以HN-21 0.681 mg/L (HN-21 LC50)为待测药剂对草地贪夜蛾幼虫进行处理。
分别取不同处理0、24、48 和72 h 后的草地贪夜蛾幼虫 (有表型且为存活状态),使用Trizol试剂盒进行RNA 的提取,以3 只为一组,每处理重复3 次。提取后用1% 的琼脂糖检测RNA 质量,使用微量核酸测定仪 NanoPhotometer®测定提取 RNA 的浓度及纯度。使用试剂HiScript Ⅲ RT SuperMix for qPCR( + gDNA wiper)进行 cDNA 第一链的合成。试验进行3 次生物学重复。
1.6 几丁质合成通路相关基因表达量的测定
利用实时荧光定量PCR (qRT-PCR) 分析了不同处理组试虫体内与几丁质合成相关基因的表达水平[19],包括:海藻糖酶1 (TRE1)、海藻糖酶2(TRE2)、己糖激酶 (hexokinase,HK)、葡萄糖-6-磷酸异构酶 (glucose-6-phosphate isomerase,G6PI)、6-磷酸果糖转氨酶 (fructose-6-phosphate transaminase,GFAT)、氨基葡萄糖-磷酸N-乙酰转移酶 (glucosaminephosphate N-acetyltransferase,GNPNA)、磷酸乙酰氨基葡萄糖变位酶 (phosphoacetylglucosamine mutase,PAGM)、二磷酸尿核苷-N-乙酰氨基葡萄糖焦磷酸化酶 (UDP-N-acetylglucosamine pyrophosphorylase,UAP)、几丁质合成酶1 (CHS1)、几丁质合成酶2 (CHS2)等[21]。以核糖体蛋白基因L7(ribosomal protein L7,RPL7) 为内参基因[22],PCR引物见表1。

表1 实时荧光定量PCR 检测基因引物序列Table 1 Primer sequences for qRT-PCR detection
准备qRT-PCR 反应体系 (10 μL):Primer F(10 μmol/L) 0.25 μL、Primer R (10 μmol/L) 0.25 μL、模板cDNA 样品1 μL、ddH2O 3.5 μL、荧光定量试剂Hieff®qPCR SYBR®Green Master Mix(Low Rox Plus) 5 μL。
设置PCR 反应程序:95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸32 s,40 个循环。qRT-PCR 数据采用 2-ΔΔCT法进行分析。计算公式:2-ΔΔCT= 2-[(CT待测组-CT 待测RPL7)-(CT 对照组-CT 对照 RPL7)][23]。
1.7 海藻糖含量的测定
以无菌水为空白对照,以0.2‰ DMF 水溶液为阴性对照,分别以虱螨脲0.681 mg/L 和10.052 mg/L 作为阳性对照-1 组和阳性对照-2 组,以HN-21 0.681 mg/L 为处理组,对2 龄草地贪夜蛾幼虫进行处理。
将不同处理后的5 只草地贪夜蛾幼虫放入1.5 mL 离心管中,加入200 μL 生理盐水,用研磨杵充分研磨后再加入800 μL 生理盐水。在4 ℃、5000 r/min 下离心15 min,取上清液用于海藻糖含量的测定,沉淀留待备用。试验进行3 次生物学重复。采用蒽酮法测定海藻糖含量[24-25]。
1.8 几丁质含量的测定
取1.7 节中离心后的沉淀,测定几丁质含量[15]。用质量分数为3%十二烷基硫酸钠溶液重新悬浮沉淀后用蒸馏水清洗;根据样品质量加入适量饱和氢氧化钾溶液,于130 ℃鼓风干燥箱中悬浮沉淀;于冰上冷却,加入75% (体积分数) 冰乙醇;加入Celite 混悬液后用40% 冰乙醇和蒸馏水清洗沉淀;加入0.5 mL 蒸馏水悬浮沉淀,并吸取混合液至新的EP 管中;加入50 μL 质量分数为10%的NaNO2和10%的KHSO4,在4 ℃、4500 r/min 下离心15 min;吸取60 μL 上清液至离心管中,加入新鲜的3-甲基苯并噻唑酮腙盐酸盐溶液,100 ℃金属浴5 min,室温冷却;加入20 μL 质量分数为0.83%的FeCl3溶液,静置,检测650 nm的OD 值。
1.9 数据统计与分析
所得数据采用 IBM SPSS Statistics 26 软件中单因素方差分析turkey HSD 分析差异显著性 (P≤0.05),数值用平均值 ± 标准误差表示,并使用GraphPad Prism 7 软件绘图。
2 结果与分析
2.1 化合物HN-21 的结构鉴定及溶解能力
白色固体,产率73%,m.p.131~132 ℃。1H NMR(400 MHz, Chloroform-d)δ8.06 (s, 1H), 7.71 (d,J=8.5 Hz, 3H) 7.38 (tt,J= 8.4, 6.4 Hz, 1H),7.29 (d,J=8.5 Hz, 2H), 6.94 (dd,J= 8.5, 7.7 Hz, 2H),3.26 (s,3H), 1.38 (s, 9H).13C NMR(101 MHz, Chloroform-d)δ161.68, 160.59, 160.52, 158.08, 158.02, 150.61,145.57, 141.65, 133.77, 133.75, 131.91, 131.81,131.71, 128.73, 127.32, 114.36, 114.16, 113.97,111.69, 111.67, 111.50, 111.47, 111.45, 79.74, 77.38,77.06, 76.74, 37.56, 27.59; ESI-HRMS:m/z[M +H]+: C20H22F2N3O3, 计算值:390.1551, 测量值:390.1657 (图S1,图S2,图S3)。溶解能力检测结果显示,化合物NK-17 在0.1% DMF 水溶液中的溶解能力为 76.67 mg/L,而结构改造后的化合物HN-21 则为148.33 mg/L,为NK-17 的1.93 倍(图S4)。
2.2 药剂处理后试虫死亡率及症状
生物测定结果显示,虱螨脲与HN-21 均呈现出明显杀虫效果,中毒试虫表现为头胸蜕裂线开裂,但旧表皮无法成功蜕去,导致蜕皮过程受阻而死亡 (图1,表2)。其中,虱螨脲对草地贪夜蛾2 龄幼虫72 h 的LC50值为10.052 mg/L,而HN-21 的LC50值为0.681 mg/L,约为虱螨脲LC50值的1/15,表明化合物HN-21 对草地贪夜蛾具有更高的致死毒性 (图2)。

图1 各处理组草地贪夜蛾幼虫表型 (Bar = 0.5 cm)Fig.1 Phenotypes of S.frugiperda larvae in each treatment group
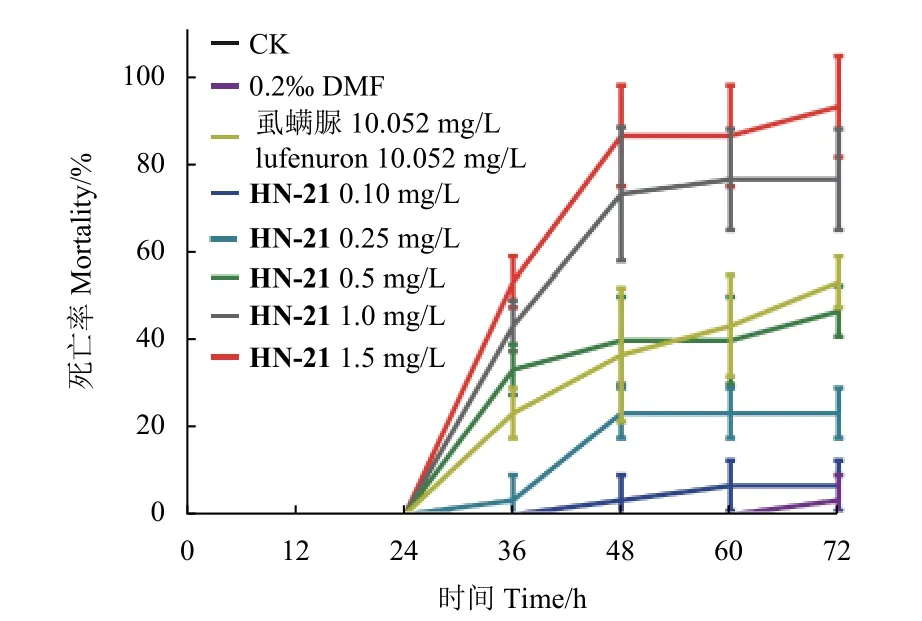
图2 各处理组草地贪夜蛾幼虫死亡率Fig.2 Mortality of S.frugiperda larvae in each treatment group
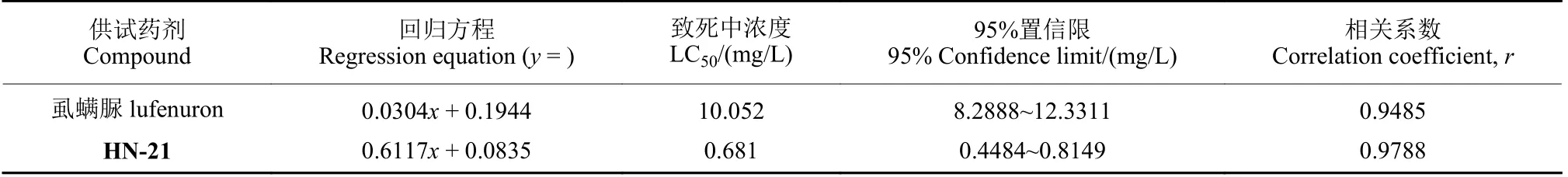
表2 供试药剂对草地贪夜蛾的杀虫活性 (72 h)Table 2 Toxicities of lufenuron and HN-21 against S.frugiperda (72 h)
2.3 药剂处理后海藻糖含量变化
在2 龄草地贪夜蛾1~3 d 的发育期内,CK 组体内的海藻糖含量呈现先下降后上升的趋势。虱螨脲0.681 mg/L 组、10.052 mg/L 组和HN-21 0.681 mg/L 组试虫体内海藻糖含量与对照组相比均无显著差异 (图3)。
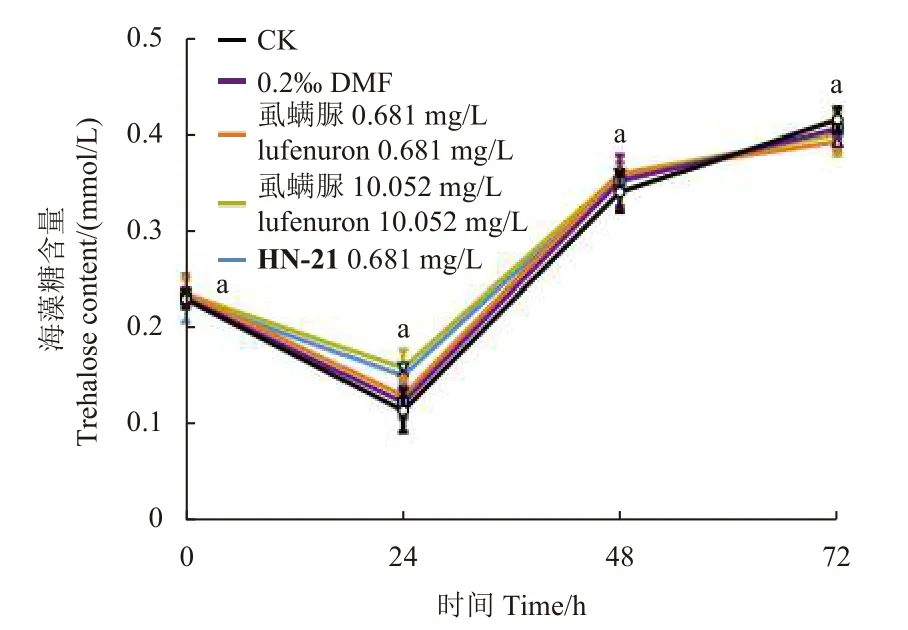
图3 各处理组草地贪夜蛾幼虫体内海藻糖含量Fig.3 Trehalose content in S.frugiperda larvae in each treatment group
2.4 药剂处理后几丁质含量的变化
经处理24~72 h 期间,CK 组的试虫体内几丁质含量逐渐上升,虱螨脲0.681 mg/L 组试虫几丁质含量与CK 组相比无显著差异,而虱螨脲10.052 mg/L组和HN-21 0.681 mg/L 组试虫体内几丁质含量分别下降至CK 的49.6%和76.3%;处理48~72 h 后,虱螨脲10.052 mg/L 组和HN-21 0.681 mg/L组之间已无显著差异,几丁质含量在48 h 时分别下降至CK 的12.3%和18.6%,而72 h 时下降至10.5%和8.7% (图4)。
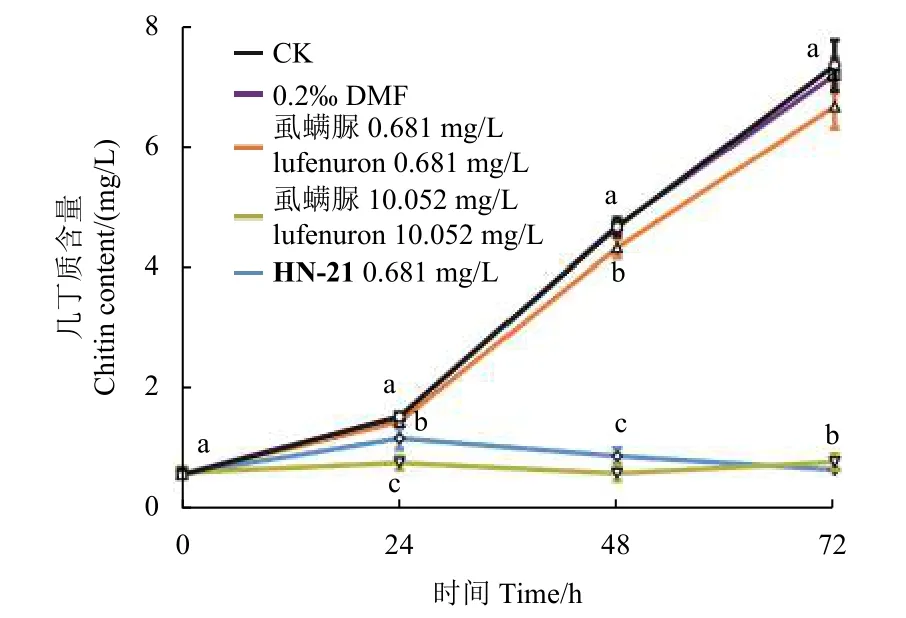
图4 各处理组草地贪夜蛾幼虫体内几丁质含量Fig.4 Chitin content of S.frugiperda larvae in each treatment group
2.5 药剂处理对几丁质合成通路相关基因表达量的影响
与CK 组与0.2‰ DMF 组相比,虱螨脲0.681 mg/L组试虫体内几丁质合成相关基因的表达量在所测时间点均无显著差异;处理24 h 后,虱螨脲10.052 mg/L 组试虫sfTRE1、sfHK、sfG6PI、sfGFAT、sfGNPNA、sfCHS1和sfCHS2的表达量显著下降。而HN-21 0.681 mg/L 组则在48 h 时出现了多个基因的表达量下调,大多数基因下调倍数与虱螨脲10.052 mg/L 组无显著性差异;另外,在24~72 h 内,与CK 组及0.2‰ DMF 组相比,虱螨脲10.052 mg/L 组试虫体内sfPAGM的表达量无显著差异,sfUAP的表达量显著下降;而HN-21 0.681 mg/L 组试虫体内sfPAGM表达量显著上升,sfUAP表达量无显著差异 (图5)。
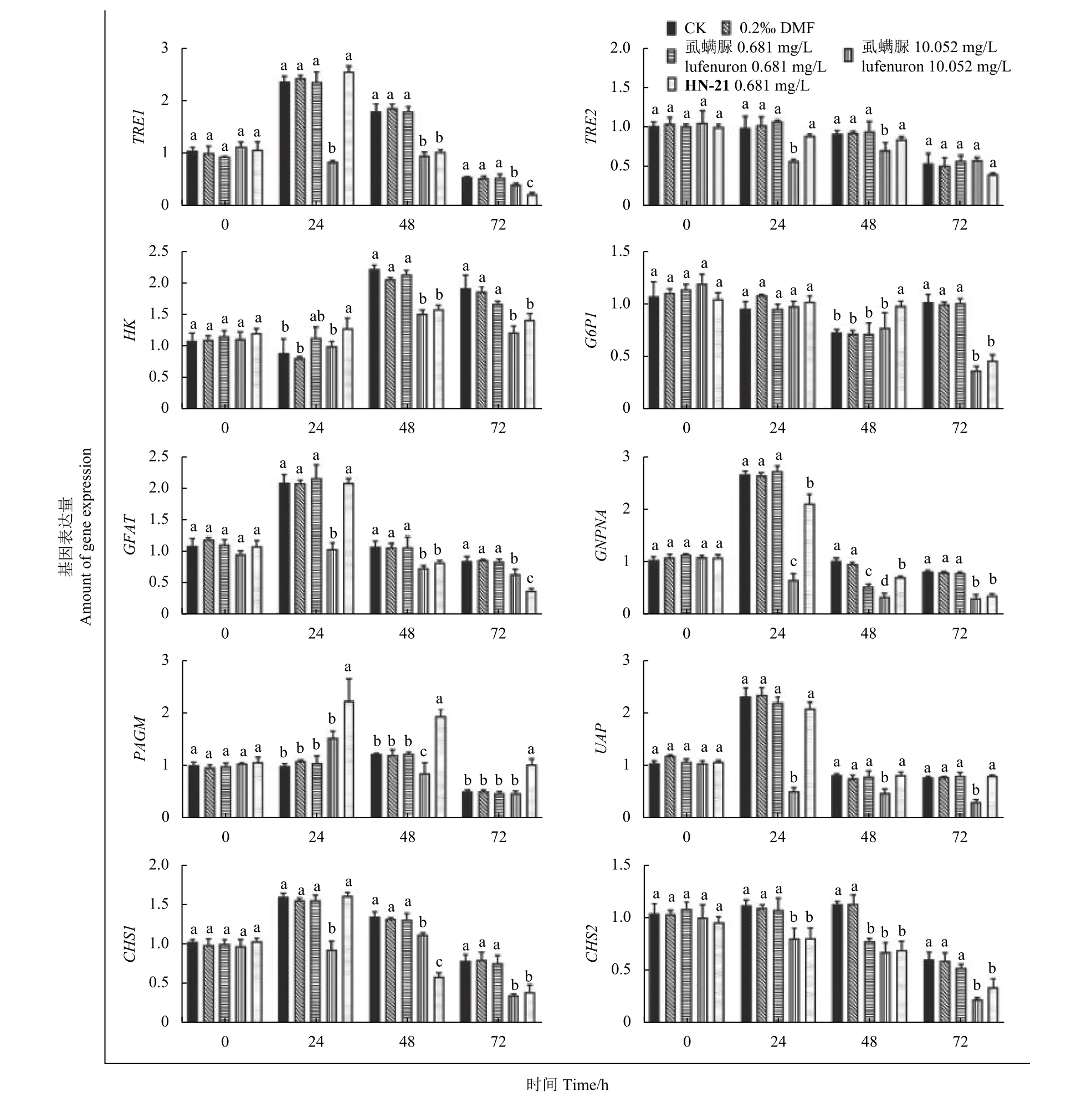
图5 各处理组草地贪夜蛾幼虫几丁质合成相关基因的表达量Fig.5 Gene expression of chitin synthesis-related genes in S.frugiperda larvae in each treatment group
3 讨论
3.1 HN-21 对草地贪夜蛾2 龄幼虫的杀虫活性
随着人们对环境安全性的重视,低毒高效的苯甲酰脲类杀虫剂脱颖而出,在近40 年来得到了较好的应用。目前为止,已得到专利报道的此类化合物有上千种,且有20 多个商品化学品种广泛应用于田间防治,如除虫脲、啶虫隆、氟铃脲及虱螨脲等[26-28],可用于防治鳞翅目、双翅目、鞘翅目类等多种农林业害虫[3,29-30]。研究表明,作为苯甲酰脲类第一大产品,虱螨脲在对甜菜夜蛾Spodoptera exigua、小菜蛾Plutella xylostella、草地贪夜蛾、苹浅褐卷蛾Epiphyas postvittana和梨小食心虫Grapholita molesta等鳞翅目害虫的杀虫活性尤为优越,在玉米、棉花、蔬菜、果树等作物上得到了较好的应用[2,31-34]。采用叶片药膜法测定虱螨脲对草地贪夜蛾幼虫的室内毒力,不同处理组的结果有一定的差异,如苏豪、吕胜兰等报道,其对草地贪夜蛾2 或3 龄幼虫24 h 的LC50值分别为4.66 mg/L 和0.062 mg/L[21,35],本研究结果显示,虱螨脲对草地贪夜蛾2 龄幼虫的72 h LC50值为10.052 mg/L,介于前两者与Chen 等测得的20.706 mg/L 之间[36],这可能与各地的草地贪夜蛾种群敏感性差异有关。在本研究中,通过以2,6-二氟取代模式以及经过生物电子等排和亚结构连接法[3]设计的含有肟醚结构的苯甲酰脲类化合物HN-21,不仅溶解能力相比较NK-17 有了显著的提升,其对草地贪夜蛾的LC50值也仅为0.681 mg/L,杀虫活性显著优于商品推荐用药虱螨脲。化合物HN-21含有的肟醚结构为亲脂基团,在其与作用靶标结合时可能具有双作用位点,从而使毒力增加[3]。受试昆虫表现出明显的昆虫生长调节剂中毒症状,无法正常完成蜕皮过程,最终死亡。
3.2 药剂处理对海藻糖及几丁质含量的影响
几丁质合成通路始于海藻糖酶 (TRE),终于几丁质合成酶 (CHS)。海藻糖代谢与几丁质代谢息息相关,直接影响着昆虫的生长发育过程。多种化学药剂会引起海藻糖含量与几丁质含量失调,进而产生高比例的昆虫个体死亡。如黄地老虎Agrotis segetum在经氯虫苯甲酰胺处理后,海藻糖含量减少[37],受井冈霉素处理后,斜纹夜蛾Spodoptera litura体内海藻糖含量显著上升,几丁质含量下降[19],均使昆虫无法完成正常的生长发育过程。
作为几丁质合成抑制剂,苯甲酰脲类化合物处理后,受试昆虫体内的几丁质含量通常会减少,进而抑制昆虫正常的表皮形成和生长发育,导致试虫蜕皮困难而死亡:氟苯脲的摄入可显著降低马铃薯甲虫Leptinotarsa decemlineata整体 (无中肠) 和表皮中的几丁质含量,且呈现浓度依赖效应[38];绿盲蝽Apolygus lucorum经氟铃脲处理12~72 h 后,几丁质含量下降,海藻糖含量增加[39],此现象在氟铃脲处理斜纹夜蛾幼虫96 h 也有发现[40]。在本研究中,在经HN-21 和高剂量虱螨脲处理后,幼虫体内几丁质含量从24 h 开始出现下降,且随着时间的延长,HN-21 对几丁质含量降低的影响更加显著,到72 h 时其对受试昆虫几丁质含量的影响程度甚至大于高剂量的虱螨脲。这可能与不同药剂在叶片的渗透或虫体的传递速率有关。药剂对几丁质含量的影响程度和受试昆虫的表型表现出一致:HN-21 和高剂量的虱螨脲均会导致受试昆虫在蜕皮时死亡,但表型出现时间有一定差异。高剂量虱螨脲处理的受试昆虫在24 h 时生长发育便受到抑制,HN-21 则在48 h 时使多数受试昆虫生长明显受到阻滞,到72 h 时两者已无明显差异。另外,在本研究中,HN-21 和高剂量虱螨脲处理后,受试昆虫体内的海藻糖含量未出现变化,可能与不同昆虫不同的响应机制有关,具体原因还有待进一步实验验证和分析。
3.3 药剂处理对几丁质合成通路相关基因表达量的影响
昆虫体内几丁质合成由8 个基因参与调控,始于海藻糖酶TRE,经过糖酵解途径的2 种酶、己糖胺通路的4 种酶,最后终止于几丁质合成酶CHS。其中某一过程代谢异常即会影响昆虫正常的生长发育。研究表明,TRE基因表达量下降会使豌豆蚜Acyrthosiphon pisum畸形[41];在棉蚜Aphis gossypiiGlover、赤拟谷盗Tribolium castaneum等多种昆虫中,RNA 干扰介导的CHS1基因使受试昆虫发育停滞而死亡[42-44]。同样,HK、G6PI、GFAT、GNPNA、PAGM和UAP等基因的异常表达[45-49]也会直接导致昆虫几丁质合成过程受阻,最终导致昆虫畸形,甚至死亡。
在本研究中,经HN-21 处理后,幼虫体内sfTRE1、sfHK、sfG6PI、sfGFAT、sfCHS1和sfCHS2等基因表达量均显著下调,使试虫无法正常完成几丁质合成过程。化合物H N-2 1 对sfUAP的表达没有显著影响,而sfPAGM表达量显著上调。这一现象在其他药剂的研究中也有报道,如受除虫脲处理的柑橘木虱Diaphorina citri体内,几丁质合成酶基因相对表达水平显著上调[50];经过井冈霉素处理24 h 后,柑橘木虱海藻糖酶基因显著上调[51];斜纹夜蛾在受到井冈霉素处理后,其体内多个几丁质合成相关基因表达量同样会显著上调[19]。这表明有可能存在一种反馈调节机制,受试昆虫几丁质含量的缺失刺激了部分相关基因被进一步激活,试图通过此过程来补偿几丁质含量不足。另外,HN-21 处理后的几丁质合成通路大多数基因的表达量变化时间 (48 h)同样是稍晚于高剂量虱螨脲处理组 (24 h),但在72 h 时两组已无明显差异,与生物学表型、几丁质含量的变化趋势一致。
4 结论与展望
新型苯甲酰脲类化合物HN-21 相较于NK-17溶解能力明显提升,且其对草地贪夜蛾的杀虫活性远高于推荐用药虱螨脲,LC50值约为虱螨脲LC50值的1/15;高剂量的虱螨脲对草地贪夜蛾幼虫生长发育产生影响的时间略早于HN-21,但两者最终在对草地贪夜蛾几丁质通路相关基因的表达量、几丁质含量等方面的下降影响程度上无明显差异。本研究为苯甲酰脲类对昆虫几丁质合成的具体调控过程提供理论依据,同时HN-21 高效的杀虫活性也为绿色杀虫剂研发提供了理论支撑。
