氯氟醚菌唑对西红花球茎腐烂病原菌尖孢镰刀菌的生物活性
2023-09-03邱谷丰任廷丹张传清
邱谷丰, 任廷丹, 王 强, 张传清
(1.浙江农林大学 现代农学院,杭州 311300;2.建德市三都西红花专业合作社,浙江 建德 311605)
西红花Crocus sativusL.是鸢尾科番红花属的一种多年生草本植物,是浙江省“新浙八味”之一[1],具有活血化瘀、凉血解毒、解郁安神、预防心血管疾病等效果[2]。西红花起源于伊朗、西班牙、希腊等地中海国家[3]。在中国,杭州建德是西红花种植栽培的发源地,被称为“西红花之乡”。西红花球茎腐烂病是由尖孢镰刀菌Fusarium oxysporum引起的真菌病害,也是西红花上最重要的病害[4]。在球茎储存期和种植期,病球率高达30%~70%,严重降低了西红花产量和花丝品质,造成巨大的经济损失[5]。目前尚未见有关药剂可以有效防治西红花球茎腐烂病的系统研究报道。
氯氟醚菌唑 (mefentrifluconazole) 是巴斯夫公司于2016 年上市的第1 个新型脱甲基抑制剂(demethylation inhibitors, DMIs)[6]。DMIs 的作用靶点为病原菌细胞膜甾醇生物合成过程中的C14-脱甲基酶[6],氯氟醚菌唑分子结构中的异丙醇基团,能够与该作用位点更加紧密地结合[7]。据报道,氯氟醚菌唑能有效防治多种真菌病害,如:香蕉叶斑病[8]、小麦锈病以及由壳针孢菌引起的病害、由柱隔孢菌引起的大麦病害、水稻纹枯病、稻瘟病、苹果黑星病、核果树和杏树花腐病以及褐腐病[9-10]、葡萄白粉病、马铃薯早疫病等[7]。另外,相比于传统的三唑类杀菌剂,氯氟醚菌唑对于生态环境的风险更低[11-12]。
目前有关氯氟醚菌唑防治镰刀菌病害的研究甚少。仅刘亚慧等报道,氯氟醚菌唑对不同镰刀菌菌丝生长、孢子萌发及细胞膜通透性表现出不同的生物活性[13],但对于西红花尖孢镰刀菌的生物活性尚不清楚。因此,本研究建立了西红花尖孢镰刀菌对氯氟醚菌唑的敏感性基线,并分析了氯氟醚菌唑对该病菌菌丝生长、孢子萌发及产孢量的影响;同时测定了氯氟醚菌唑对尖孢镰刀菌的细胞膜通透性的影响,评估了氯氟醚菌唑对西红花球茎的保护和治疗作用,以期为氯氟醚菌唑的科学使用及合理应用于西红花球茎腐烂病的防治提供依据。
1 材料与方法
1.1 供试材料
1.1.2 供试药剂 97%氯氟醚菌唑原药和400 g/L氯氟醚菌唑悬浮剂(mefentrifluconazole 400 g/L SC),由巴斯夫股份公司提供。原药用甲醇溶解,配制成 40 mg/mL 的母液,于4 ℃保存,备用。
1.1.3 供试培养基 马铃薯葡萄糖琼脂 (PDA) 培养基:称取去皮马铃薯200 g,煮沸后过滤,加入20 g 葡萄糖和20 g 琼脂,加水定容至1 L,121 ℃高压灭菌锅灭菌,备用。水琼脂培养基 (WA) 培养基:20 g 琼脂,无菌水定容至1 L。马铃薯葡萄糖 (PDB) 液体培养基:马铃薯200 g,20 g 葡萄糖,加水定容至1 L。
1.2 仪器设备
BJ-2CD 超净工作台,上海博讯实业有限公司;XT5107-IM250 霉菌培养箱,杭州雪中炭恒温技术有限公司;MLS-3781L-PC 高压蒸汽灭菌锅,松下健康医疗器械株式会社;Scope.A1 型光学显微镜,德国 Carl Zeiss 公司;ZWY-2102C 恒温培养振荡器,上海智城分析仪器制造有限公司;DDS-307A 电导率仪,上海仪电科学仪器股份有限公司。
1.3 试验方法
1.3.1 尖孢镰刀菌对氯氟醚菌唑的敏感性测定
采用菌丝生长速率法[16-18]测定。在灭菌的PDA培养基中加入氯氟醚菌唑药液,使其质量浓度分别为 0、0.125、0.25、0.5、1 和2 μg/mL[13]。将尖孢镰刀菌菌株在PDA 平板上预培养5 d 后,从菌落边缘制取直径为5 mm 的菌饼,转接至上述含不同质量浓度氯氟醚菌唑的PDA 平板中央。以不含药剂的PDA 板作为对照。每处理重复3 次。在25 ℃恒温培养箱黑暗培养6 d 后,采用十字交叉法测量各处理的菌落直径,按公式 (1) 计算各药剂处理对菌丝生长的抑制率 (Im)。
式中:DC为对照组菌丝生长直径,cm;DT为处理组菌丝生长直径,cm;D0为菌饼直径,cm。
利用SPSS 22.0 软件,通过药剂质量浓度的对数值 (x) 与抑制率的几率值 (y) 之间的线性回归关系,求出毒力回归方程、EC50值及相关系数r。
1.3.2 氯氟醚菌唑对尖孢镰刀菌菌丝生长及产孢量影响的评价 随机选取10 株尖孢镰刀菌分别在PDA 平板上进行黑暗培养。5 d 后从菌落边缘取直径为5 mm 的菌饼,转移至含0.125、0.5 和2 μg/mL氯氟醚菌唑的PDA 平板上[19],以不含药剂的PDA平板作为对照,每处理3 个重复。培养6 d 后,采用十字交叉法测量菌落直径,按公式 (1) 计算菌丝生长抑制率 (Im)。
参照宋化稳等[20]的方法制备孢子悬浮液。将供试菌株在PDA 平板上活化,5 d 后从菌落边缘打取直径为5 mm 的菌饼,放置在药剂质量浓度为0.125、0.5 和2 μg/mL 氯氟醚菌唑的PDA 平板上培养,以不含药剂的PDA 平板作为对照。培养6 d 后,加入5 mL ddH2O,用涂棒将菌丝表面的孢子刮下,用灭菌纱布过滤到三角锥形瓶中,加ddH2O 定容至10 mL,充分混匀用血球计数板采用五点取样法统计孢子数量,每处理重复3 次。按公式 (2)和 (3) 计算各药剂处理下的产孢量 (S)及产孢量抑制率 (Is)。
李小树凝视着远方,后来他收回视线平静地对我说:“我很严肃。哥们儿,昨晚我考虑了整整一夜,我决定——去寻找许春花。”
式中:n为80 个小方格中孢子个数;d为稀释倍数。
式中:Sc为对照组菌株的产孢量;Ss为处理组菌株的产孢量。
1.3.3 氯氟醚菌唑对尖孢镰刀菌孢子萌发影响的测定 随机选取2 株尖孢镰刀菌在PDA 平板上活化,5 d 后从菌落边缘打取直径为5 mm 的菌饼,分别置于药剂质量浓度为0.125、0.5 和2 μg/mL氯氟醚菌唑的PDA 平板上培养,以不含药剂的PDA 平板作为对照[21]。培养6 d 后,用无菌水分别洗下供试菌株的分生孢子,用灭菌纱布过滤,充分混匀,制得孢子悬浮液,用血球计数板计数观察,将孢子悬浮液浓度调至106个/mL。取100 μL孢子悬浮液均匀涂布于含0.125、0.5 和2 μg/mL氯氟醚菌唑的WA 培养基平板上,于25 ℃下黑暗培养。分别于2、4、6、8、10 h 镜检观察孢子萌发情况,每重复检查孢子总数不少于200 个,以芽管长度达到孢子短直径的1/2 视为萌发,记录孢子总数及孢子萌发数。每处理重复3 次,以不含药剂的WA 板为空白对照[20-21]。孢子萌发率(RG)按公式 (4) 计算。
式中:NG为孢子萌发数;NT为孢子总数。
1.3.4 氯氟醚菌唑对尖孢镰刀菌细胞膜通透性影响的测定 随机选取4 株尖孢镰刀菌在PDA 上黑暗培养5 d 后,在菌落边缘打取直径为5 mm 的菌饼,接种至灭菌的250 mL PDB 培养基中,每瓶接种5 个菌饼,摇培5 d (28 ℃、175 r/min) 后,经灭菌滤纸过滤冲洗,收集菌丝。称取1.0 g 洗净的菌丝,放入盛有40 mL 无菌水的离心管中,悬浮,用氯氟醚菌唑处理,设置质量浓度梯度为0.125、0.25、0.5、1、2 μg/mL,以滴加等体积的无菌水作为对照[20-21],每处理重复3 次。继续摇培0、2、4、6、8、16 h 后,收集菌液,在25 ℃、5000 r/min 下高速离心10 min,取上清液测定电导率。
1.3.5 氯氟醚菌唑对西红花球茎腐烂病的保护治疗作用评价 随机选取2 株尖孢镰刀菌,用1.3.3 节方法制备,获得各菌株浓度为106个/mL的孢子悬浮液,备用。400 g/L 氯氟醚菌唑悬浮剂用无菌水配制成有效成分质量浓度梯度为0.125、0.5、2 μg/mL,备用。挑选健康的西红花球茎,去皮后用无菌水洗净后,晾干,分有伤和无伤处理。
治疗作用测定:在西红花球茎左右两侧均滴加20 μL 孢子悬浮液,以滴加等体积的无菌水作为对照,置于25 ℃ 12 h 光暗交替的光照培养箱中保湿 (相对湿度80%)培养,24 h 后每个球茎表面分别喷洒0、0.125、0.5、2 μg/mL 的氯氟醚菌唑200 μL[22]。
保护作用测定:在每个西红花球茎表面分别喷洒0、0.125、0.5、2 μg/mL 的氯氟醚菌唑200 μL,置于25 ℃光暗12 h 交替的光照培养箱中保湿培养,24 h 后每个球茎表面均滴加20 μL孢子悬浮液,以滴加等体积的无菌水作为对照[23]。
每处理3 个重复。7 d 后根据分级标准[24]调查发病情况:0 级,无病斑;1 级,病斑面积占整个球茎面积的5%以下;3 级,病斑面积占整个球茎面积的5%~20%;5 级,病斑面积占整个球茎面积的21%~50%;7 级,病斑面积占整个球茎面积的50%以上。按公式 (5)和(6) 计算各处理病情指数(ID) 及防治效果 (E)。
式中:NL为各级病球茎数;L为相对级数值;N为调查总球茎数;LMax最高病级。
式中:IDc为对照组病情指数;IDt为处理组病情指数。
2 结果与分析
2.1 尖孢镰刀菌对氯氟醚菌唑的敏感性
测定结果 (图1) 显示,氯氟醚菌唑对供试的82 株尖孢镰刀菌的EC50值分布在0.182~2.491 μg/mL之间,平均EC50值为 (0.838 ± 0.438) μg/mL,敏感系数Rf(最高EC50值/最低EC50值) 为13.69。对EC50值进行正态性分布Kolmogorov-Smirnov 检验,显著性P= 0.19 > 0.05,表明82 株供试菌株对氯氟醚菌唑的敏感性分布符合正态分布。同时,供试菌株对氯氟醚菌唑的敏感性频率分布呈现出一条连续的曲线。
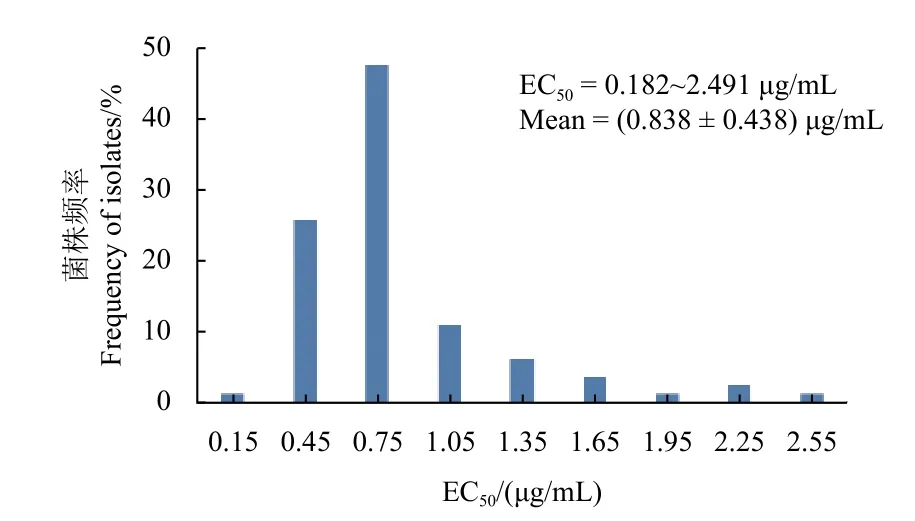
图1 尖孢镰刀菌对氯氟醚菌唑的敏感性分布Fig.1 Distribution of sensitivity of F.oxysporum to mefentrifluconazole
2.2 氯氟醚菌唑对西红花尖孢镰刀菌菌丝生长及产孢量的影响
结果 (表1) 表明,氯氟醚菌唑对所测定菌株的菌丝生长有明显的抑制作用。0.125 μg/mL 氯氟醚菌唑对菌丝生长的抑制率较低,随着药剂质量浓度的增加,抑制率逐渐增强。对于产孢量,菌株XHH14 在0.125 μg/mL 下的抑制率仅为1.58%,2 μg/mL 时抑制率也仅为13.45%。对于其他菌株产孢量的抑制率也较低。表明氯氟醚菌唑对尖孢镰刀菌的菌丝生长的抑制作用较强。
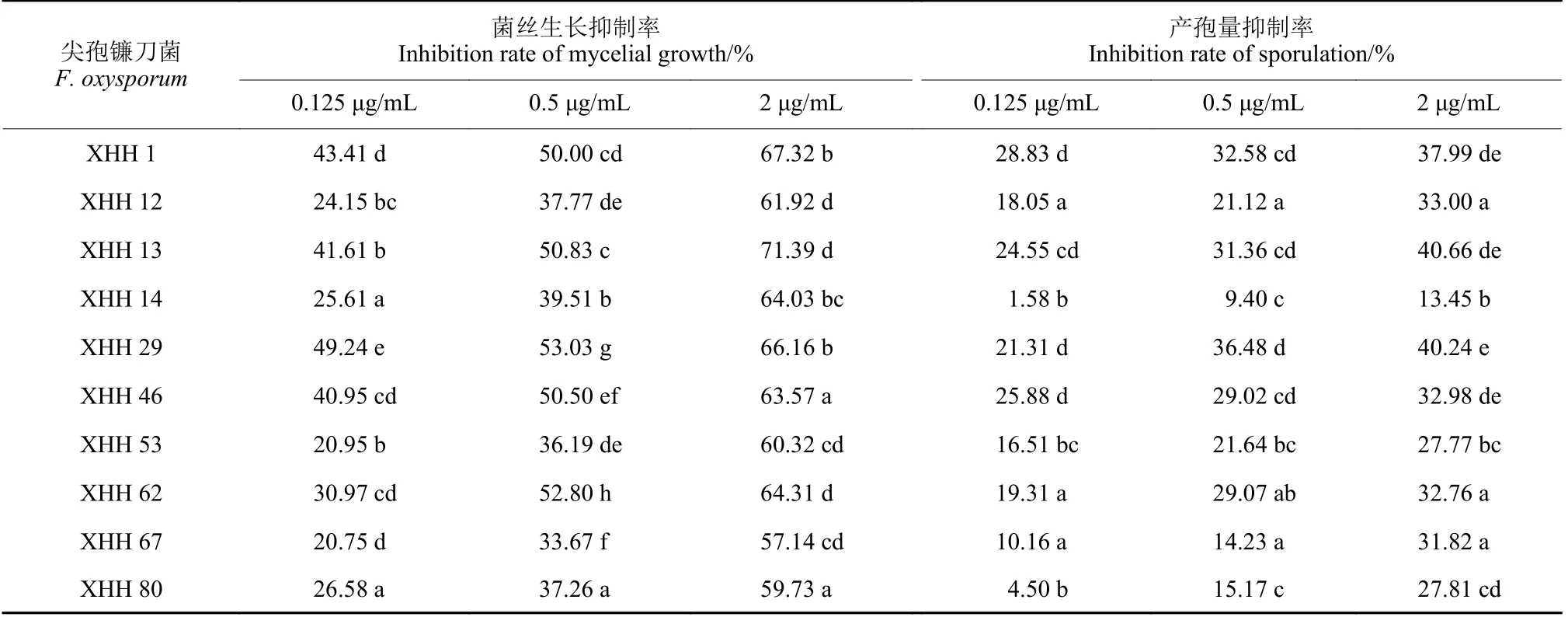
表1 氯氟醚菌唑对尖孢镰刀菌的菌丝生长及产孢量的抑制作用Table 1 The inhibiting effect of mefentrifluconazole on mycelial growth and sporulation quantity of F.oxysporum
2.3 氯氟醚菌唑对西红花尖孢镰刀菌的孢子萌发的影响
测定结果 (图2) 表明:2 h 时,各处理组的菌株孢子基本上均未萌发,与CK 处理相比,孢子萌发率被显著抑制;随着时间的推移,各处理组的孢子逐渐萌发,且渐与CK 无显著性差异;到10 h 时各浓度处理的孢子萌发率均达80%以上,无显著性差异。当CK 组孢子萌发率达95%时,0.5 μg/mL 氯氟醚菌唑处理组的孢子萌发率达93.03%,2 μg/mL 处理组的也达85.16%。结果表明,氯氟醚菌唑会推迟尖孢镰刀菌孢子萌发的时间。
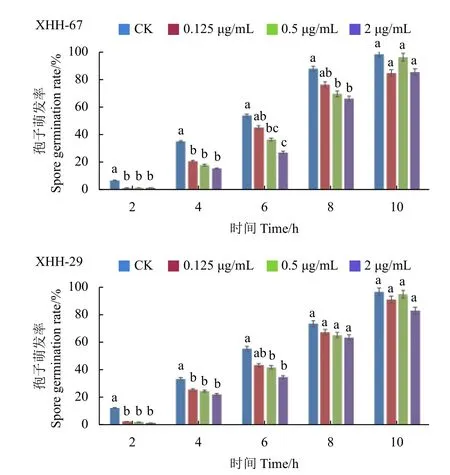
图2 氯氟醚菌唑对尖孢镰刀菌不同菌株孢子萌发率的影响Fig.2 The effect of mefentrifluconazole on the germination rate of different F.oxysporum conidia
2.4 氯氟醚菌唑对西红花尖孢镰刀菌细胞膜通透性的影响
氯氟醚菌唑对供试菌株各培养液的电导率测定结果如图3 所示:0 h 时,CK 组与各处理组的电导率基本一致,随着时间的延长,CK 组与各处理组培养液的电导率均表现出上升趋势,且各处理组的电导率上升速率显著高于CK 组。16 h 时各处理组电导率达到了最高值。此外,菌丝培养液的电导率会随着药剂处理浓度的升高而显著增加。说明氯氟醚菌唑对尖孢镰刀菌细胞膜具有显著的破坏作用,能够引起镰刀菌电解质的渗漏,从而导致菌丝培养液电导率的显著增加。
2.5 氯氟醚菌唑对西红花球茎腐烂病的保护治疗作用
结果如表2 所示:在保护作用试验中,施药24 h 后接种孢子液,氯氟醚菌唑对西红花球茎腐烂病有较好的保护作用,且随着氯氟醚菌唑质量浓度的升高,防治效果增加,2 μg/mL 氯氟醚菌唑处理的保护作用防治效果达83.87%。在治疗作用试验中,接种病菌后24 h 施药,氯氟醚菌唑对西红花球茎腐烂病的防治效果较差,0.125 μg/mL 氯氟醚菌唑的防治效果仅为18.18%~19.35%,2 μg/mL时治疗效果最高,达到51.61%。表明氯氟醚菌唑对西红花球茎腐烂病的保护作用防治效果优于治疗作用(图4)。
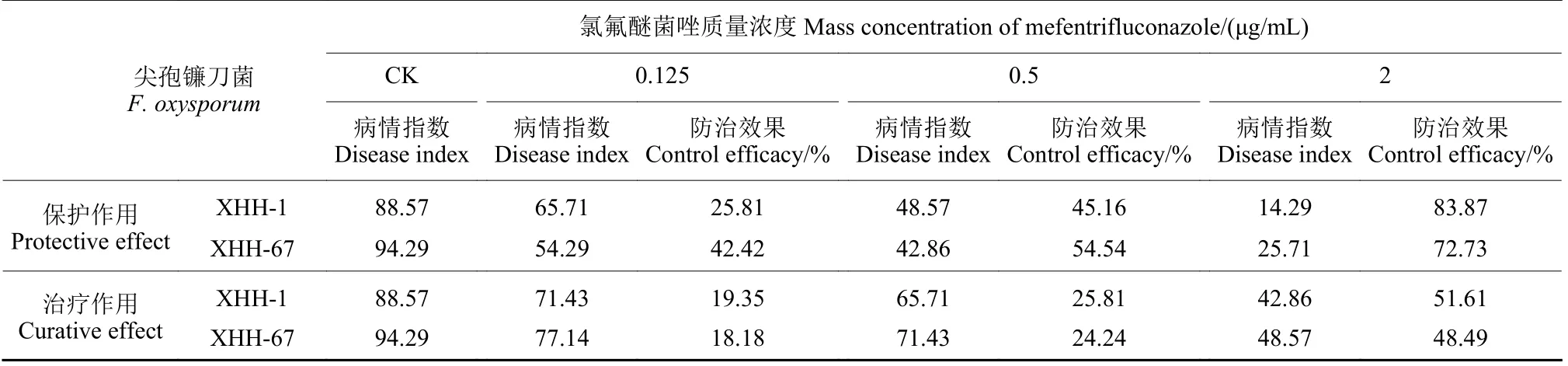
表2 氯氟醚菌唑对西红花球茎腐烂病的保护作用及治疗作用防治效果Table 2 The control efficacy of protective and curative effect of mefentrifluconazole on saffron corm rot
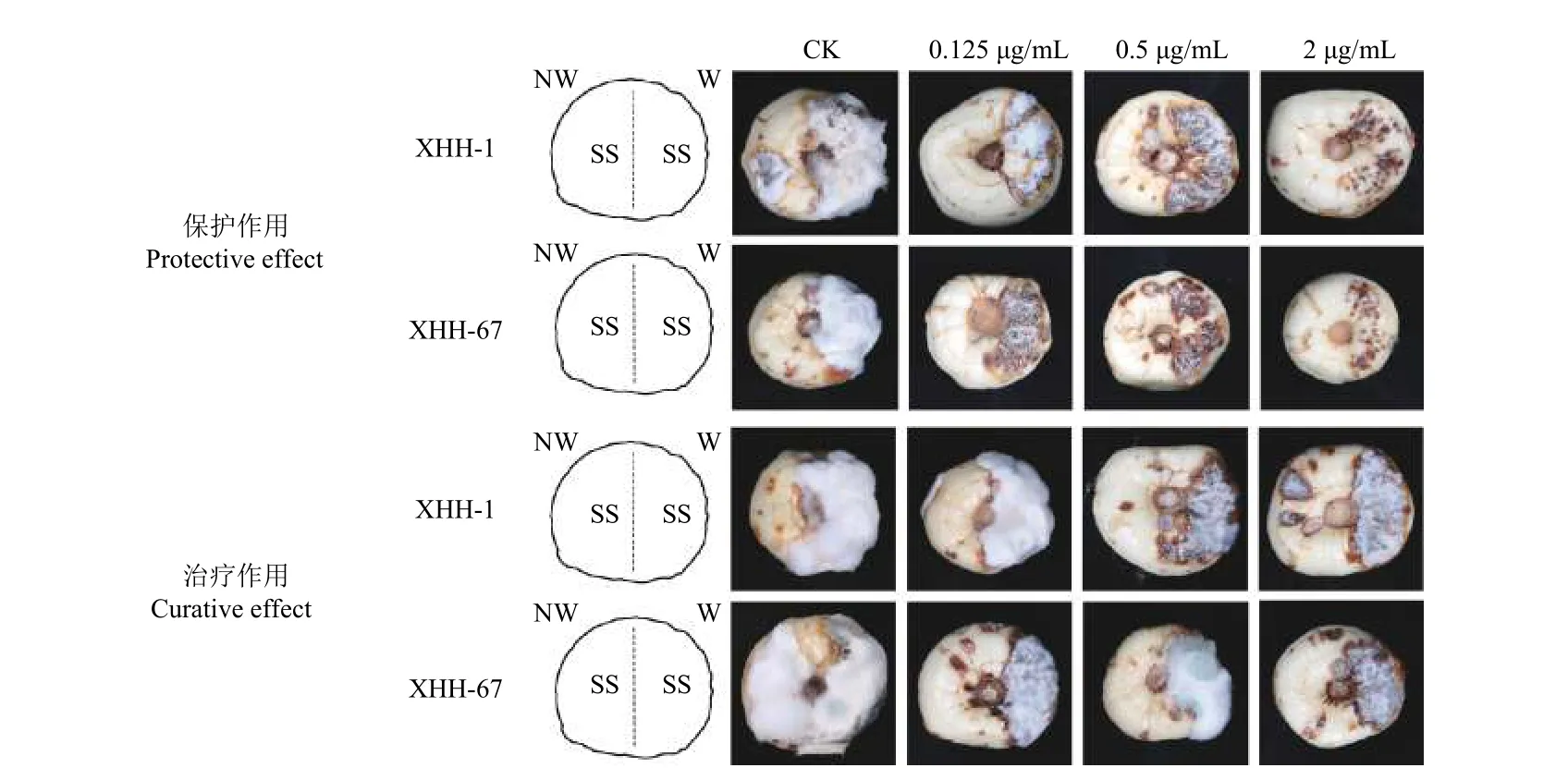
图4 氯氟醚菌唑对西红花球茎腐烂病的保护治疗作用Fig.4 Protective and curative effect of mefentrifluconazole on saffron corm rot
3 结论与讨论
球茎腐烂病是西红花种植栽培过程中发生较为严重的病害,但有关其防治方法的研究报道很少[24],所用的农药品种也比较单一,基本以多菌灵、甲基硫菌灵、百菌清为主,但田间防治效果一般[25]。有研究表明,克菌丹、福美双等老杀菌剂对西红花球茎腐烂病菌菌丝生长和孢子萌发均有一定的抑制作用[26-27]。本文探究了新型DMIs 杀菌剂氯氟醚菌唑对西红花球茎腐烂病菌的抑菌活性及作用方式,同时评估了其对西红花球茎腐烂病的保护和治疗效果。
氯氟醚菌唑目前已经在马铃薯、黄瓜、苹果、番茄等少数几种作物上用于早疫病、白粉病、炭疽病等病害的防治,但尚未登记用于中药材植物病害的防治。本研究测定了82 株西红花球茎腐烂病菌对氯氟醚菌唑的敏感性,发现氯氟醚菌唑的EC50值分布在0.182~2.491 μg/mL 之间,平均EC50值为 (0.838 ± 0.438) μg/mL,敏感性频率分布曲线符合正态分布。同时,氯氟醚菌唑可以有效抑制病原菌F.oxysporum的菌丝生长,且对菌丝生长的抑制作用优于对产孢量的抑制。Li 等[21]研究表明,氯氟醚菌唑对灰葡萄孢菌Botrytis cinerea的平均EC50值为 (0.124 ± 0.025) μg/mL,对分生孢子芽管伸长的平均EC50值为 (0.015 ±0.008) μg/mL。崔一平等[28]研究发现,氯氟醚菌唑对香蕉叶斑病、人参黑斑病等也具有良好的防治效果。表明氯氟醚菌唑具有广谱的杀菌活性。
本研究发现,虽然氯氟醚菌唑不能抑制尖孢镰刀菌的孢子萌发,但是会延迟孢子萌发的时间。另外,氯氟醚菌唑能够通过破坏病原真菌的细胞膜,引起细胞电解质的流失,从而导致细胞死亡。Li 等[21]发现,氯氟醚菌唑并不抑制B.cinerea分生孢子萌发,但能抑制芽管伸长,同时,氯氟醚菌唑能够降低细胞中麦角甾醇含量并引起细胞膜通透性的改变。这一点在本研究中得到了证实,说明氯氟醚菌唑对不同植物病原真菌的作用方式具有一致性,即通过抑制14α-脱甲基酶活性,破坏病原菌细胞膜的形成,达到抑制病原菌芽管伸长与菌丝生长的作用,从而发挥其防治植物病害的作用。
通过在西红花球茎上进行保护与治疗作用的分析,发现提前24 h 喷施氯氟醚菌唑能够更好地抑制F.oxysporum所引起的球茎腐烂病的发生。相同浓度下,氯氟醚菌唑对灰霉病、炭疽病和恶苗病等的保护作用同样优于治疗作用[7,13,21],本研究结果与其相一致。同时Gao 等[7]通过田间试验发现,氯氟醚菌唑对辣椒炭疽病也有较好的保护作用。以上试验表明,氯氟醚菌唑对F.oxysporum引起的西红花球茎腐烂病的保护活性显著优于治疗活性,因此在氯氟醚菌唑的使用过程中,应注意使用时机的把握,使其发挥出最优的防治效果。
研究表明,西红花球茎腐烂病化学防治最关键的是防治适期,田间种植期处理效果不佳,种植前处理种球是关键[29]。综上所述,氯氟醚菌唑对西红花球茎腐烂病的发生具有较好的活性,氯氟醚菌唑对于由镰刀菌引起的西红花球茎腐烂具有良好的应用前景,但后续还需要进一步开展田间防治试验进一步确认防病效果及对西红花球茎萌发、生长的安全性等。
