滇龙胆花化学成分的分离与鉴定
2023-07-10朱卫萍潘韬文饶高雄
朱卫萍 潘韬文 饶高雄
【摘 要】 目的:对滇龙胆花的化学成分进行了初步研究,明确滇龙胆花的化学成分并加以充分利用,为最大限度地提高滇龙胆种植产业效益提供科学依据。方法:采用硅胶、葡聚糖凝胶LH-20等色谱法分离化合物,并通过与标准品TLC对照、核磁共振、 质谱数据鉴定化合物的结构。结果:从滇龙胆花体积分数为95%的乙醇溶液提取物中分离鉴定了12个化合物,主要为小极性的三萜脂肪酸酯酸,含量最大的是乌苏烷型三萜。分别鉴定为软脂酸([STHZ]1)、古柯二醇-3-棕榈酸酯([STHZ]2[STBZ])、羽扇豆醇棕榈酸酯([STHZ]3[STBZ])、α-香树脂醇([STHZ]4[STBZ])、熊果醇-3-棕榈酸酯([STHZ]5[STBZ])、β-谷甾醇([STHZ]6[STBZ])、熊果酸([STHZ]7[STBZ])、胡萝卜苷([STHZ]8[STBZ])、2α-羟基-熊果酸([STHZ]9[STBZ])、β-香树脂醇棕榈酸酯([STHZ]10[STBZ])、α-香树脂醇棕榈酸酯([STHZ]11[STBZ])、β-香树脂醇([STHZ]12[STBZ])。结论:对滇龙胆花化学成分进行研究,分离鉴定了12个单体化合物,化合物[STHZ]1~6、8~12[STBZ]均为首次从龙胆花中分离得到。
【关键词】滇龙胆花;化学成分;结构鉴定
【中图分类号】R284.2 【文献标志码】 A【文章编号】1007-8517(2023)11-0035-05
Abstract:Objective This researchstuied the chemical constituents of the flowers of cultivated Gentiana rigescens Franch.,in order to identify the chemical compositions of Gentiana rigescens Franch.and use it,to improve the value.Methods the compounds were isolated by chromatography such as Silica gel,Dextran gel LH-20,and identified the structure by the physicochem-ical property and spectral data.Results 12 compounds were isolated from the alcoholic extracts of the flowers of cultivated Gentiana rigescens Franch..They were identified as:palmitic acid ([STHZ]1[STBZ]),Erythrodiol-3-palmitate ([STHZ]2[STBZ]),Lupeol palmitate ([STHZ]3[STBZ]),α-Amyrin ([STHZ]4[STBZ]),Uvaol-3-palmitate ([STHZ]5[STBZ]),β-Sitosterol ([STHZ]6[STBZ]),Ursolic acid ([STHZ]7[STBZ]),Daucosterol ([STHZ]8d),2α-hydroxyl- ursolic acid ([STHZ]9[STBZ]),β-Amyrin palmitate ([STHZ]10[STBZ]),α-Amyrin palmitate ([STHZ]11[STBZ]) and β-Amyrin ([STHZ]12[STBZ]).Conclusion The compounds of [STHZ]1-6、8-12[STBZ] were isolated from the flowers of Gentiana for the first time.
Keywords:The Flowers of Cultivated Gentiana rigescens Franch.;Chemical Constituents;StructuralIdentification
龍胆花为藏医常用药材,龙胆花收载于《中国藏药》[1],主要来源于蓝玉簪龙胆Gentiana veitchiorum Hemsl.和高山龙胆Gentiana algida Pall.,的干燥花。其性寒、味苦,具有清热解毒、利胆之功,藏医常用于治疗肺热、时疫热病、咽喉肿痛等[2]。滇龙胆花来源于Gentiana rigescens Franch.的干燥花,虽非藏药所用龙胆花的正品来源但可作为替代品使用。目前,藏药龙胆花资源相对稀少,而栽培滇龙胆花资源相对较为丰富。对于龙胆花的化学成分极少,迄今为止,仅有徐传梅等[3]从藏药提宗龙胆花中分离得到熊果酸(ursolic acid),日本獐牙菜素(isooreintin)、异荭草素(swertiajaponin)3个成分。为明确滇龙胆花的化学成分及其药效物质基础并加以充分利用,最大限度地提高种植产业效益,开发龙胆花药用价值。本实验对栽培滇龙胆花进行提取,并运用各种色谱法进行分离,辅以重结晶等常规方法纯化处理,对得到单体化合物进行结构分析,从滇龙胆花得到12个单体化合物,均为首次从龙胆花中分离得到。
1 仪器与材料
Yanaco显微熔点仪、岛津IR P-21型红外光谱仪、Finnigan MAT-95质谱仪测定、NMR用Bruker AM-400或DRX-500核磁共振波谱仪。正相柱色谱用硅胶(75~150μm)、薄层色谱硅胶GF254板(青岛海洋化工厂);树脂MCI Gel CHP-20P(日本三棱化工);葡聚糖凝胶LH-20(Pharmacia公司);AB-8型大孔树脂为(南开大学产品)。提取分离所用甲醇,乙醇,乙酸乙酯,环己烷,氯仿,丙酮等化学试剂,溶剂为普通工业级或化学纯级溶剂;
实验所用滇龙胆花样品产于云南省临沧市云县,经原云南中医药大学杨树德教授鉴定为Gentiana rigescens Franch.的干燥花,标本保存于云南中医药大学。
2 提取与分离
栽培滇龙胆花1.55 kg用10倍量95%乙醇加热回流提取2次,每次1 h,减压回收乙醇后得龙胆花乙醇浸膏266.5 g。浸膏混悬于水中依次用乙酸乙酯和正丁醇萃取,萃取液分别减压回收溶剂得到乙酸乙酯部分103 g(Fr-A)、正丁醇部分60.8 g(Fr- B)。
取Fr-A(103 g)经硅胶柱层析,以三氯甲烷-甲醇(体积比为99∶1→1∶1)进行梯度洗脱,葡聚糖凝LH-20(三氯甲烷-甲醇=1∶1)纯化,经薄层色谱分析,合并相同部分,再辅以重结晶,最后从该部分分离得到9个化合物:化合物[STHZ]1[STBZ](573 mg)、化合物[STHZ]2[STBZ](253 mg)、化合物[STHZ]3[STBZ](403 mg)、化合物[STHZ]4[STBZ](352 mg)、化合物[STHZ]5[STBZ](80 mg)、化合物[STHZ]6[STBZ](1017 mg)、化合物[STHZ]10[STBZ](153 mg)、化合物[STHZ]11[STBZ](15 mg)、化合物[STHZ]12[STBZ](20 mg)。
取Fr-B(60.8g)经硅胶柱层析,以三氯甲烷-甲醇(体积比为6∶1→1∶2)梯度洗脱,在经葡聚糖凝LH-20(甲醇),RP-18柱色谱(水-甲醇)等柱色谱多次分离纯化,辅以重结晶等常规方法,最后从该部分得到3个化合物:化合物[STHZ]7[STBZ](4.4 g)、化合物[STHZ]8[STBZ](400 mg)、化合物[STHZ]9[STBZ](432 mg)。
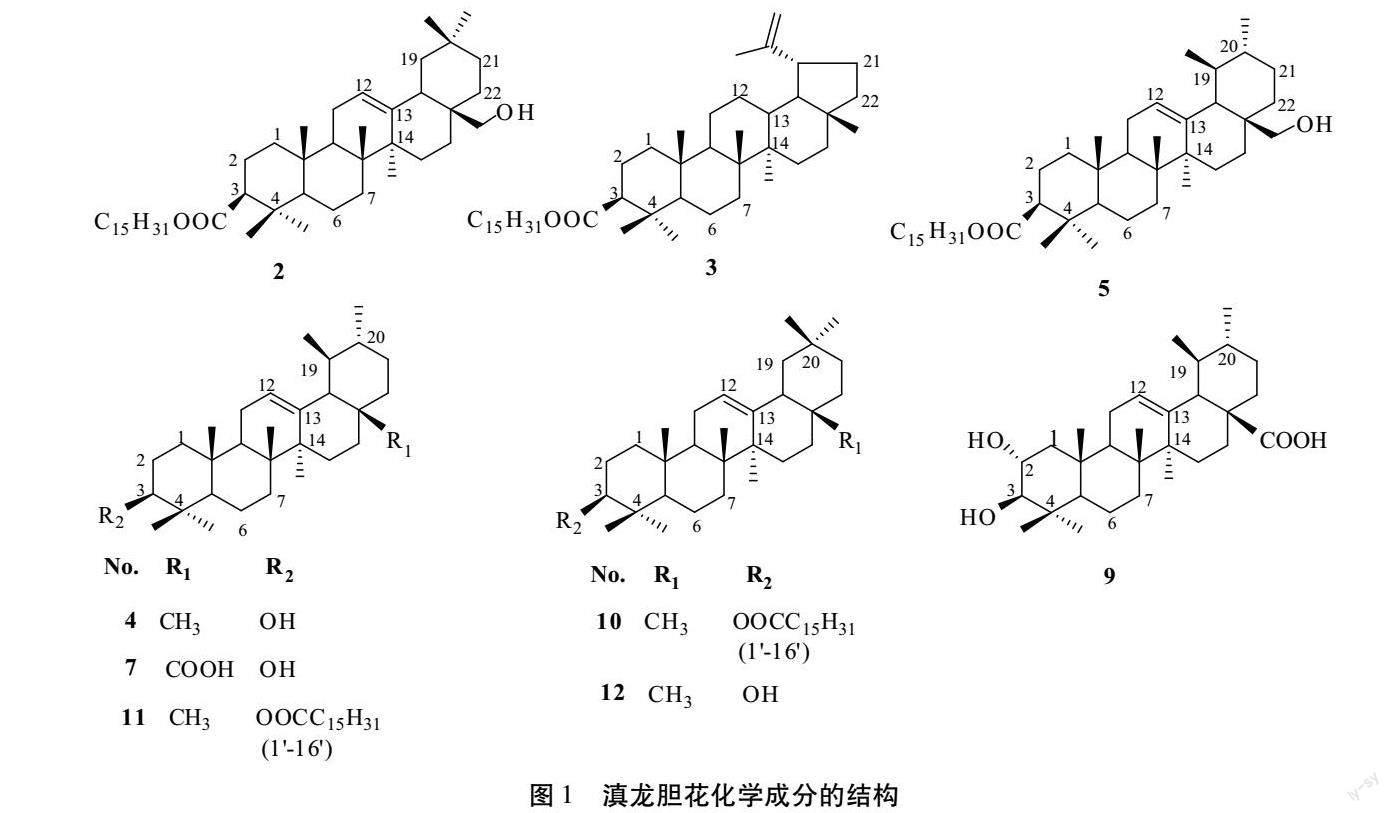
各化合物架构如图1所示。
3 结构鉴定
化合物[STHZ]1[STBZ]:白色粉末(乙酸乙酯)。10%硫酸乙醇不显色、有油性斑点,mp.54.2~55.4 ℃。IR(KBr)显示有长链烷烃(2927 cm-1、2918 cm-1、2849 cm-1)。与软脂酸(Palmitic acid)标准品对照,TLC的Rf值和显色一致,由此確定为软脂酸(Palmitic acid)。
化合物[STHZ]2[STBZ]:白色粉末(甲醇)。10%硫酸乙醇显紫色,mp.92.4~93.5 ℃。IR(KBr) cm-1:2924、2854、1735、1457、1378。与古柯二醇-3-棕榈酸酯(Erythrodiol-3-palmitate)标准品对照,TLC的Rf值和显色一致,故确定为古柯二醇-3-棕榈酸酯(Erythrodiol-3-palmitate)。
化合物[STHZ]3[STBZ]:白色脂状固体(丙酮)。10%硫酸乙醇显紫色,mp.56~57 ℃。IR(KBr) cm-1:3478、2924、2852、1732、1705、1465,显示有羟基(3478cm-1),饱和烃基(2924、2852cm-1)、羰基(1732cm-1)。1H NMR(400 MHz,CDCl3)δ H:4.99(1H,br.s,H-29a)、4.70(1H,br.s,H-29b)、3.19(1H,dd,J=11.2,5.0Hz,H-3a)、0.77~0.97(各3H,s,H-23、24、25、26、27、28);13C NMR(100 MHz,CDCl3)δ C:37.9(t,C-1)、25.7(t,C-2)、80.0(d,C-3)、37.0(s,C-4)、55.6(d,C-5)、18.0(t,C-6)、34.2(t,C-7)、40.2(s,C-8)、50.3(d,C-9)、36.9(s,C-10)、20.9(t,C-11)、24.9(t,C-12)、37.8(d,C-13)、42.5(s,C-14)、26.7(t,C-15)、35.6(t,C-16)、42.5(s,C-17)、26.9(d,C-18)、47.7(d,C-19)、150.7(s,C-20)、29.7(t,C-21)、39.9(t,C-22)、27.5(q,C-23)、15.0(q,C-24)、15.8(q,C-25)、15.96(q,C-26)、14.2(q,C-27)、17.4(q,C-28)、109.4(d,C-29)、18.9(q,C-30)、173.4(s,C-1′)、33.6(t,C-2′)、25.4(t,C-3′)、29.6~28.7(t,C-4′~14′)、22.7(t,C-15′)、14.4(t,C-16′)。上述1H NMR、13C NMR谱数据与文献[4]对照,鉴定为羽扇豆醇棕榈酸酯(Lupeol palmitate)。
化合物[STHZ]4[STBZ]:白色,薄片状(甲醇)。10%硫酸乙醇显紫色,mp.135.8~136.7 ℃。IR(KBr) cm-1:3400、2946、2920、2854、1471、1387,显示羟基(3400cm-1)、双键(1639 cm-1、1463 cm-1)等官能团。1H NMR(400 MHz,CDCl3)δ:5.16(1H,t,J=3.6Hz,H-12)、3.24(1H,dd,J=5.2、11.0 Hz,H-3),1.06、1.02、1.01、1.00、0.95、0.81、0.80、0.79(s,8×CH3);13C NMR(100MHz,CDCl3)δ C:39.7(t,C-1)、28.0(t,C-2)、79.9(d,C-3)、39.3(s,C-4)、55.7(d,C-5)、19.1(t,C-6)、33.5(t,C-7)、40.6(s,C- 8)、48.6(d,C-9)、37.9(s,C-10)、24.0(t,C-11)、123.4(d,C-12)、139.5(s,C-13)、42.8(s,C-14)、29.7(t,C-15)、27.6(t,C-16)、34.7(s,C-17)、59.7(d,C-18)、40.5(d,C-19)、40.6(d,C-20)、32.2(t,C-21)、42.6(t,C-22)、29.0(q,C-23)、16.6(q,C-24)、16.6(q,C-25)、17.0(q,C-26)、24.2(q,C-27)、29.0(q,C-28)、 18.3(q,C-29)、22.5(q,C-30)。上述1H NMR、13C NMR谱数据与文献[5]对照,鉴定该化合物确定为α-香树脂醇(α-Amyrin)。
化合物[STHZ]5[STBZ]:白色脂状固体(甲醇)。10%硫酸乙醇显紫色,mp.137~140 ℃。IR(KBr) cm-1:3444、2924、2852、1719、1462、1377。与熊果醇-3-棕榈酸酯(Uvaol-3-palmitate)标准品对照,TLC的Rf值和显色一致,由此确定为熊果醇-3-棕榈酸酯(Uvaol-3-palmitate)。
化合物[STHZ]6[STBZ]:白色针晶(乙酸乙酯)。与β-谷甾醇标准品对照[6]在不同系统中展开,Rf值和显色现象相同,故鉴定为β-谷甾醇(β-Sitosterol)。
化合物[STHZ]7[STBZ]:白色粉末(甲醇)。10%硫酸乙醇显紫色,mp.215.5~217.8 ℃。IR(KBr) cm-1:3440、2926、2857、1693、1458、1388、1274,显示有羟基(3440cm-1)、羰基(1693cm-1)等官能团。1H NMR(400 MHz,CDCl3)δ H:5.24(1H,t,J=3.4Hz,H-12)、3.33(1H,dd,J=14.3Hz,7.2Hz,H-3)、2.69(1H,d,J=9.5Hz,H-19)、1.53(3H,H-27)、1.28(3H,H-23)、1.11(3H,H-25)、0.99(3H,H-30)、0.96(3H,H-24)、0.84(3H,H-29)、0.78(3H,H-26); 13C NMR(100 MHz,CDCl3)δ C:181.8(s,C-28)、139.6(s,C-13)、126.9(d,C-12)、78.8(d,C-3)、56.7(d,C-5)、54.3(d,C-18)、48.1(s,C-17)、47.8(d,C-9)、40.8(s,C-14)、40.1(s,C-8)、34.4(s,C-10)、39.9(d,C-19)、38.7(d,C-20)、38.2(t,C-22)、30.9(s,C-4)、31.9(t,C-7)、30.7(t,C-1)、30.5(t,C-21)、30.9(t,C-15)、29.0(t,C-2)、27.9(q,C-23)、26.6(t,C-16)、24.5(t,C-11)、24.4(q,C-27)、21.9(q,C-30)、19.6(t,C-6)、18.0(q,C-29)、17.9(q,C-26)、26.3(q,C-24)、16.6(q,C-25)。上述1H NMR、13C NMR谱数据和文献报道[7]对照,鉴定为熊果酸(Ursolic acid)。
化合物[STHZ]8[STBZ]:白色粉末(甲醇)。mp.254~256 ℃。IR(KBr):3530~3260 cm-1、2940 cm-1、2866 cm-1、1644 cm-1、1463 cm-1、1378 cm-1、1106~1050 cm-1、806 cm-1。与胡萝卜苷对照品[6]在不同系统中展开,Rf值和显色现象相同,故鉴定为胡萝卜苷(Daucosterol)。
化合物[STHZ]9[STBZ]:白色粉末(甲醇)。10%硫酸乙醇显蓝色;mp.235.7~237.9 ℃;IR(KBr) cm-1:3451、2926、2856、1700、1456、1387、1050,显示有羟基(3450cm-1)、羰基(1700cm-1);1H NMR(400 MHz,CDCl3)δ H:5.24(1H,t,J=3.4Hz,H-12)、3.34(1H,dd,J=14.3Hz,7.2Hz,H-3)、2.97(1H,d,J=9.6Hz,H-19)、1.53(3H,H-27)、1.34(3H,H-23)、1.11(3H,H-25)、1.05(3H,H-30)、0.98(3H,H-24)、0.89(3H,H-29)、0.83(3H,H-26);13C NMR(100MHz,CDCl3)δ C:181.6(s,C-28)、139.6(s,C-13)、124.7(d,C-12)、84.5(d,C-3)、58.7(d,C-5)、54.3(d,C-18)、48.6(s,C-17)、48.7(d,C-9)、43.4(s,C-14)、39.3(s,C-8)、40.4(s,C-10)、40.7(d,C-19)、40.9(d,C-20)、38.2(t,C-22)、40.7(s,C-4)、34.3(t,C-7)、48.3(t,C-1)、31.9(t,C-21)、29.3(t,C-15)、69.9(d,C-2)、31.9(q,C-23)、24.5(t,C-16)、25.4(t,C-11)、29.9(q,C-27)、21.9(q,C-30)、19.6(t,C-6)、17.5(q,C-29)、17.8(q,C-26)、17.9(q,C-24)、18.0(q,C-25)。上述1H NMR、13C NMR谱数据与文献[8]报道对照,鉴定为2α-羟基-熊果酸(2α-hydroxyl- ursolic acid)。
化合物[STHZ]10[STBZ]:白色脂状固体(乙酸乙酯)。10%硫酸乙醇显紫色;mp.56~57 ℃;IR(KBr) cm-1:2927、2854、1731、1455,显示有羰基(1731cm-1);1H NMR(500 MHz,CDCl3)δ H:5.17(1H,t,J=3.5Hz,H-12)、4.55(1H,dd,J=9.0、6.0Hz,H-3α)、1.02、1.01、0.98、0.93、0.91、0.85、0.83(各3H,s,H-30、29、27、26、25、24、23),2.30(2H,t,J=7.2Hz,H-2′)、0.85(3H,t,J=7.0Hz,H-30′);13C NMR(125 MHz,CDCl3)δ C:38.6(t,C-1)、23.9(t,C-2)、80.6(d,C-3)、36.8(s,C-4)、55.7(d,C-5)、18.6(t,C-6)、32.5(t,C-7)、40.0(s,C-8)、47.8(d,C-9)、36.9(s,C-10)、23.5(t,C-11)、121.6(d,C-12)、145.5(s,C-13)、41.9(s,C-14)、26.0(t,C-15)、27.0(t,C-16)、32.9(s,C-17)、47.8(d,C-18)、47.0(t,C-19)、31.0(s,C-20)、34.9(t,C-21)、37.0(t,C-22)、28.0(q,C-23)、16.9(q,C-24)、15.6(q,C-25)、16.8(q,C-26)、26.1(q,C-27)、28.5(q,C-28)、33.5(q,C-29)、23.0(q,C-30),棕櫚酰基δ C: 173.5(s,C-1′)、35.0(t,C-2′)、25.4(t,C-3′)、29.0~30.0(s,C-4′~C-13′)、31.8(t,C-14′)、22.9(t,C-15′)、14.5(q,C-16′),上述1H NMR、13C NMR谱数据与文献报道[9]项对照,鉴定为β-香树脂醇棕榈酸酯(β-Amyrin palmitate)。
化合物[STHZ]11[STBZ]:白色脂状固体(甲醇)。mp.114~116 ℃;10%硫酸乙醇显紫色;IR(KBr) cm-1:3458、2923、1730、1465,显示有羰基(3458cm-1)、羟基有饱和烃基(2923 cm-1、2852cm-1)、羰基(1731cm-1);1H NMR(500 MHz,CDCl3)δ H:5.10(1H,t,J=3.6Hz,H-12)、4.81(1H,dd,J=6.4、9.0Hz,H-3α)、0.96(3H,d,J=4.5Hz,H-30)、0.92(3H,d,J=5.5Hz,H-29)、1.05、1.02、0.85、0.87、0.80(各3H,s,H-27、26、24、23、25)、2.31(2H,t,J=7.1Hz,H-2′)、0.85(3H,t,J=7.0Hz,H-30′);13C NMR(125 MHz,CDCl3)δ C:38.7(t,C-1)、26.0(t,C-2)、79.2(d,C-3)、38.5(s,C-4)、55.2(d,C-5)、18.0(t,C-6)、32.9(t,C-7)、39.9(s,C-8)、47.6(d,C-9)、36.7(s,C-10)、23.6(t,C-11)、124.2(d,C-12)、139.6(s,C-13)、42.4(s,C-14)、28.5(t,C-15)、26.7(t,C-16)、33.7(s,C-17)、59.0(d,C-18)、39.5(d,C-19)、39.6(d,C-20)、31.0(t,C-21)、41.7(t,C-22)、28.2(q,C-23)、16.8(q,C-24)、15.8(q,C-25)、17.0(q,C-26)、23.1(q,C-27)、28.5(q,C-28)、17.7(q,C-29)、21.6(q,C-30),棕榈酰基δ C:173.6(s,C-1′)、34.7(t,C-2′)、25.1(t,C-3′)、29.2~29.5(s,C-4′~C-13′)、31.7(t,C-14′)、22.8(t,C-15′)、14.1(q,C-16′)。以上1H NMR、13C NMR譜数据和文献报道[10]对照,鉴定为α-香树脂醇棕榈酸酯(α-Amyrin palmitate)。
化合物[STHZ]12[STBZ]:白色粉末(环己烷-乙酸乙酯)。mp.142~144 ℃;IR(KBr) cm-1:3450、2928、2857、1645、1460、1385、1250、977,显示分子中有羟基(3450 cm-1)、双键(1645 cm-1、1460 cm-1)等官能团;1H NMR(500 MHz,CDCl3)δ H:0.76、0.80、0.86、0.90、0.94、1.01、1.07(8×3H,s)、3.23(1H,dd,J=11.4,4.4Hz,H-3)、5.15(1H,t,J=6.0Hz,H-12);13C NMR(125 MHz,CDCl3)δ C:39.5(t,C-1)、27.7(t,C-2)、79.9(d,C-3)、39.1(s,C-4)、55.9(d,C-5)、19.7(t,C-6)、33.6(t,C-7)、40.4(s,C-8)、48.7(d,C-9)、37.9(s,C-10)、24.6(t,C-11)、125.0(d,C-12)、140.7(s,C-13)、42.9(s,C-14)、27.0(t,C-15)、27.8(t,C-16)、33.9(s,C-17)、48.1(d,C-18)、47.7(t,C-19)、31.9(s,C-20)、35.1(t,C-21)、37.8(t,C-22)、29.0(q,C-23)、16.5(q,C-24)、17.5(q,C-25)、17.8(q,C-26)、24.7(q,C-27)、29.5(q,C-28)、34.3(q,C-29)、24.3(q,C-30)。上述1H-NMR、13C NMR谱数据文献[11]对照,鉴定为β-香树脂醇(β-Amyrin)。
4 讨论
作者应用多种色谱法对栽培滇龙胆花的化学成分进行了系统的分离制备, 并结合多种波谱法鉴定了12个化合物,主要为五环三萜类化合物,其中分离纯化得到单体化合物量最大为乌苏烷型三萜,即熊果酸(化合物[STHZ]7[STBZ])和2α-羟基-熊果酸(化合物[STHZ]9[STBZ])。化合物[STHZ]1~6、8~12[STBZ]均为首次从龙胆花中分离得到。
文献[12]报道,熊果酸有较强的抑菌抗炎作用,可能是龙胆花主要有效成分之一。但人们仍普遍认为龙胆苦苷是龙胆花发挥疗效的最主要物质基础,且在含量测定的文献[13-14]报道龙胆花中含有一定量的龙胆苦苷,但在其化学成分研究中均未分离得到该成分。经查阅龙胆苦苷稳定性相关文献,李小芳等[15]发现长时间高温度提取不利于龙胆苦苷的稳定性,酒龙胆在“100 ℃,10 min”炮制条件下龙胆苦苷的含量最高,而本实验采用“95%乙醇加热回流提取2次,每次1 h”的提取方法,高温提取时间远超文献报道最佳时间的12倍,是否因长时间加热回流导致本实验最终未分离得到龙胆苦苷有待进一步深入研究。
参考文献
[1]青海省药品检验所编,青海省藏医药研究所.中国藏药(第三卷)[M].上海:上海科学技术出版社,1996:160-163.
[2]罗达尙.新修晶珠本草[M].成都:四川科学技术出版社,2002:508-517.
[3]许传梅,张春红,董琦,等.藏药提宗龙胆花的化学成分研究[J].西北植物学报,2008,28(12):2543-2546.
[4]薛慧清,杨红澎,汪汉卿,等.黄毛橐吾三萜类成分研究[J].中国中药杂志,2008,33(3):272-275.
[5]吕建炜,张承忠,李冲,等.金沙绢毛菊的三萜成分[J].中草药,2006,37(3):349-350.
[6]赵磊,李智敏,白艳婷,等.滇龙胆地上部分的化学成分研究[J].云南中医学院学报,2009,32(2):27-31.
[7]杨亚滨,杨雪琼,丁中涛.白花蛇舌草化学成分的研究[J].云南大学学报(自然科学版),2007,29(2):187-189.
[8]刘世旺,付宏征,林文翰.糙苏的化学成分研究(Ⅰ)[J].中草药,1999,30(3):161-164.
[9]张庆英,王学英,营海平,等.飞廉化学成分研究[J].中国中药杂志,2001,26(12):837-839.
[10]吴致,程志红,刘和平,等.中药拘骨叶脂溶性化学成分的研究[J].中国药学杂志,2005,40(19):1460-1462.
[11]王奇志,梁敬钰,原悦.岩黄连化学成分[J].中国天然药物,2007,5(1):31-34.
[12]王丽娜,伍贤进.熊果酸的提取分离及其运用[J].新疆大学学报(自然科学版),2007,24(增刊):83-87.
[13]江蔚新.三花龙胆地上、地下器官主要有效成分积累规律研究[J].中国中药杂志,2005,30(11):870-871.
[14]许海棠,黄丽涵,曾永芳,等.HPLC-MS测定十味龙胆花颗粒中的龙胆苦苷和小檗碱[J].药物分析杂志,2008,28(10):1641-1644.
[15]李小芳,蒋卫.应用药物动力学数学模型研究酒龙胆炮制过程中龙胆苦苷的化学稳定性[J].世界科学技术,2006(6):49-51.
(收稿日期:2022-09-29 编辑:陶希睿)
