华蟾素注射液对胃癌细胞MGC-803增殖、迁移和侵袭能力及上皮-间质转化的影响
2023-06-13涂雅婷李庆林
涂雅婷,王 萌,程 卉,李庆林
(1.安徽中医药大学药学院,安徽 合肥 230012;2.安徽中医药大学科研技术中心,安徽 合肥 230038;3.新安医学教育部重点实验室,安徽 合肥 230038)
胃癌是常见的恶性肿瘤之一,其发病率和死亡率在全球恶性肿瘤中居于前5位[1]。目前,胃癌早期的主要治疗方法是胃切除、淋巴结清扫联合化学治疗或放射治疗[2],但由于胃癌早期诊断率极低,超过70%的患者发现时已是晚期,而针对晚期胃癌的治疗方法主要是手术切除后结合传统药物辅助化学治疗或放射治疗,此时即使手术去除原发灶,预后仍不理想。此外,传统药物的发展遇到瓶颈,已很难进一步提高患者的生存质量。化学治疗造成无法避免的严重胃损伤,在很大程度上阻碍了其临床应用[3]。因此,需要寻找更多对晚期胃癌转移患者有效的药物。
胃癌的发生、发展、扩散及转移与其微环境密切相关。肿瘤微环境是指实体瘤所处的局部生物环境,包括癌细胞和附近的间质细胞[4]。肿瘤或间质细胞分泌的可溶性因子在肿瘤微环境中含量丰富,有助于诱导肿瘤的异常增殖、血管生成、转移和耐药[5]。肿瘤微环境中上皮-间质转化(epithelial-mesenchymal transition,EMT)的发生与肿瘤细胞的迁移和侵袭密切相关,EMT使静止的贴壁细胞获得迁移能力,是上皮细胞失去顶端-基底极性和细胞-细胞黏附,向侵袭性间质细胞转变的过程[6]。胃癌是临床上侵袭性较强的肿瘤之一,因此,阻断胃癌细胞的EMT是治疗胃癌转移的关键。
如何提高胃癌患者的临床获益是目前亟待解决的问题。中医药在肿瘤治疗方面有一定的特色和优势。蟾蜍分泌物蟾酥及其干燥的蟾皮均可入药。经现代中药成分分析,蟾酥及干蟾皮的化学成分主要有蟾蜍二烯羟酸内酯类、蟾毒色胺类及甾醇类化合物等[7]。华蟾素(cinobufagin,CBG)注射液是由干蟾皮通过水提醇沉的方法得到的水溶性提取物[8],已纳入国家基本医保目录作为抗肿瘤药物进入临床应用。临床应用[9-10]表明,CBG对多种癌症均有明显的治疗作用。Shen等[11]研究发现,CBG可通过调节miR-494-BAG-1轴抑制胃癌细胞增殖并促进凋亡。Xiong等[12]研究表明,抑制自噬可增强CBG诱导的胃癌细胞凋亡以起到抗肿瘤的作用。然而,CBG抑制胃癌侵袭转移的机制并不明确。本研究拟探讨CBG注射液抑制胃癌细胞侵袭转移的分子机制,为CBG治疗胃癌提供理论依据。
1 材料
1.1 细胞 人胃腺癌细胞MGC-803购自中国科学院上海生命科学研究院。
1.2 药物 CBG注射液(批号 200501)浓度为500 mg/mL,由安徽华润金蟾药业股份有限公司提供,成分为干蟾皮提取物,辅料为0.9%氯化钠。
1.3 试剂 Transwell小室(货号 14341,孔径8.0 μm):美国Corning公司;Matrigel胶(货号 B-P-00002-4):Biozellen公司;兔抗人E-cadherin抗体(货号 20874-1-AP)、兔抗人N-cadherin抗体(货号 22018-1-AP):Proteintech公司;兔抗人Vimentin抗体(货号 R22775)、兔抗人Snail抗体(货号 AF6032):成都正能生物技术有限责任公司;β-actin(货号 AF5003):江苏碧云天生物技术研究所;RPMI 1640培养基、胎牛血清(fetal bovine serum,FBS):美国Gibco公司。
1.4 仪器 细胞培养箱、-80 ℃冰箱:日本Sanyo公司;倒置显微镜:日本Olympus公司;超净工作台:浙江苏净净化设备有限公司;灭菌锅:日本Hirayama公司;高速冷冻离心机:德国Eppendorf;垂直电泳仪:上海天能科技有限公司。
2 方法
2.1 MGC-803细胞的培养 MGC-803细胞在含10% FBS和1%青霉素-链霉素的1640培养基中,于5% CO2、37 ℃培养箱中培养,每2 d用磷酸盐缓冲溶液清洗细胞,并换成新鲜的完全培养基,待细胞密度长至80%~90%时,胰酶消化,离心,按1∶3的比例传代培养。
2.2 CCK-8检测CBG注射液对MGC-803细胞活力的影响 取对数生长期的MGC-803细胞,按每孔5×103接种于96孔板中,每组6个复孔,待细胞贴壁后,用细胞培养基稀释含500 mg/mL CBG注射液的原液,分别给予细胞不同浓度(0、1、2、4、6、8、10 mg/mL)的CBG注射液(0 mg/mL即为空白对照组),24 h后每孔加入CCK-8溶液10 μL,30 min后用酶标仪在450 nm处检测吸光值。
2.3 倒置显微镜下观察CBG注射液对MGC-803细胞形态的影响 取对数生长期的MGC-803细胞,消化和收集,将细胞密度调整为每毫升5×104,接种于含1640培养基(含10% FBS和1%青霉素-链霉素)的25 cm2培养瓶中,于5% CO2、37 ℃培养箱中培养。待细胞贴壁后,更换为含有CBG注射液的培养基,继续培养24 h后,倒置显微镜下(10×10倍)观察细胞并拍照。
2.4 细胞划痕实验检测CBG注射液对胃癌细胞划痕愈合能力的影响 将MGC-803细胞接种于6孔板中(每孔1×106),每组3个复孔,待细胞贴壁后用枪头在每孔的培养瓶底部划横线后,PBS洗去划下的细胞,给药后0、24 h在显微镜下观察细胞在划痕处的愈合情况。应用Image J软件分析愈合面积。划痕愈合率=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%。
2.5 Transwell小室检测CBG注射液对胃癌细胞迁移能力的影响 将MGC-803细胞接种于上室(放置在24孔板中,每孔2×104),下层24孔板加入含10%胎牛血清的800 μL培养基。孵育24 h后,用4%多聚甲醛将下室细胞固定,结晶紫染色30 min后,用棉签轻轻擦拭小室内部未穿膜过的细胞,光学显微镜下拍照统计迁移细胞数量。细胞迁移率=CBG注射液组细胞数/空白对照组细胞数×100%。
2.6 Transwell小室检测CBG注射液对胃癌细胞侵袭能力的影响 将Matrigel胶加入小室(放置在24孔板中)。处理24 h后每孔加入20 000个细胞,下层24孔板加入含10% FBS的800 μL培养基。孵育24 h后,固定下室细胞,结晶紫染色30 min后,棉签擦拭掉小室内部未穿过的细胞,光学显微镜下拍照(10×20倍),然后统计侵袭细胞数量。细胞侵袭率=CBG注射液组细胞数/空白对照组细胞数×100%。
2.7 Western blot检测CBG注射液对人胃癌细胞MGC-803中E-cadherin、N-cadherin、Vimentin和Snail表达水平的影响 用含PMSF的RIPA裂解液将MGC-803细胞裂解。使用BCA蛋白测定试剂盒测定蛋白浓度,每孔加20 μg总蛋白。样品经8%~12% Bis-Tris PAGE电泳分离,转移至PVDF膜检测。用含5%脱脂牛奶的TBST室温封闭2 h后,一抗孵育过夜。用TBST洗涤3次后,在IgG-HRP标记的二抗(1∶10 000)中室温孵育2 h。采用化学发光法检测抗原,使用Image J软件进行条带定量。

3 结果
3.1 CBG注射液对MGC-803细胞活力的影响 CBG注射液能抑制胃癌细胞MGC-803细胞的增殖活性,细胞存活率随着CBG注射液浓度的增加和时间的延长呈现下降趋势(P<0.05),其中7 mg/mL CBG注射液作用24 h后细胞存活率趋近IC50时存活率。因此,选择CBG注射液作用时间为24 h进行下一步研究。见图1。
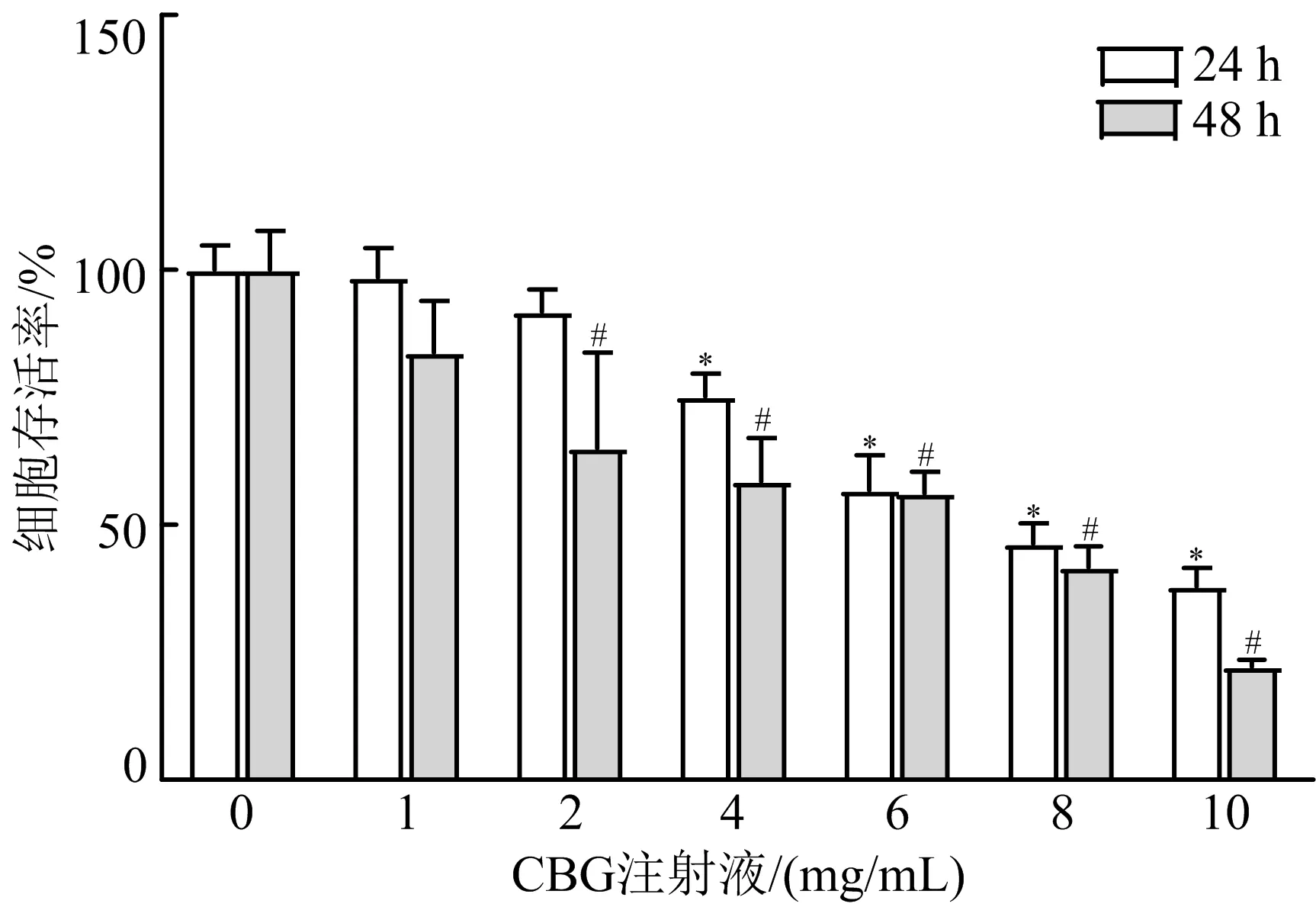
注:与24 h空白对照组比较,*P<0.05;与48 h空白对照组比较,#P<0.05图1 CBG注射液对MGC-803细胞存活率的影响
3.2 CBG注射液对MGC-803细胞形态的影响 光学显微镜下观察发现,处理细胞24 h后,空白对照组细胞形态正常,贴壁良好,折光性强,而给予CBG注射液的各组细胞皱缩变圆,体积变小,细胞折光性明显变弱,贴壁较差,并且呈一定的剂量依赖性。见图2。
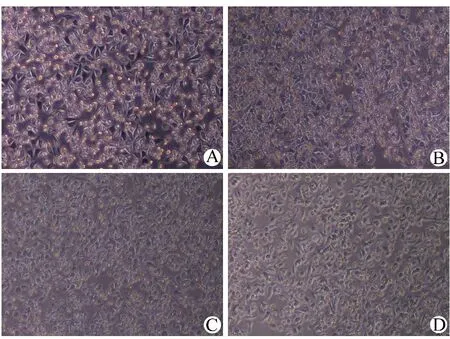
注:A.空白对照组;B.2 mg/mL CBG注射液组;C.4 mg/mL CBG注射液组;D.6 mg/mL CBG注射液组图2 光学显微镜观察CBG注射液对MGC-803细胞形态的影响(10×10倍)
3.3 CBG注射液对MGC-803细胞划痕愈合能力的影响 与空白对照组比较,CBG注射液各给药组细胞的划痕愈合变慢,并且呈现剂量依赖性(P<0.05)。结果表明,CBG注射液可以抑制MGC-803细胞的迁移能力。见图3、表1。
表1 各组MGC-803细胞划痕愈合率比较

图3 光学显微镜下观察CBG注射液对MGC-803细胞划痕愈合能力的影响(10×4倍)
3.4 CBG注射液对MGC-803细胞迁移和侵袭能力的影响 与空白对照组比较,CBG注射液可以显著抑制MGC-803细胞迁移率和侵袭率(P<0.05),并且呈剂量依赖性,表明CBG注射液可抑制MGC-803的迁移和侵袭。见图4、表2。
表2 各组MGC-803细胞迁移率和侵袭率比较
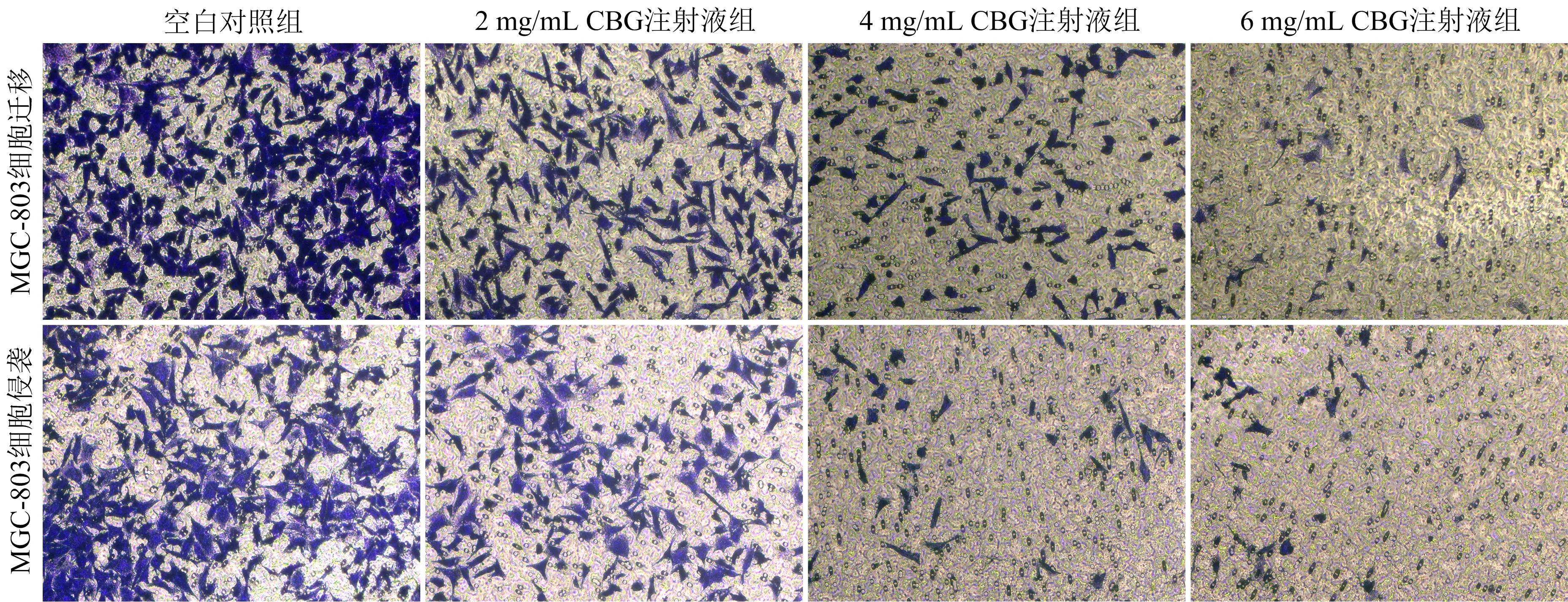
图4 CBG注射液对MGC-803细胞迁移和侵袭能力的影响(结晶紫染色,10×20倍)
3.5 CBG注射液对MGC-803细胞EMT相关蛋白表达水平的影响 与空白对照组比较,CBG注射液能上调MGC-803细胞E-cadherin蛋白的表达水平(P<0.05),下调N-cadherin、Vimentin和Snail蛋白的表达水平(P<0.05),且具有剂量依赖性。见图5。
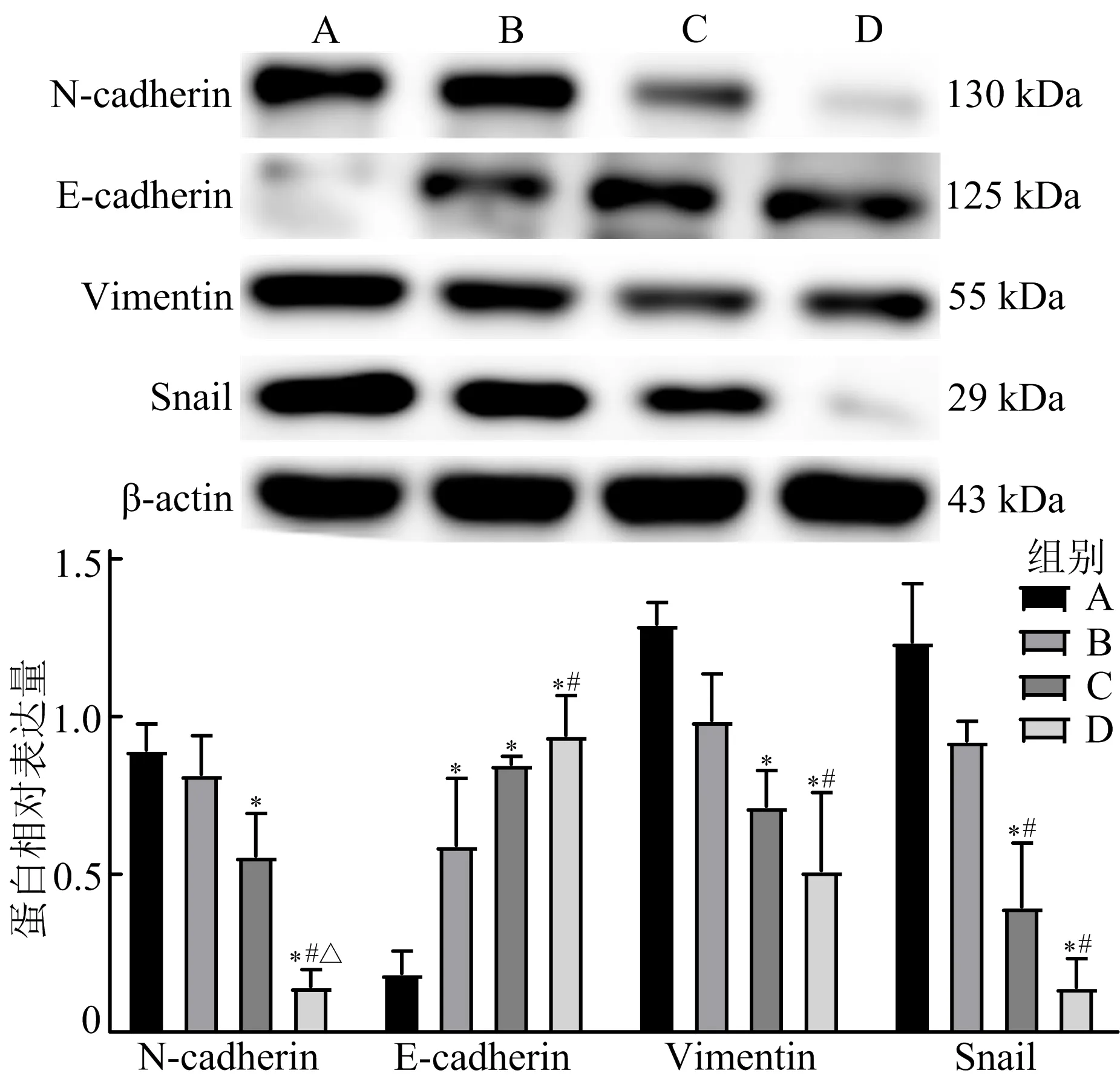
注:A.空白对照组;B.2 mg/mL CBG组;C.4 mg/mL CBG组;D.6 mg/mL CBG组;与空白对照组比较,*P<0.05;与2 mg/mL CBG注射液组比较,#P<0.05;与4 mg/mL CBG注射液组比较,△P<0.05图5 各组MGC-803细胞EMT相关蛋白表达水平比较
4 讨论
尽管过去几十年来,针对胃癌的临床疗法在化学治疗和靶向治疗方面取得了重大进展,但转移仍然是胃癌患者有效治疗的关键障碍[13]。寻找参与细胞迁移和侵袭的潜在分子机制有助于深入了解癌症转移。转移是引起胃癌患者死亡的重要原因[14]。有研究[15]表明,EMT在癌症进展和转移过程中起着关键作用。在EMT过程中,上皮细胞失去其特征,重新编码基因表达并获得间质特性,这使得侵入性表型得以进化,并促进癌细胞的迁移[16]。因此,EMT一直被视为癌细胞侵袭行为的充分条件。
近年来多项研究[17]表明,CBG在胃癌的临床治疗中发挥作用。为了探究CBG抑制胃癌转移的分子机制,本研究首先通过CCK-8实验、划痕愈合实验以及Transwell小室的细胞迁移与侵袭实验对药效进行验证,结果表明,CBG注射液可以抑制胃癌细胞MGC-803的增殖、迁移与侵袭,且抑制效果呈剂量依赖性和时间依赖性。
EMT的共同特征是E-cadherin表达的下调甚至缺失,伴随着N-cadherin表达的上调。这种变化增加了肿瘤细胞侵入和转移到远端的能力。N-cadherin的表达促进肿瘤细胞从原位脱落,甚至克服了E-cadherin的肿瘤抑制作用[18]。Snail是Snail转录因子家族的成员,其可以被TGF-β、Wnt、NOTCH等信号通路激活,从而抑制E-cadherin,诱导EMT并促进细胞迁移[19]。Vimentin是一种重要的Ⅲ型中间丝蛋白,与其他细胞骨架成分(如微丝和微管)一起在细胞结构的支撑、附着、迁移和信号传导等动态过程中起重要作用[20]。在癌症转移过程中,总是能观察到Vimentin的过表达,因此Vimentin被普遍认为是EMT的典型分子标志物[21]。本研究通过Western blot法探究CBG注射液抑制胃癌转移的分子机制是否与EMT有关。结果发现,CBG注射液可以上调上皮标志蛋白E-cadherin的表达水平,下调间充质标志蛋白N-cadherin以及与EMT密切相关的Vimentin和Snail的表达水平,表明CBG注射液可以抑制胃癌细胞MGC-803的EMT。
综上所述,CBG注射液能明显抑制胃癌细胞的增殖、迁移和侵袭,其机制可能与改善胃癌细胞的EMT过程有关。但本研究仅从细胞层面进行了探究,对于CBG注射液体内抗胃癌的作用及分子机制仍需进一步研究。
