万寿菊胡萝卜素羟化酶基因TeCHYE克隆与分析
2023-05-05王瑞鹏杨智强张博昆牛向丽
王瑞鹏, 刘 茜, 杨智强, 张博昆, 黄 姿, 牛向丽
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
类胡萝卜素是植物体重要的色素次生代谢产物。在植物类胡萝卜素的生物合成途径中,两分子的牻牛儿基牻牛儿基焦磷酸(geranylgeranyl pyrophosphate,GGPP)在八氢番茄红素合成酶(phytoene synthase,PSY)的催化下形成八氢番茄红素,后者在八氢番茄红素脱氢酶(phytoene desaturase,PDS)、ξ-胡萝卜素脱氢酶(ξ-carotene desaturase,ZDS)、类胡萝卜素异构酶(carotenoid isomerase,CRTISO)等的作用下脱氢、异构形成反式番茄红素。番茄红素在不同环化酶(lycopene cyclase,LCY)作用下,分别生成α-胡萝卜素和β-胡萝卜素,这是类胡萝卜素合成途径中的一个关键分支点。此后两者经过连续羟化分别形成不同的含氧类胡萝卜素(Xanthophylls)[1]。这种羟化反应包括由细胞色素P450家族类胡萝卜素羟化酶(cytochrome P450-type monooxygenase 97,CYP97)和亚铁血红素依赖型β-胡萝卜素羟化酶(β-carotenoid hydroxylase,CHYB)催化的2种路径,两者同属于类胡萝卜素羟化酶家族[2]。其中,CYP97家族负责具有ε环的α-胡萝卜素的羟基化,简称为CHYE,而具有β环的β-胡萝卜素的羟基化则由CHYB家族完成,通过羟基化最终分别合成叶黄素(Lutein)、玉米黄素(Zeaxanthin)等重要植物色素,与番茄红素等共同组成植物的天然类胡萝卜素功能成分[3]。植物中类胡萝卜素的生物合成途径保守存在,但不同植物物种在各自生存环境的适应进化过程中,由于相关合成途径基因及其表达水平的差异最终积累不同含量的色素组分,呈现丰富多变的色泽。
万寿菊(TageteserectaL.)是菊科万寿菊属草本植物,原产于墨西哥,因其花形大、色彩绚丽、易于栽培,常作为园艺花卉在世界各地栽培种植[4]。由于万寿菊花中富含类胡萝卜素,尤其是叶黄素,而这些色素成分是维持人体健康所必需的营养素,具有抗氧化、防止退行性视力疾病、抗癌、抗辐射等重要功能[5-6],但在人体内无法合成,必须从膳食中摄取或补充[7]。叶黄素是类胡萝卜素合成途径中α分支的终产物,作为含氧类胡萝卜素家族的重要成员之一,既有多种生物活性又具有增色作用,因此在医药、化妆品、饲料等领域被广泛应用[8]。富含叶黄素的万寿菊花也因此成为用于提取天然色素成分的主要植物资源,但目前对其类胡萝卜素合成途径基因的克隆和分析报道较少。本课题组通过万寿菊转录组高通量测序获得了万寿菊CHYE(TeCHYE)基因的组装推测序列,在本文中进一步从花中克隆分离该基因,通过生物信息学分析以及在万寿菊叶片和不同发育时期花组织中的表达水平测定,对其功能进行研究。
1 材料与方法
1.1 实验材料
1.1.1 植物材料
万寿菊(TageteserectaL.)栽培品种‘Juwang’种植于合肥工业大学植物培养室。分别采集生长约70 d万寿菊植株的叶片(L)、花蕾(F1)、未盛开花(F2)、盛开后3 d的花(F3)组织,用于RNA提取、叶黄素质量比测定。
1.1.2 试剂药品
TRIzol购于Invitrogen公司;反转录试剂盒、高保真DNA聚合酶、T4 DNA连接酶、荧光定量聚合酶链式反应(polymerase chain reaction,PCR)试剂盒均购于北京全式金生物技术有限公司;质粒提取试剂盒、DNA纯化试剂盒均购于天根生化科技有限公司;引物设计采用Primer Premier 5.0软件,引物合成和测序由生工生物工程(上海)股份有限公司完成;其他试剂均为国外原装或国产分析纯。
1.1.3 载体与菌株
pEASY-Blunt克隆载体购于北京全式金生物技术有限公司;大肠杆菌(Escherichiacoli)菌株DH5α由本实验室保存。
1.2 实验方法
1.2.1 万寿菊RNA提取与cDNA合成
将采集的万寿菊组织样品液氮研磨,利用TRIzol提取总RNA,并以Nanodrop 2000超微量分光光度计检测RNA的纯度、浓度;然后按照反转录试剂盒操作步骤将所提取RNA经过反转录,合成cDNA,保存于-20 ℃备用。
1.2.2 万寿菊TeCHYE基因的扩增
基于本课题组万寿菊转录组数据,获得万寿菊TeCHYE基因组装序列,并据此序列设计的基因克隆引物CHYEF/R见表1所列。

表1 本实验所用引物
以上述反转录cDNA为模板,利用巢式PCR对TeCHYE基因进行扩增。PCR反应程序如下:
预变性(98 ℃、2 min);变性(98 ℃、10 s), 退火(55 ℃、20 s),延伸(72 ℃、90 s),重复30个循环;最后延伸(72 ℃、5 min)。通过1%琼脂糖凝胶电泳分离检测扩增产物。
1.2.3TeCHYE基因的克隆
利用DNA纯化试剂盒对扩增产物进行纯化,然后将纯化后扩增产物与克隆载体pEASY-Blunt进行连接。连接产物通过热休克法转化大肠杆菌感受态细胞,涂布于含有卡那霉素的固体培养基中,37 ℃培养16 h。然后挑取单克隆进行培养,以引物CHYEF2、CHYER2进行菌落PCR鉴定。取阳性克隆菌液进行质粒提取、送样测序,并比对测序结果。
1.2.4TeCHYE基因生物信息学分析
利用蛋白组学分析平台(ExPASy,https://www.expasy.org/)ProtParam和ProtScale对TeCHYE编码蛋白的理化性质进行分析,使用同源建模方法(SWISS-MODEL)对TeCHYE蛋白三维结构进行预测,并运用RasWin软件对其进行注释优化。将TeCHYE基因序列在美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库进行对比,利用MEGA 7.0软件,使用邻接法(Neighbor Joining)构建进化树进行进化分析,并对保守性较高的蛋白用Espript 3.0(https://espript.ibcp.fr/)在线软件进行氨基酸序列比对分析。
1.2.5TeCHYE基因表达分析
以万寿菊‘Juwang’的叶片和不同发育阶段花组织样品提取RNA、反转录合成cDNA。依据TeCHYE克隆测序结果设计定量检测引物CHYERTF/R(分别位于编码序列第1 017碱基和第1 124碱基处),内参为万寿菊TIF6基因[9],相应引物TIF6F/R序列见表1,对其进行实时荧光定量PCR,该反应体系(20 μL)如下: 2×PerfectStart Green qPCR SuperMix 10 μL,上、下游引物(10 μmol/L)各0.4 μL,模板cDNA(1∶30稀释)4 μL,无菌双蒸水5.2 μL。扩增程序(两步法)如下:94 ℃、30 s;94 ℃、5 s,60 ℃、30 s,40个循环。在Bio-Rad CFX96 Real-time PCR系统运行,利用2-ΔΔCt方法对实时荧光定量PCR 结果进行分析。
1.2.6 万寿菊不同组织叶黄素质量比测定
将万寿菊叶、花组织采样后45 ℃烘干。置于研钵中加入液氮迅速研磨成粉末。称取0.1 g置于试管中,先后加入0.1% BHT(2,6-二叔丁基-4-甲基苯酚)-乙醇0.8 mL、50% KOH 0.2 mL,涡旋振荡混匀,然后50 ℃水浴锅水浴1 h,每隔20 min涡旋1次。水浴完成待冷却后,加入1 mL丙酮超声提取1 h,吸取10 μL提取液滤液,利用高效液相色谱(high performance liquid chromatography,HPLC)法测定叶黄素质量比。色谱条件如下:色谱柱Symmetry C18(5 μm,4.6 mm×250 mm);柱温30 ℃;流动相为乙腈、二氯甲烷、甲醇,三者体积比为7∶2∶1;流速为1 mL/min;检测波长[10]为445 nm 。根据标准曲线计算样品中叶黄素的质量比。
1.2.7 数据分析
本实验所测得数据均采用SPSS 22软件进行统计学分析。
2 结果分析
2.1 TeCHYE基因克隆结果分析
以万寿菊花cDNA为模板,利用特异巢式PCR引物CHYEF/R对TeCHYE基因进行2轮扩增,将第2轮PCR产物进行琼脂糖凝胶电泳,结果如图1a所示。图1a中:M代表DNA Marker;1代表TeCHYE基因扩增产物。
由图1a可知,本实验获得了与预期大小(1 656 bp)基本一致的目的条带,且条带清晰,没有其他明显的非特异扩增产物。将此扩增产物纯化后与pEASY-Blunt克隆载体连接,转化大肠杆菌感受态。
利用基因特异引物CHYEF2/R2对卡那霉素抗性平板上生长的单克隆进行PCR鉴定,结果如图1b所示。
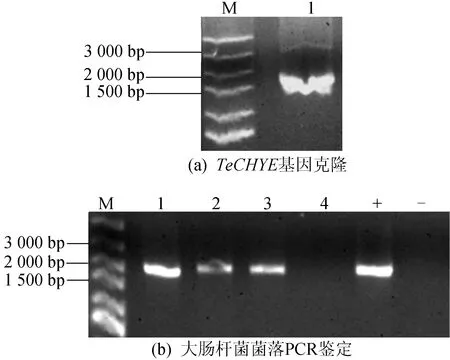
图1 TeCHYE基因克隆载体的构建
图1b中:M代表DNA Marker;1~4代表单克隆编号;+代表正对照,为TeCHYE基因扩增产物;-代表负对照,为pEASY-Blunt空载体扩增产物。
从图1b可以看出,单克隆1~3可能连接有TeCHYE基因。然后将鉴定为阳性的单克隆进行测序验证。测序结果表明,本研究获得了万寿菊TeCHYE基因全长编码序列,其与转录组组装序列仅有少数碱基的差异,进一步说明组装结果较为准确。
2.2 TeCHYE基因生物信息学和表达分析结果
通过蛋白组学分析平台(ExPASy)对TeCHYE编码蛋白的理化性质进行分析。分析结果显示,TeCHYE含有552个氨基酸,相对分子质量为62 125.21;理论等电点为6.62;不稳定系数为35.79,属于稳定蛋白;亲水性平均值为-0.174,属于亲水性蛋白。
通过同源建模方法进一步对TeCHYE的三级结构进行预测,并采用软件优化模型,所具有的α螺旋、β折叠、转角等结构如图2所示。图2中:粉色表示α螺旋;黄色表示β折叠;淡蓝色表示转角;白色表示其他结构;方框标注为亚铁血红素的识别结合。
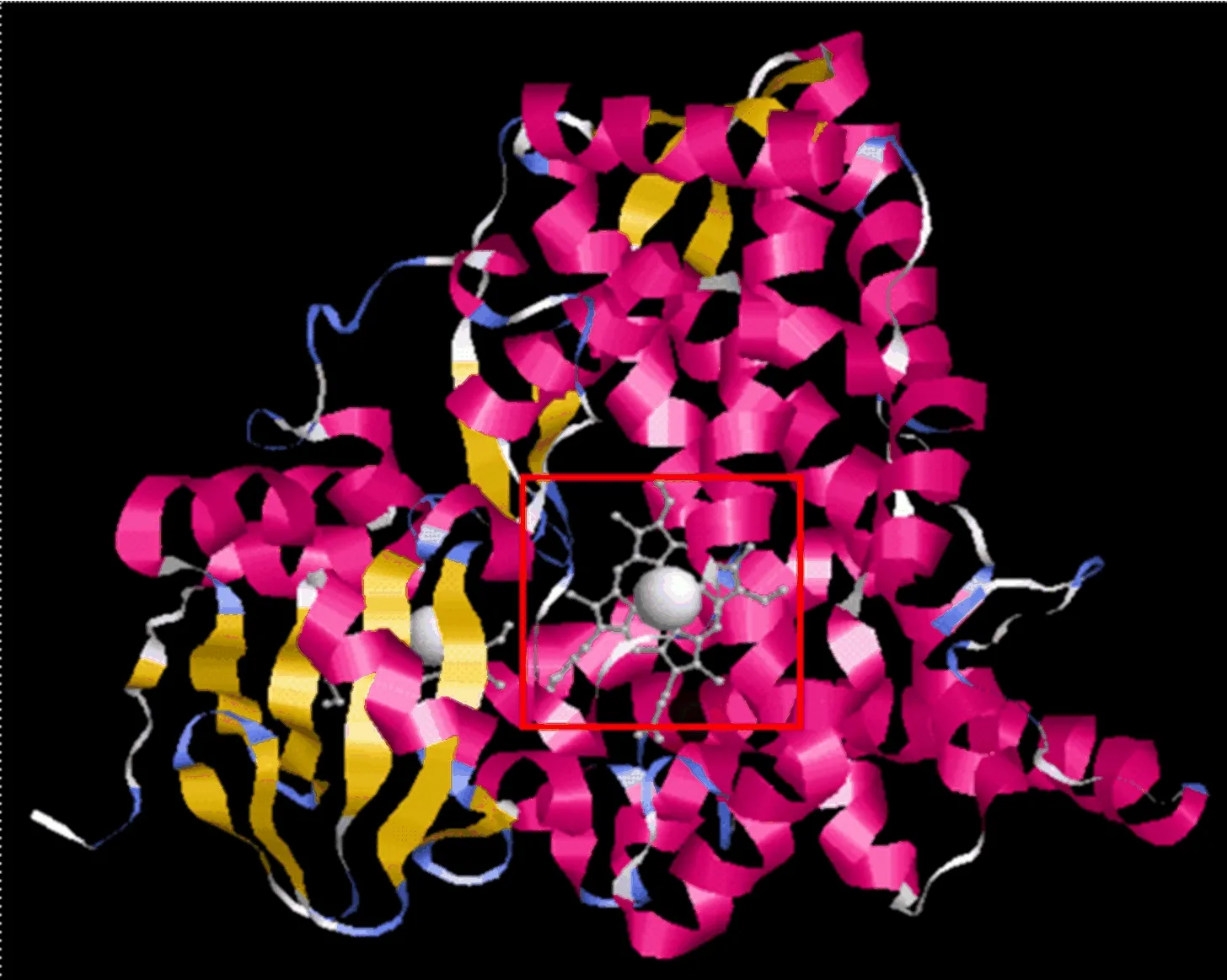
图2 TeCHYE蛋白三级结构预测
利用植物CHYE基因序列所构建的系统进化树如图3所示。图3中:Te(Tageteserecta,万寿菊);Ha(Helianthusannuus,向日葵XM022130222.2);Cc(Cynaracardunculus,大蓟XM025127352.1);Ls(Lactucasativa,莴苣XM02390889 6.1);Cm(Chrysanthemummorifolium,杭菊KX85384 9.1);Cs(Cucumissativus,黄瓜XM 004143239.3);Ps(Papaversomniferum,罂粟XM026562158.1);Nt(Nicotianatabacum,烟草XM016580209.1);Sl(Solanumlycopersicum,番茄NM001247129.2);Rc(Ricinuscommunis,蓖麻XM015719409.2);Jc(Jatrophacurcas,麻风树XM020682561.2);Hb(Heveabrasiliensis,橡胶树XM0 21821728.1);Pm(Prunusmume,梅花XM008243131.1);Pa(Prunusavium,甜樱桃XM021947619.1);Zj(Ziziphusjujuba,枣XM016043092.2);Cs(Cannabissativa,大麻XM030652736.1);Eg(Eucalyptusgrandis,巨按XM010 052026.3);Bo(Bixaorellana,红木KT359009.1);Cs(Crotonstellatopilosus,巴豆HG917436.1);Vr(Vitisriparia,河岸葡萄XM034837759.1);Vv(Vitisvinifera,酿酒葡萄XM019221707.1);Cq(Chenopodiumquinoa,藜麦XM021859450.1)。
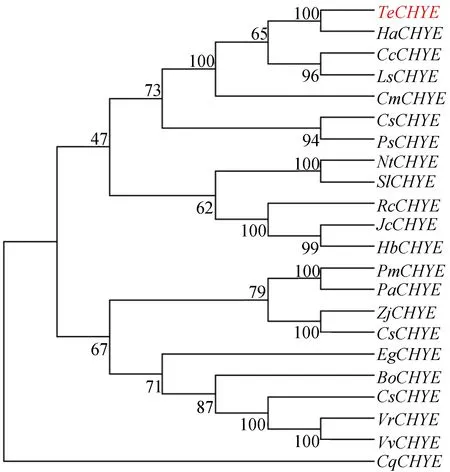
图3 TeCHYE基因系统进化分析
数据库比对结果表明CHYE基因在植物中普遍存在,其中万寿菊TeCHYE与藜麦(Chenopodiumquinoa)同源基因相似性最低,为73.66%,而与同科植物向日葵(Helianthusannuus)的同源性最高,为87.53%。与TeCHYE同源性较高的不同植物物种CHYE蛋白的氨基酸序列比对结果如图4所示。
‘Juwang’叶片(L)以及不同发育时期(F1、F2、F3)的花组织如图5a所示,对各组织中TeCHYE基因的表达水平进行实时荧光定量PCR检测,结果如图5b所示,图5b中不同字母表示有显著差异(P<0.05),下同。由图5b可知,TeCHYE基因在叶片和各发育时期的花中均有表达,但在发育阶段的未盛开花(F2)中表达水平最高。

图4 不同植物的CHYE蛋白氨基酸序列比对
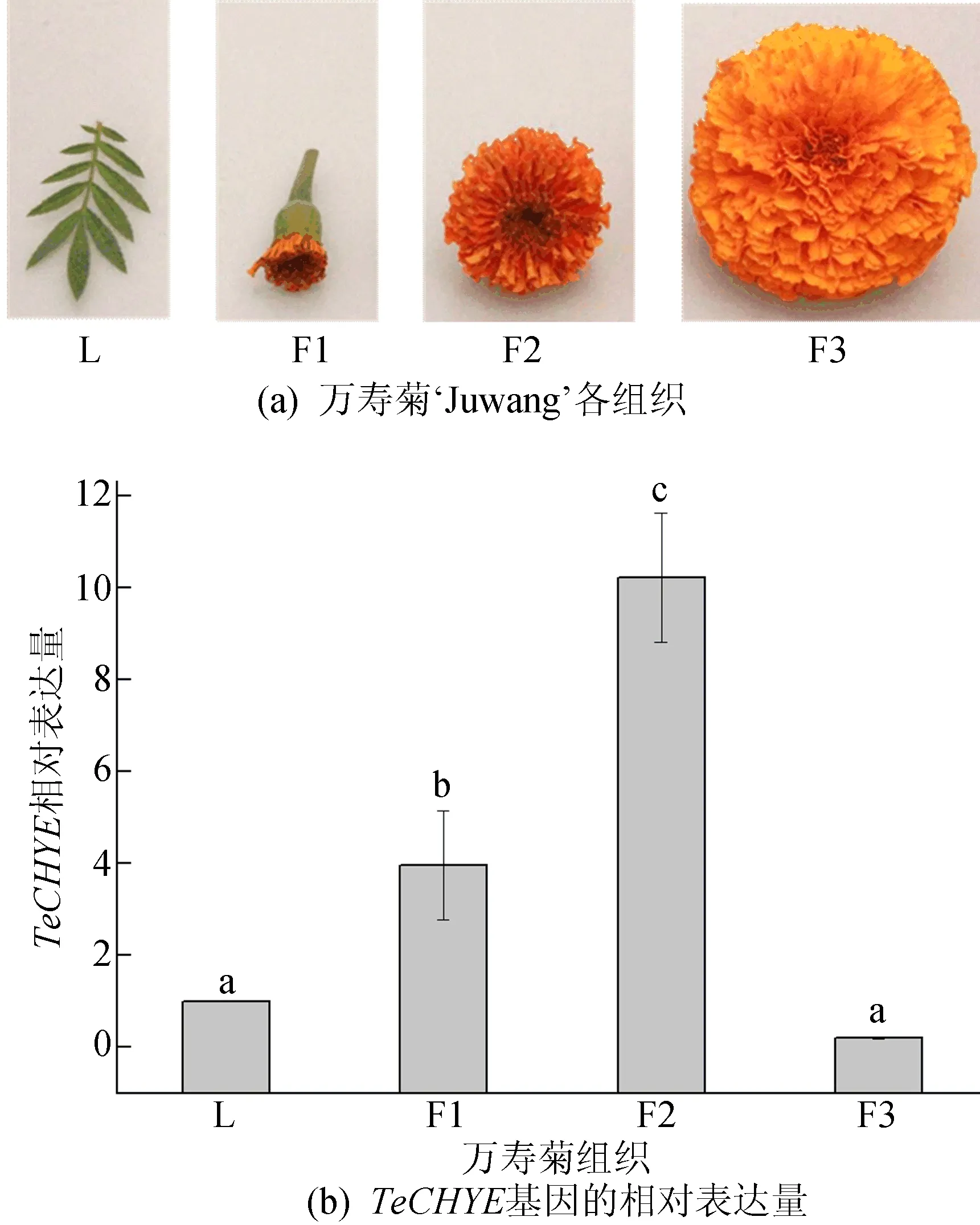
图5 TeCHYE基因表达量分析
2.3 叶黄素质量比分析
对上述万寿菊组织中的叶黄素进行提取,利用HPLC方法对叶黄素质量比进行检测,结果如图6所示。图6中,箭头所指为叶黄素色谱峰。由图6可得万寿菊‘Juwang’叶黄素质量比如图7所示,由图7可知,万寿菊叶片(L)、花蕾(F1)、未盛开花(F2)、盛开后3 d花(F3)中叶黄素质量比分别为10.62、44.49、79.32、57.01 μg/g,不同发育阶段花组织中叶黄素质量比均明显高于叶片,是叶片的5~10倍。万寿菊花组织是合成积累叶黄素的主要部位,且随着发育程度加深,花中叶黄素质量比显著增加,但在完全盛开后略有下降,表明在成熟后期叶黄素可能通过代谢途径转化为其他次生物质。
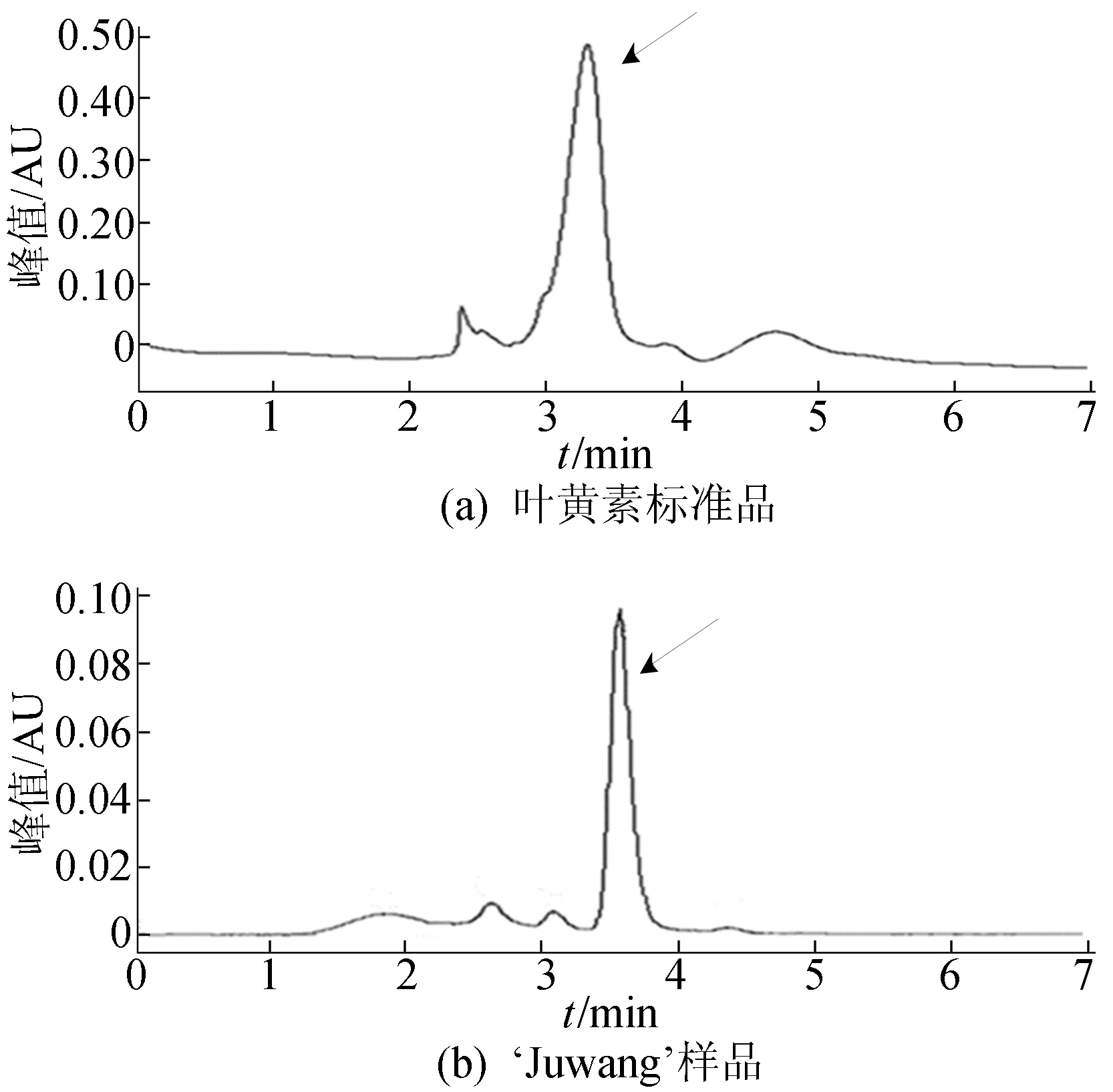
图6 叶黄素标准品和‘Juwang’样品的HPLC谱图
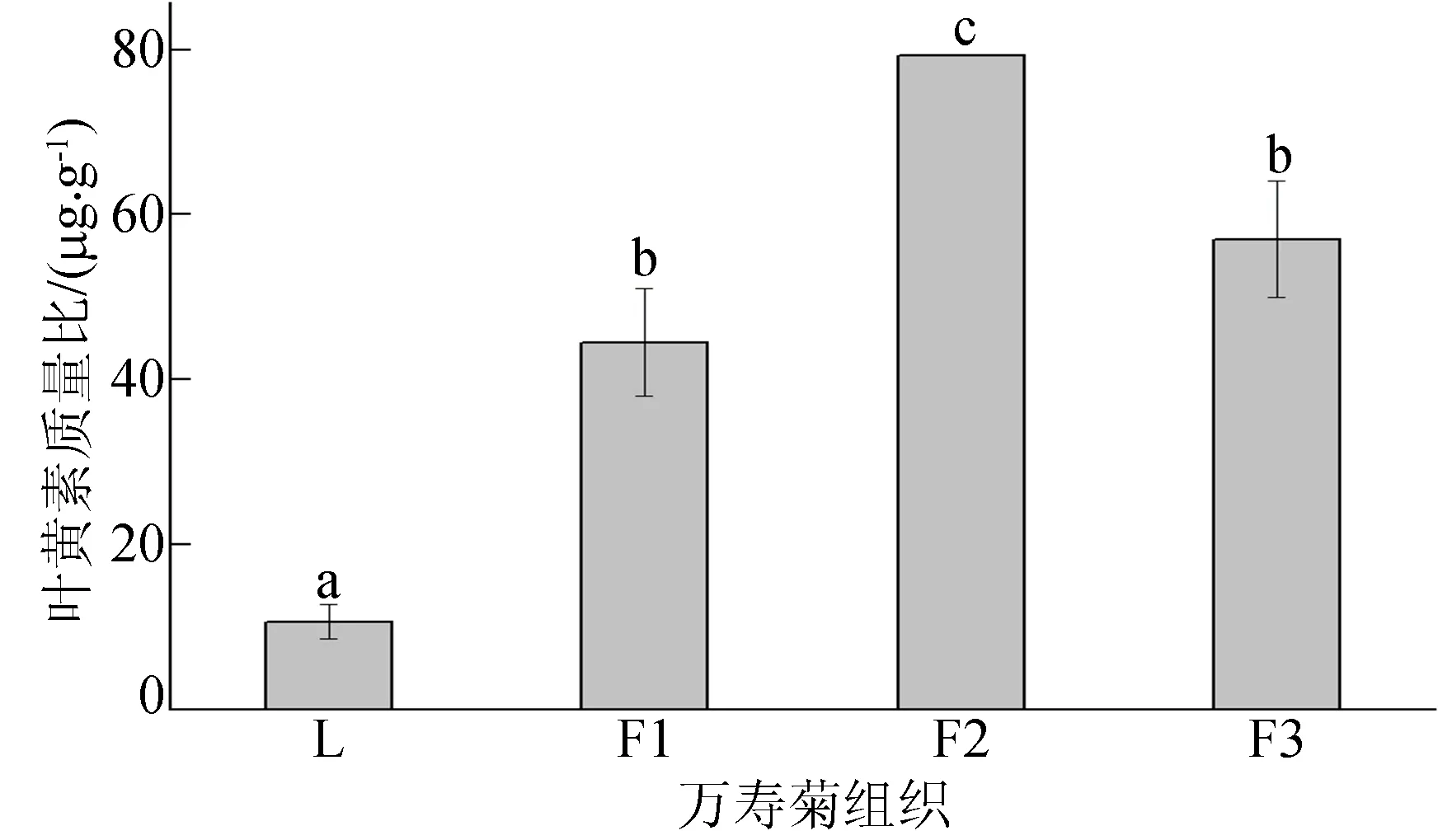
图7 万寿菊‘Juwang’叶黄素质量比分析
3 讨 论
万寿菊颜色多样,有明黄、橙黄、橘黄、橘红,色彩深浅不一[11]。但无论颜色深浅,叶黄素均为万寿菊花中主要色素成分,因此这种颜色差异主要取决于叶黄素的含量[12-13]。本实验所选用橙色万寿菊品种‘Juwang’,其花中叶黄素质量比也显著高于叶片,是合成积累以及用于天然叶黄素提取的组织。但目前对万寿菊叶黄素合成途径相关基因的克隆报道并不多,本文对催化α-胡萝卜素形成叶黄素的α-胡萝卜素ε环羟化酶基因TeCHYE进行了克隆,获得其完整编码序列。进化分析表明万寿菊TeCHYE与同科植物向日葵HaCHYE同源性最高,也进一步说明进化分析的可信性。所预测TeCHYE编码蛋白三级结构与拟南芥同源AtCYP97C1蛋白结构类似。有报道认为,AtCYP97C1主要定位于叶绿体膜,催化α-胡萝卜素ε环和β环的羟基化,但对β-胡萝卜素的β环仅有很低的催化活性[14-16]。当最佳底物α-胡萝卜素耗尽时,植物才发挥β-胡萝卜素羟化酶活性[17]。本文中所检测万寿菊TeCHYE基因的表达模式与相应组织中叶黄素质量比也显示相似趋势,因此TeCHYE可能具有类似功能,催化叶黄素在万寿菊花中的合成。在课题组前期的转录组深度测序分析中[9],CHYE在万寿菊中只发现了本文所克隆的1个基因序列,不存在多个拷贝,考虑到万寿菊花中叶黄素的高合成积累,TeCHYE基因可能在其中发挥重要作用。
已有研究表明,万寿菊所合成叶黄素可以与脂肪酸(主要是饱和脂肪酸)结合,主要以叶黄素酯的形式存在[18]。在相同的光、热条件下,叶黄素酯的稳定性要优于叶黄素[19]。此外,以叶黄素酯提取的天然色素成分也更有利于人体、饲养动物的吸收利用。而通过CHYE催化α-胡萝卜素ε环引入羟基形成叶黄素,这种羟基化也为叶黄素进一步与脂肪酸形成叶黄素酯,在万寿菊花组织中稳定积累提供了条件。文献[20]对牵牛花的研究表明,通过CHYE羟基化促进叶黄素酯的积累是其花瓣呈色的重要原因。
综上所述,本研究通过TeCHYE基因克隆与分析,为植物类胡萝卜素合成途径及可能的遗传改良应用提供了新的基因资源。后续可以利用番茄等模式园艺作物进行遗传转化,通过分析过表达株系果实色素表型进一步验证其功能并评估应用潜力。
