LINC00342调控miR-384对肺鳞癌细胞增殖侵袭迁移的影响研究
2023-03-13徐月亮王孝彬杨尧庆
徐月亮, 王孝彬, 杨尧庆
(空军军医大学唐都医院胸外科, 陕西 西安 710032)
肺癌是常见的恶性肿瘤之一,非小细胞肺癌、肺鳞癌和肺腺癌为其主要病理类型,与非小细胞肺癌、肺腺癌相比,肺鳞癌的发病机制与治疗策略研究明显滞后,严重威胁着人们的生命健康[1]。目前肺鳞癌的治疗手段主要有手术、放化疗、免疫治疗和靶向治疗等,但是患者晚期预后较差,化疗易产生耐药性,治疗效果并不理想[2]。因此,深入探究肺鳞癌发生发展的机制至关重要。长链非编码RNA(long non-coding RNA,LncRNA)参与并调控包括癌症在内的多种疾病的发生发展[3,4]。有研究证实,LINC00342在非小细胞肺癌组织和细胞中高表达,可促进癌细胞转移[5],而miR-384在非小细胞肺癌组织和细胞中的表达水平降低[6]。通过生物信息学分析发现,LINC00342与miR-384可靶向结合。然而,LINC00342对人肺鳞癌细胞恶性生物学行为的影响尚不明确。因此,本研究主要探究LINC00342对肺鳞癌细胞恶性生物学行为的影响及潜在机制。
1 材料与方法
1.1细胞:人肺鳞癌细胞系SK-MES-1购自中科院上海细胞库。
1.2主要试剂:CCK-8试剂盒(CK04)购自上海经科化学公司;Transwell小室(货号:3413)购自北京信生元生物医学科技有限公司;兔源一抗基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)(ab97779)、MMP-9(ab142180)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)(ab265585)、半胱氨酸蛋白酶3(caspase-3)(ab4051)均购自英国Abcam公司;LipofectamineTM 2000 Reagent(ab136465)购自美国Invitrogen公司;LINC00342敲低质粒(si-LINC00342)及对照(si-NC),miR-384抑制剂(miR-384 inhibitor)及对照(inhibitor-NC)、miR-384模拟物(miR-384 mimic)及对照(mimic-NC)、LINC00342及miR-384引物购自广州RiboBio公司。
1.3方 法
1.3.1细胞培养:将SK-MES-1细胞置于含10%胎牛血清、1%青-链霉素的DMEM高糖培养基中,在37℃、5% CO2环境下常规培养,每3d更换一次培养基,当细胞融合度达到85%以上时,消化传代,收集对数期的细胞进行实验。
1.3.2细胞转染:将对数期的SK-MES-1细胞分为ctrl组(正常培养的SK-MES-1细胞)、si-NC组(转染si-NC)、si-LINC00342组(转染si-LINC00342)、si-LINC00342+inhibitor-NC组(si-LINC00342和inhibitor-NC共转染)、si-LINC00342+ miR-384 inhibitor组(si-LINC00342和 miR-384 inhibitor共转染)。转染严格按照LipofectamineTM2000 Transfection Reagent操作步骤进行。
1.3.3RT-qPCR法检测LINC00342、miR-384表达:使用Trizol提取各组细胞中的总RNA,将RNA逆转录为cDNA后,以cDNA为模板上RT-qPCR仪进行扩增。LINC00342:正向引物,5'-CGTTCCAATGTGTTGGGT-3',反向引物,5'-TGGGAGGAGGTTGAGATG-3';miR-384:正向引物,5'-ATTCCTAGAAATTGTTCATA-3';反向引物,5'-GAACATGTCTGCGTATCTC-3';GAPDH:正向引物,5'-CACCCACTCCTCCACCTTTG-3',反向引物,5'-CCACCACCCTGTTGCTGTAG-3';U6:正向引物,5'-GCTCGCTTCGGCAGCACA-3';反向引物,5'-GAGGTATTCGCAGAGGA-3'。分别以GAPDH、U6为内参,采用2-ΔΔCT计算细胞中LINC00342、miR-384的相对表达量。
1.3.4CCK-8法检测细胞增殖:各组细胞接种到96孔板中,每孔初始接种约1×104个细胞,培养24、48、72h后,弃去细胞上清液,且在指定的时间点向每个孔中加入含有10μL CCK-8溶液的100μL完全培养基。孵育2h后,使用酶标仪检测吸光度。
1.3.5Transwell实验检测细胞侵袭:将基质胶包被在上室,并向上室加入无血清的SK-MES-1细胞重悬液100μL,下室加入含10%胎牛血清的DMEM培养基。在37℃、5% CO2下孵育24h后,取出Transwell小室,弃去孔中的培养基,擦去上部未侵袭的细胞,PBS洗涤,甲醇固定,0.1%结晶紫染色。在光学显微镜下计数。
1.3.6划痕实验检测细胞迁移:取各组细胞,置于37℃、5% CO2培养箱中培养24h后,采用20μL移液器枪头进行划痕,显微镜下记0h细胞的划痕宽度为W0,记24h时细胞的划痕宽度为W24。划痕愈合率(%)=(W0-W24)/W0×100%。
1.3.7流式细胞仪检测细胞凋亡:收集各组SK-MES-1细胞,PBS洗涤,重悬细胞,再分别添加Annexin V-FITC和PI染液5μL,充分混匀,于室温下避光染色15min,使用BD流式细胞仪快速检测细胞凋亡情况。
1.3.8Western blot检测蛋白表达:利用RIPA裂解缓冲液提取SK-MES-1细胞总蛋白。电泳分离后,100V恒压转移蛋白至PVDF膜上,用5%的脱脂牛奶封闭2h,将膜与一抗PCNA、MMP-2、MMP-9、caspase-3、GAPDH,在4℃孵育过夜,再将膜与HRP偶联的羊抗兔二抗在室温下孵育2h,弃去液体,洗涤3次,加入ECL试剂观察蛋白质印迹,Image J软件评估各组细胞蛋白相对表达水平。
1.3.9双荧光素酶报告基因实验:构建LINC00342野生型质粒(LINC00342-WT)和突变型质粒(LINC00342-MUT),将LINC00342-WT和LINC00342-MUT分别与mimic-NC或miR-384 mimic共转染于SK-MES-1细胞,48h后,检测荧光素酶活性。
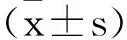
2 结 果
2.1各组SK-MES-1细胞中LINC00342、miR-384表达比较:与ctrl组、si-NC组比较,si-LINC00342组SK-MES-1细胞中miR-384表达升高,LINC00342表达降低(P<0.05);与si-LINC00342组、si-LINC00342+inhibitor-NC组比较,si-LINC00342+ miR-384 inhibitor组SK-MES-1细胞中LINC00342表达变化差异无统计学意义(P>0.05),miR-384表达降低(P<0.05),见表1。
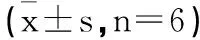
表1 各组SK-MES-1细胞中LINC00342 miR-384表达比较
2.2各组SK-MES-1细胞增殖能力比较:与ctrl组、si-NC组比较,si-LINC00342组SK-MES-1细胞OD450值降低(P<0.05);与si-LINC00342组、si-LINC00342+inhibitor-NC组比较,si-LINC00342+ miR-384 inhibitor组SK-MES-1细胞OD450值升高(P<0.05),见表2。
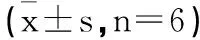
表2 各组SK-MES-1细胞OD450值比较
2.3各组SK-MES-1细胞侵袭情况比较:与ctrl组、si-NC组比较,si-LINC00342组SK-MES-1细胞侵袭数目减少(P<0.05);与si-LINC00342组、si-LINC00342+inhibitor-NC组比较,si-LINC00342+miR-384 inhibitor组SK-MES-1细胞侵袭数目增多(P<0.05),见图1和表3。

图1 各组SK-MES-1细胞侵袭情况比较(×400)
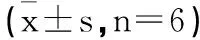
表3 各组SK-MES-1细胞侵袭数目比较
2.4各组SK-MES-1细胞迁移能力比较:与ctrl组、si-NC组比较,si-LINC00342组SK-MES-1细胞划痕愈合率降低(P<0.05);与si-LINC00342组、si-LINC00342+inhibitor-NC组比较,si-LINC00342+miR-384 inhibitor组SK-MES-1细胞划痕愈合率升高(P<0.05),见图2和表4。

图2 划痕实验检测SK-MES-1细胞迁移
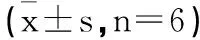
表4 各组SK-MES-1细胞划痕愈合率比较
2.5各组HN-3细胞凋亡情况比较:与ctrl组、si-NC组比较,si-LINC00342组SK-MES-1细胞凋亡率升高(P<0.05);与si-LINC00342组、si-LINC00342+inhibitor-NC组比较,si-LINC00342+miR-384 inhibitor组SK-MES-1细胞凋亡率降低(P<0.05),见图3和表5。

图3 各组SK-MES-1细胞凋亡情况比较
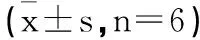
表5 各组SK-MES-1细胞凋亡率比较
2.6各组SK-MES-1细胞中PCNA、MMP-2、MMP-9、caspase-3蛋白表达比较:与ctrl组、si-NC组比较,si-LINC00342组SK-MES-1细胞PCNA、MMP-2、MMP-9蛋白表达降低,caspase-3表达升高(P<0.05);与si-LINC00342组、si-LINC00342+inhibitor-NC组比较,si-LINC00342+miR-384 inhibitor组SK-MES-1细胞PCNA、MMP-2、MMP-9蛋白表达升高,caspase-3表达降低(P<0.05),见图4和表6。
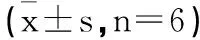
表6 各组SK-MES-1细胞中PCNA MMP-2 MMP-9 caspase-3蛋白表达比较

图4 Western blot检测SK-MES-1细胞中PCNA、MMP-2、MMP-9、caspase-3蛋白表达注:A:ctrl组,B:si-NC组,C:si-LINC00342组,D:si-LINC00342+inhibitor-NC组,E:si-LINC00342+miR-384 inhibitor组
2.7双荧光素酶报告基因检测结果:查询Starbase数据库可知LINC00342与miR-384之间有结合位点,见图5。与mimic-NC和LINC00342-WT共转染组比较,miR-384 mimic和LINC00342-WT共转染组荧光素酶活性降低(P<0.05);与LINC00342-MUT和mimic-NC共转染组比较,LINC00342-MUT和miR-384 mimic共转染组荧光素酶活性差异无统计学意义(P>0.05),见表7。
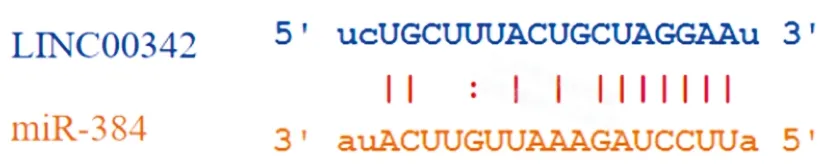
图5 LINC00342与miR-384的结合位点
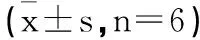
表7 荧光素酶活性比较
3 讨 论
LncRNA可调节癌症的许多重要病理过程,如肿瘤发生、增殖、转移,在肺鳞癌的机制研究中有着重要地位[7,8]。LINC00342的异常表达在多种癌症中充当致癌基因,例如,LINC00342表达在胃癌组织和细胞系中上调[9];在结肠腺癌中,LINC00342的高表达与患者预后不良有关,敲低LINC00342可抑制结肠腺癌细胞增殖、迁移和侵袭,促进细胞凋亡[10]。此外,有研究表示,LINC00342在非小细胞肺癌中呈高表达,敲低其表达可抑制非小细胞肺癌细胞增殖[11]。而LINC00342对肺鳞癌的影响尚不清楚,因此,本研究设计转染si-LINC00342到SK-MES-1细胞中,检测其对肺鳞癌细胞的影响。研究结果显示,敲低LINC00342可降低SK-MES-1细胞的OD450值、侵袭数目、划痕愈合率、PCNA、MMP-2和MMP-9表达,升高了细胞凋亡率、caspase-3表达,提示敲低LINC00342可阻止SK-MES-1细胞的恶性生物学行为,促进细胞凋亡。
LncRNA通过靶向miRNA对癌症发挥调控作用,例如,LncRNA UNC5B-AS1可充当miR-339-5p的分子海绵,敲低其表达可通过靶向上调miR-339-5p抑制人肺腺癌A549细胞增殖,促进其凋亡[12]。LINC00342过表达可通过抑制miR-15b表达,促进肺腺癌转移[13]。miR-384已被确定为多种癌症中与癌症相关的新型miRNA。有研究证实,miR-384在非小细胞肺癌中呈低表达,上调其表达可诱导非小细胞肺癌细胞凋亡,抑制细胞增殖[14]。本研究发现LINC00342与miR-384存在调控关系,通过si-LINC00342与miR-384 inhibitor共转染于SK-MES-1细胞探究其对肺鳞癌的影响。结果显示,抑制miR-384表达减弱了敲低LINC00342对SK-MES-1细胞增殖、侵袭和迁移能力的抑制作用,降低了促细胞凋亡作用。提示敲低LINC00342可能通过上调miR-384抑制SK-MES-1细胞增殖、侵袭和迁移,促进细胞凋亡。
综上所述,敲低LINC00342可能通过靶向miR-384,抑制肺鳞癌细胞SK-MES-1增殖、侵袭和迁移。LINC00342/miR-384可能成为治疗肺鳞癌的一种新的靶点。然而本研究尚存在不足之处,仅仅在细胞水平上验证了LINC00342/miR-384对SK-MES-1细胞增殖、侵袭和迁移的影响,并未在体内水平上进行探讨,后续研究将会在体内水平上进行进一步探索。
