慢性应激致老年雌小鼠学习记忆损伤
2023-02-11徐家雯屠心茹姚余有
徐家雯,屠心茹,刘 锐,江 瑞,陶 龙,姚余有,2*
1.安徽医科大学 公共卫生学院 卫生检验与检疫学系,安徽 合肥 230031;2.安徽医科大学 人口健康与优生安徽省重点实验室,安徽 合肥 230031
女性患阿尔茨海默病(Alzheimer’s disease,AD)的风险更高[1],学习记忆损伤是AD的早期症状,海马与学习记忆密切相关,且海马对压力、应激等环境因素很敏感[2]。慢性应激是指机体长期受到各种内外负面因素的刺激而发生的非特异性全身反应[3],慢性应激可能引起机体免疫、神经生化等系列改变[4],从而影响脑细胞的正常功能,影响学习记忆。m-TOR信号受损后,导致小鼠海马中树突状蛋白合成减少[5],慢性应激是否可通过m-TOR信号通路致老年雌性海马组织神经元损伤,最终引起学习记忆损伤有待研究。基于此,该研究采用20月龄自然老化ICR小鼠模拟人老年期,对其施加慢性不可预测温和应激(chronic unpredictable mild stress,CUMS),观察各组记忆能力,并探讨慢性应激致老年雌鼠学习记忆下降的机制。
1 材料与方法
1.1 材料
1.1.1 动物:SPF级10月龄ICR小鼠共40只,雌鼠与雄鼠各20只,体质量60~80 g(杭州子源实验动物有限公司合格证号:20210523Abzz0105000786)。在鼠房温度为18~25 ℃、环境相对湿度50%~70%、循环给与12 h光照和12 h黑暗、小鼠可自由获得水和食物的条件下,饲养全部小鼠至20月龄。
1.1.2 试剂:β-actin抗体、m-TOR抗体、P-mTOR抗体和辣根酶标山羊抗鼠抗体(Abmart公司);小鼠血清CRH ELISA试剂盒(Elabscience公司); BCA试剂盒(上海碧云天公司)。
1.2 方法
1.2.1 小鼠的分组及处理:将小鼠分为对照雌性组、对照雄性组、应激雌性组、应激雄性组。应激开始前,使用新物体识别实验测定4组应激前学习记忆能力。采用随机数表法对应激组每天施加一种应激,持续30 d,慢性应激施加方法参考相关文献并加以改进[6]。慢性应激方式共包括以下8种:1)夹尾(距尾尖2 cm处,5 min);2)禁水(24 h);3)改变居住环境(让鼠在潮湿的垫料上生活24 h);4)禁食(24 h);5)束缚应激(60 min);6)冰水游泳(4~6 ℃,5 min);7)热水游泳(28~35 ℃,15 min);8)昼夜颠倒。应激结束后,采用新物体识别和Morris水迷宫测定4组小鼠应激后学习记忆能力。行为学实验结束后,将小鼠麻醉后眼球取血并处死,解剖小鼠取海马、全脑。
1.2.2 新物体识别实验测定学习记忆:该实验一共分为两个阶段,第一阶段为熟悉期:在测试箱中放入A、B两个相同的物体,让小鼠自由探索10 min。第二阶段为识别期:熟悉1 h后,将测试箱中的B物体换成C物体,C物体是不同于A、B物体的新物体,让小鼠自由探索5 min。实验结束后分析小鼠在熟悉期和识别期对各个物体的探索时间,计算识别系数。计算公式为:识别系数=新物体探索时间/(新物体探索时间+熟悉物体探索时间)。
1.2.3 Morris水迷宫测定学习记忆:参考相关文献进行操作[7]。在定位巡航试验中,连续训练6 d,4次/d,投放点分别为正北、正南、正西、正东。定位巡航试验结束后,在第7天,撤除平台,选定和平台相对的象限为入水点,记录60 s内小鼠为搜索平台而穿过平台各象限区域的时间,以及穿过平台区的次数。
1.2.4 脑组织Nissl染色:小鼠脑组织标本于4%多聚甲醛固定24~72 h后脱水、石蜡包埋并切片(3 μm),对切片进行尼氏染色。于正置荧光显微镜下观察每张切片(×200),选取各组小鼠海马相同层面CA3、CA1和DG区3个视野,采用Image-J软件计视野内染色阳性细胞数。
1.2.5 脑组织Golgi-Cox染色:行为测试结束后,随机从各组中抽取部分小鼠断头取脑,将脑组织置于20 mL Golgi-Cox溶液中(将5%重铬酸钾,5% 氯化汞,5%铬酸钾和纯水按5∶5∶4∶10的比例配制),37 ℃避光放置7 d。7 d 后取出脑组织置于30%蔗糖溶液中,浸泡1 d。使用振动切片机对脑组织行连续切片,切片厚度为200 μm,取相同层面海马切片依次进行显影、脱水、封片、干燥等操作。采用 Image-J软件对神经元树突进行分析。
1.2.6 Western blot检测蛋白:测定海马组织m-TOR、p-mTOR蛋白表达水平 提取海马组织中的总蛋白,SDS-聚丙烯酰胺凝胶电泳,转移蛋白至PVDF膜,5%脱脂奶粉封闭,一抗(m-TOR、p-mTOR)孵育,二抗孵育,采用化学发光成像仪进行显影,采用Image-J软件进行光密度值分析。
1.2.7 ELISA检测血清CRH含量:从-80 ℃冰箱中取出血清后置于冰上缓慢融化,按照试剂盒说明书操作。采用酶标仪检测微孔板对应的吸光度(absorbance,A)值。使用Origin 9.0软件计算标准曲线并将检测样本A值代入标准曲线公式计算血清CRH浓度。
1.3 统计学分析
2 结果
2.1 各组小鼠行为学实验结果
2.1.1 新物体识别:应激前各组认知系数水平相近。应激后仅应激雌性组认知系数较应激前下降(P<0.001),且显著低于应激雄性组(P<0.001)和应激后的对照雌性组(P<0.001)(图1)。
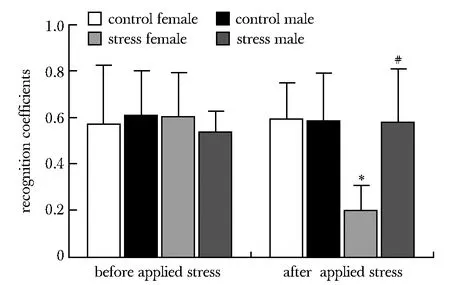
*P<0.001 compared with before applied stress of stress female group;#P<0.001 compared with after applied stress of stress female group图1 各组小鼠新物体识别实验识别系数Fig 1 Recognition coefficients of new object recognition experiments in each group of
2.1.2 Morris水迷宫:随训练天数的增加,各组小鼠逃避潜伏期整体呈下降趋势,但应激雌性组在为期6 d的训练中与其他各组相比均需花费更多时间找到平台。应激雌性组小鼠第1、3、4、5和6天相较对照雌性组小鼠逃避潜伏期差异有统计学意义(DAY1:P<0.05;DAY3:P<0.05;DAY4:P<0.01; DAY5:P<0.001;DAY6:P<0.001);从第5天开始,应激雌性组与应激雄性组逃避潜伏期相比有差异(DAY5:P<0.01;DAY6:P<0.01)(图2B)。
在空间探索实验中,应激雌性组穿越平台次数少于对照雌性组和应激雄性组(P<0.01,P<0.01)(图2C)。应激雌性组穿越目标象限次数少于对照雌性组和应激雄性组(P<0.0001,P<0.01)(图2D)。
2.2 海马区尼氏染色结果
对照雌性组、对照雄性组与应激雄性组各个区神经元形态完整,细胞排列紧密而规则,核仁清晰,胞浆内尼氏体丰富,而应激雌性组各个区细胞排列松散,神经元丢失明显,核仁模糊,尼氏体减少(图3A)。
应激雌性组CA3区的神经元数量少于对照雌性组和应激雄性组(P<0.001,P<0.001)(图3B)。应激雌性组CA1区的神经元数量少于对照雌性组和应激雄性组(P<0.001,P<0.001)(图3C)。应激雌性组DG区的神经元数量少于对照雌性组和应激雄性组(P<0.001,P<0.001)(图3D)。

A.representative graphs of the swimming trajectory of each group of mice during the six-day positioning cruise experiment;B.escape latency of mice in each group of the positioning cruise experiment;C.the number of times each group of mice crossed the platform in the spatial exploration experiment;D.The number of times each group of mice crossed the target quadrant in the spatial exploration experiment;E.swimming speed of each group of mice in the space exploration experiment; *P<0.05,**P<0.01,***P<0.001 compared with control female group;#P<0.01 compared with stress female group
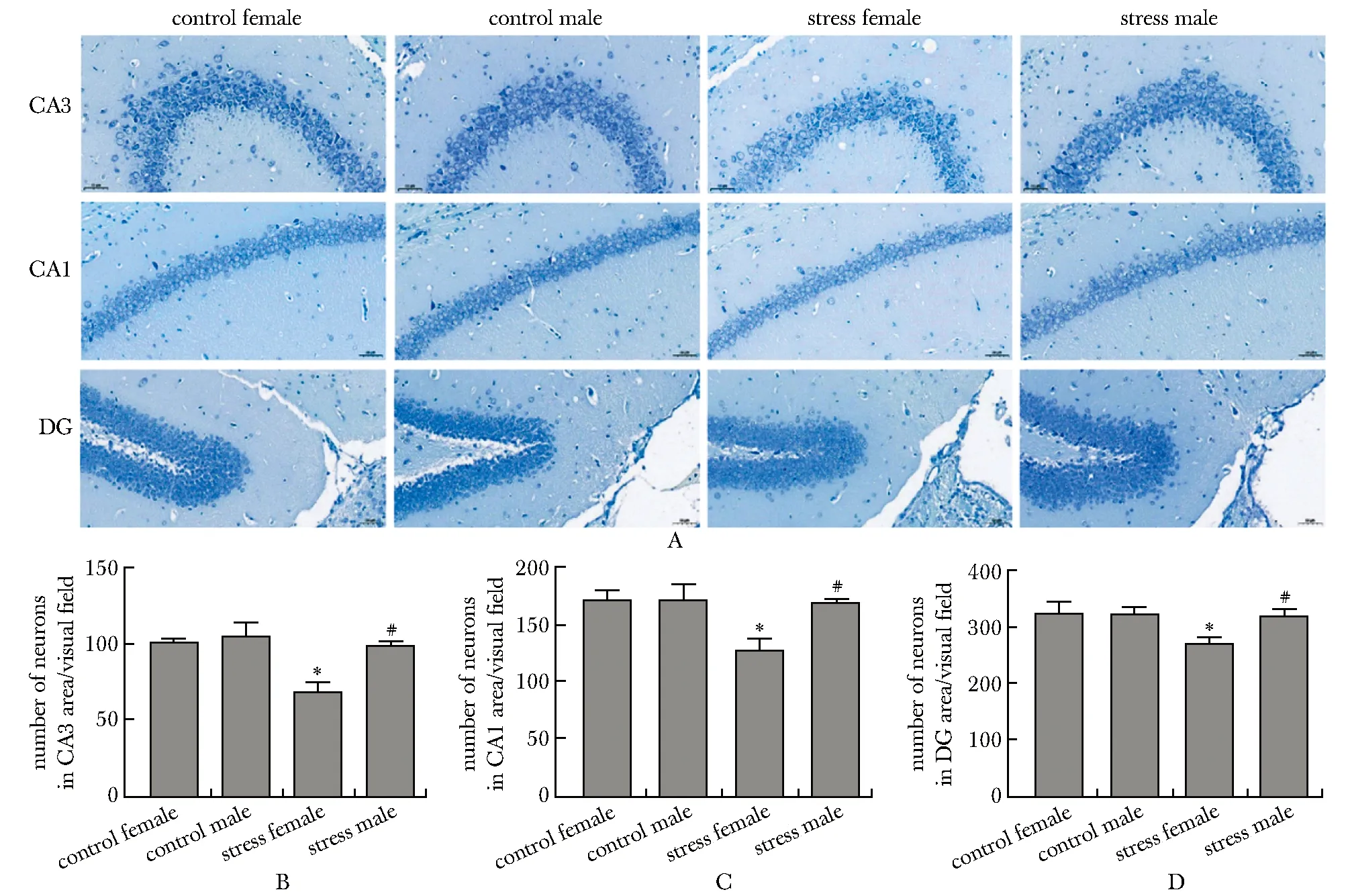
A.Nissl staining of hippocampal CA3, CA1and DG areas in each group of mice (×200);B.number of neurons in the CA3 area under the visual field;C.number of neurons in the CA1 area under the visual field;D.number of neurons in the DG area under the visual field;*P<0.001 compared with control female group;#P<0.001 compared with stress female group
2.3 高尔基染色结果
应激雌性组小鼠海马CA3、CA1区椎体神经元基底树突的分支数及基底树突总长度较对照雌性组和应激雄性组均减少(P<0.05)(图4A~D)。对DG区神经元作Sholl分析,结果显示应激雌性组在20~200 μm的交点数少于其余各组,在距胞体80 μm处交点数少于对照雌性组(P<0.05),在距胞体80、120、140 μm处交点少于应激雄性组(P<0.05,P<0.05,P<0.01)(图4E~F)。
2.4 脑组织中m-TOR、p-mTOR蛋白的表达
应激雌性组m-TOR蛋白表达下降,与对照雌性组和应激雄性组相比有差异(P<0.001,P<0.01),应激雌性组小鼠p-mTOR蛋白表达下降,与对照雌性组和应激雄性组相比有差异(P<0.05,P<0.01)(图5)。
2.5 血清CRH水平
应激雌性组与对照雌性组和应激雄性组相比CRH水平显著上升(P<0.05,P<0.01)(图6)。
3 讨论
慢性应激导致大脑特别是海马功能和结构发生变化,而海马在认知功能中起关键作用。老年人是易发生认知衰退的弱势群体,且以往研究显示老年女性更易发生认知衰退[8],故研究慢性应激是否更易致老年雌鼠学习记忆能力下降有重要意义。
在新物体识别实验中,小鼠应激前学习记忆力无差异,但应激后雌性组记忆下降明显。Morris水迷宫进一步证明了慢性应激更易致老年雌鼠学习记忆损伤,这与Nascimento研究连续3 d束缚应激仅引起6周龄雌性小鼠记忆损伤的结果相似[9]。慢性应激可导致海马功能和结构的改变[10],尼氏体是神经元胞体的特征性结构之一, 尼氏体的状态是神经元是否受损的重要标志。本研究尼氏染色发现应激雌性组小鼠海马CA3、CA1和DG区神经细胞受损明显,这与Haixia Wang连续35 d束缚应激会导致7~8周小鼠神经元损伤的研究结果相似[11]。此外,高尔基染色显示,应激雌性组海马CA3、 CA1、DG区神经元树突分支减少,神经元复杂程度降低,提示由CUMS引起的海马神经元病理损伤可能是造成老年雌鼠认知下降的重要原因。本行为学实验不足之处是数据标准差偏大,影响统计效能,可能是老年鼠个体差异较大引起,其原因还有待进一步研究。
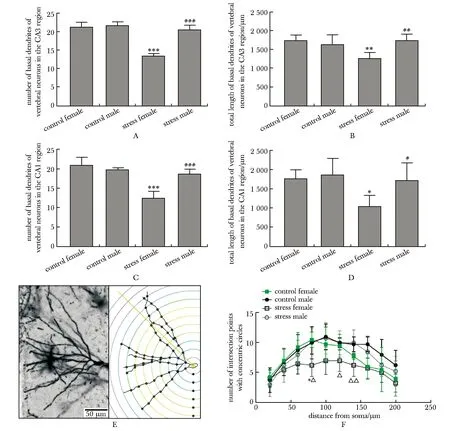
A.number of basal dendrites of vertebral neurons in the CA3 region;B.total length of basal dendrites of vertebral neurons in the CA3 region; C.number of basal dendrites of vertebral neurons in the CA1 region;D.total length of basal dendrites of vertebral neurons in the CA1 region;E.schematic diagram of Sholl analysis of neurons in the DG region;F.number of neurons in the DG area with concentric circle intersection;*P<0.05, **P<0.01, ***P<0.001 compared with control female group;#P<0.05,##P<0.01,###P<0.001 compared with stress female group; △P<0.05, △△P<0.01 compared with stree male group
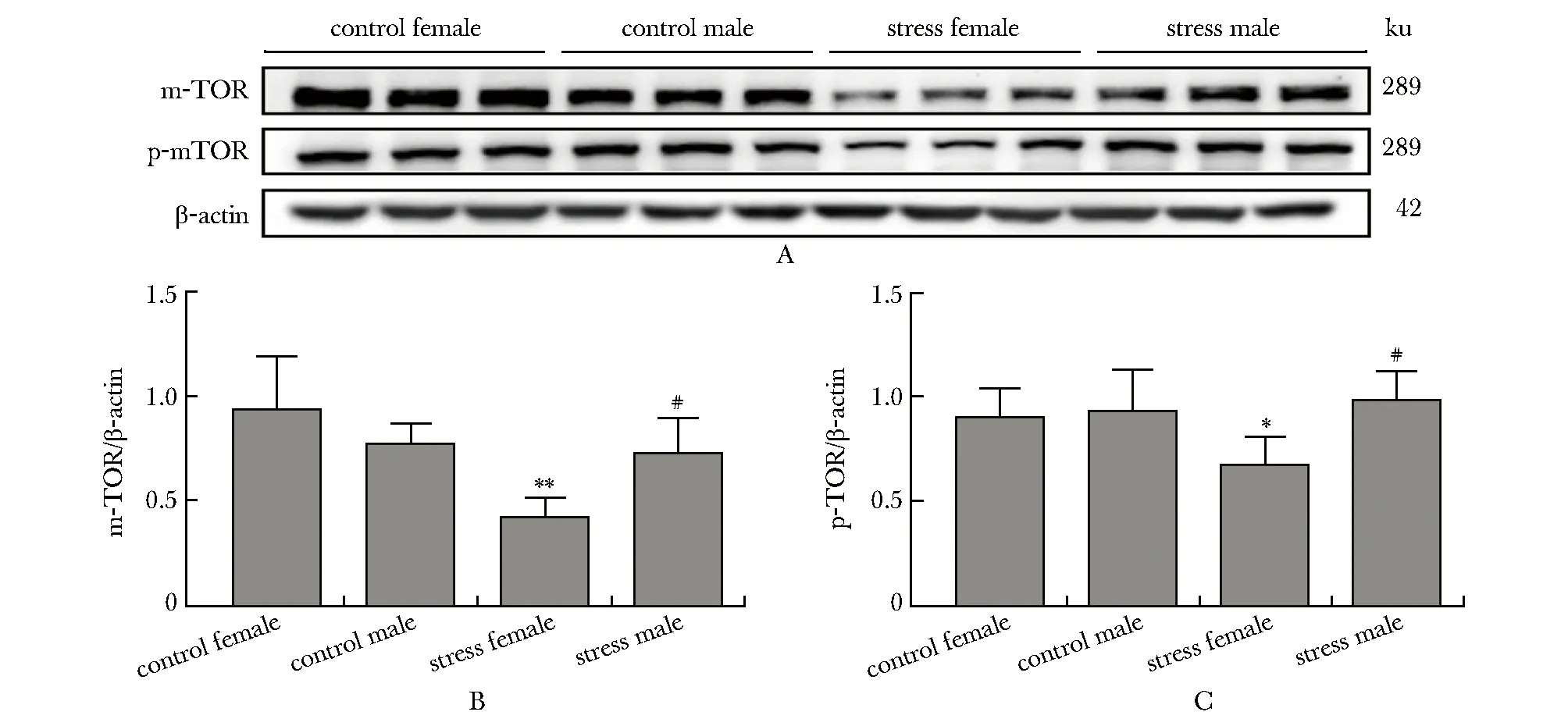
A.Western blot;B.Hippocampal m-TOR protein expression levels in each group of mice; C.Hippocampal p-mTOR protein expression levels in each group of mice;*P<0.05, **P<0.01 compared with control female group;#P<0.01 compared with stress female group
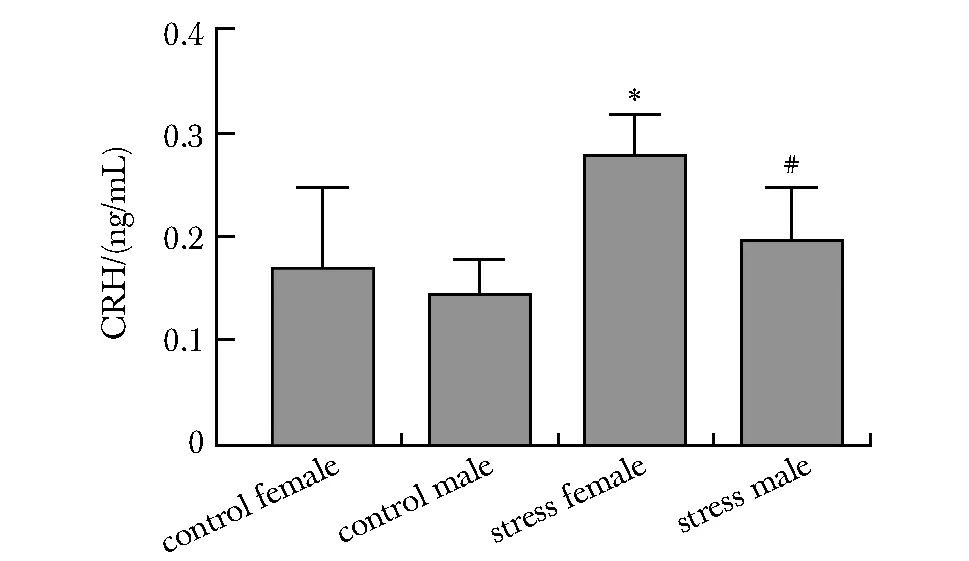
*P<0.05 compared with control female group;#P<0.01 compared with stress female group图6 各组小鼠血清CRH含量Fig 6 Serum CRH levels of mice in each group
m-TOR在调控细胞增殖的过程中起关键作用,激活m-TOR可增加小鼠神经元树突的数量和功能,故其与学习记忆的改变可能存在密切联系[12]。本研究发现,应激雌性组小鼠海马m-TOR与p-mTOR蛋白表达水平显著下降,但应激雄性组小鼠海马m-TOR与p-mTOR蛋白表达未下降,提示慢性应激可能通过抑制老年雌鼠海马m-TOR通路进而导致海马病理损伤。
CRH主要由下丘脑室旁核分泌,在应对压力的反应中起重要作用,以往研究显示应激水平的CRH可以抑制体外培养的海马片树突生长[13-14]且下调m-TOR水平[15]。本研究发现,应激雌性组小鼠血清CRH水平浓度显著上升,提示慢性应激可能通过升高CRH抑制海马m-TOR的表达,损伤海马神经元。
综上所述,慢性应激更易致老年雌性小鼠记忆损伤,其机制可能是慢性应激通过升高CRH抑制海马m-TOR的表达,损伤海马神经元,从而导致老年雌鼠更易出现认知损伤。
