R-2,3-二氯-1-丙醇的不对称合成研究
2023-01-17王亚丽贾旭旭
王亚丽,贾旭旭
(宁夏师范学院 化学化工学院,宁夏 固原 756000)
手性R-2,3-二氯-1-丙醇(R-2,3-dichloro-1-Propanol 或R-2,3-DCP)是重要的药物中间体.常被用于合成二氯丙酮、乙酸纤维、水处理剂等多种化工产品,还可用于合成抗病毒药物“更昔洛韦”(用于治疗艾滋病、器官移植病毒感染等)[1-3],也是合成离子交换树脂、环氧氯丙烷(ECH)和环氧树脂等物质的中间体.但是由于R-2,3-二氯-1-丙醇合成过程受催化剂选择性的限制,目前报道的合成方法中其产率并不高.而催化剂氯过氧化物酶(CPO)由于其特殊的卟啉环结构,具有对底物手性识别的功能,能进行一些特殊的手性催化,选择性很高,近年来引起了药学界和商业界的广泛关注.目前的研究结果表明其被用作催化小分子烯烃环氧化、小分子炔烃羟基化以及有机硫化物磺化氧化等[4-6]方面催化效果显著.
目前甘油合成二氯丙醇都是在羧酸等化学催化剂作用下实现的,在酸性反应环境中,甘油和羧酸首先进行酯化反应,生成羧酸甘油酯[7-8].然后,氯离子与羧酸甘油酯生成3-氯-1,2-丙二醇和2-氯-1,3-丙二醇,继续反应则可生成2,3-二氯-1-丙醇和1,3-二氯-2-丙醇,但是该生产方法得到的都是外消旋体,还需通过拆分才能得到R-2,3-二氯-1-丙醇,而拆分后产率并不好.怎样直接合成手性的二氯丙醇仍是一个需要解决的问题,而且目前已知的合成方法产率都不高[9].基于此本文尝试以氯过氧化物酶作催化剂,利用其对底物的手性识别功能,催化氧化甘油氯化一步反应制备R-2,3-DCP.
1 实验部分
1.1 材料与仪器
氯过氧化物酶(Rz= 1.05,Sigma-Aldrich公司),甘油(国药试剂),叔丁基过氧化氢(国药试剂),30% 过氧化氢(国药试剂),四甲基溴化铵(阿拉丁试剂),四乙基溴化铵(阿拉丁试剂),四丙基溴化(铵阿拉丁试剂),四丁基溴化铵(阿拉丁试剂),无水乙醇(国药试剂),无水亚硫酸钠(国药试剂),磷酸二氢钾(国药试剂),磷酸氢二钾(国药试剂),乙酸乙酯(国药试剂).
主要仪器为GC2014气相色谱仪(日本岛津),UV-1700 型紫外分光光度计(日本岛津),Chirascan圆二色光谱仪(英国应用光物理公司),气相色谱-质谱联用仪HP6890/5973N(美国安捷伦),WZZ-2B自动旋光仪(上海精科),超导傅立叶数字化核磁共振谱仪(Bruker),YS-10A型元素型超纯水仪(上海摩科).
1.2 实验方法
1.2.1 CPO 酶催化TBHP/H2O2氧化甘油的反应
在50 mL的烧瓶中加入15 mL一定pH的0.1 mol·L-1磷酸缓冲溶液(PBS),加入0.001 mol甘油和0.05 mol的NaCl溶液搅拌30 min后,加入0.20 μmol CPO搅拌10 min,再加入0.002 mol过氧化氢(H2O2),其中H2O2采取分次加入的方式,每隔10 min加一次.在25 ℃及固定转速下避光搅拌反应一定时间后,加入无水Na2SO3停止反应.用乙酸乙酯萃取三次,合并有机相后采用无水Na2SO4干燥,干燥后的产物用于气相色谱分析表征,计算产率及选择性.
1.2.2 产物气相色谱分析
色谱柱参数为β-DEX 120手性柱(30 m×0.25 mm×0.25 μm)、FID 检测器、载气(氮气、氢气流速保持在55 mL·min-1、柱头压为0.06 MPa、进样体积为0.3 μL.采用程序升温,初始温度50 ℃,以15 ℃·min-1升温到110 ℃后保持5 min,再以25℃·min-1升到160 ℃后保持2 min).采用与标准品的保留时间进行对照来定性分析;采用标准品做标准曲线对产物进行定量分析,计算产率和光学纯度(ee值).
1.2.3 产物表征及分析
(i)产物旋光性的测定
将数显旋光仪的光学系统以倾斜20°安装在基座上,温度设置为25℃,光源采用20瓦钠光灯,选择合适长度的旋光管盛装溶液,准备测量.首先调零,然后测定旋光度,得到实验数据为16.5°,确定溶液具有旋光性,而且数显为正,确定其为右旋物质,则产物趋于R型.同时也可读出物质的比旋光度,确定物质的纯度,实验中发现溶液的浓度以及旋光管的长度对旋光度均有影响.
(ii)产物核磁共振图谱测试实验通过对CPO酶促卤化甘油反应的产物经提纯分离后,溶解于氘代试剂中进行核磁分析,结果如图1和图2所示.

化学位移 (1×10-6)
从图1(1H NMR)可以看出,在以氘代氯仿作溶剂时,300 Hz的核磁图谱中,除去零点峰外,中间有5个明显的峰位,为5个不同的氢原子峰,每个峰位数值均不同,第一个化学位移为4.18的氢为手性碳上的氢,紧接着化学位移为4.07和3.95的氢,它们是与氯原子相连的首位碳上的氢,而化学位移为3.82和3.83是与羟基相连的碳上的两个氢,羟基氢原子由于受多种因素的影响,化学位移范围一般为2~5,综合分析可以确定化学位移1.81处为羟基氢的峰位.通过对1H核磁谱图进行积分,以判断此物质为 2,3-二氯-1-丙醇.
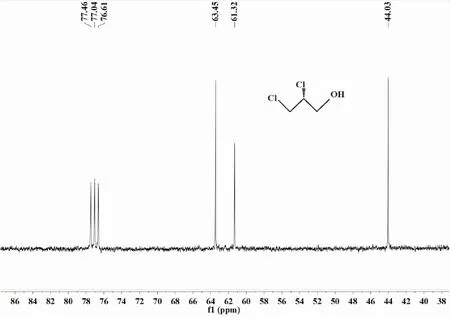
化学位移 (1×10-6)
图2为核磁13C图谱,有三个明显的碳原子峰,根据化学位移依次为63.45的碳原子峰,为与羟基相连的碳,61.32的碳原子峰为中间与氯相连的碳,也就是手性碳,44.03的碳原子峰,为左边与氯相连的碳.其实验测定值与理论值(63.33,61.09,44.38)基本相符,进一步证明所合成的产物是2,3-二氯-1-丙醇.
为了更进一步对产物进行定性分析,实验还进行了GC-MS表征,通过气相色谱让混合物中的组分分离,用质谱鉴定分离出来的组分并确定其含量.与标准图谱对照,确定同样出峰位置在2.367 min得到离子流强度最高的峰.此峰经过质谱鉴定得到质荷比(m/z)为62和31两种明显的碎片峰,其中m/z=62的质谱峰丰度最高,参考谱库确定该丰度为2,3- DCP质谱图,最终确定保留时间在2.367 min的色谱峰确实是2,3- DCP.测试结果进一步定性说明生成物为2,3- DCP.
2 结果与讨论
2.1 氧化剂的选择
在酶作催化剂的反应中,最常用的氧化剂为叔丁基过氧化氢和过氧化氢,但在以过氧化物酶家族为催化剂的部分反应中发现使用H2O2作催化剂会降低酶的活性,因此一些反应采取叔丁基过氧化氢(TBHP)代替H2O2作氧化剂.本实验同时开展两组实验分别以H2O2和TBHP作为氧化剂,CPO作催化剂催化合成手性二氯丙醇.其他反应条件均相同,反应中分别加入相同量的两种氧化剂,反应结束后计算产率,分别为46.2%和41.8%,ee%值分别为91.4%和91.3%,可见该反应以H2O2作氧化剂时产率较高,而ee值影响不大.从绿色化学的角度考虑,H2O2在该反应中除了具有良好的氧化性能,还具有对环境友好性能,所以采用其作催化剂.
确定氧化剂H2O2后,考察其用量对反应收率的影响,确定当底物甘油与H2O2的物质的量比为1∶2时,R-2,3-二氯-1-丙醇的收率达到最高44.5 %,其ee值为90.8%.当增加氧化剂用量时,R-2,3-二氯-1-丙醇的收率反而降低,这是因为随着氧化剂用量的增加使整个体系中氧化剂量比例增多,而CPO具有活性,在氧化剂浓度较高时,其分子结构发生变化,导致活性位点暴露程度降低,催化性能减小.另外反应过程中随着反应的进行,部分H2O2发生分解生成水,不利于有机反应的进行.
2.2 pH对反应的影响
在碱性环境中产率极低,根据实验测定酶已失活,因此,后续确定实验pH范围3~7.结果如图3所示,从图中可以看出,反应最佳pH为5,当pH低于5时,手性二氯丙醇的产率随pH增大而增大,当pH为5时R-2,3-DCP产率达到最大值45.3%,当pH为6时,产物产率下降很快,当pH为7时产率仍降低较快.实验证明该反应最适pH为5,这也跟CPO的本性有关,CPO在偏酸或偏碱环境中其结构会发生改变,活性中心卟啉环受到影响,导致其整个结构失活[10],而在中性条件下,溶液中的底物溶解降低,也会导致产率下降,同时通过旋光仪测定证实在中性条件下会生成部分外消旋体,从而影响产率.
2.3 酶用量对合成反应的影响
在确定pH条件后,考察氯过氧化物酶(CPO)用量对反应产率的影响,结果如图4所示,产物R-2,3-二氯-1-丙醇的产率随酶浓度变化而不同,当CPO用量逐渐增大时,产率逐渐提高,当酶用量大于0.20 μmol时,R-2,3-二氯-1-丙醇的产率基本保持不变,其最高产率达到47.5% ,结合产率并从酶用量方面考虑确定最佳CPO用量为0.20 μmol.可见以CPO作催化剂合成该反应体系,酶的用量极少,其具有潜在的产业化应用价值.
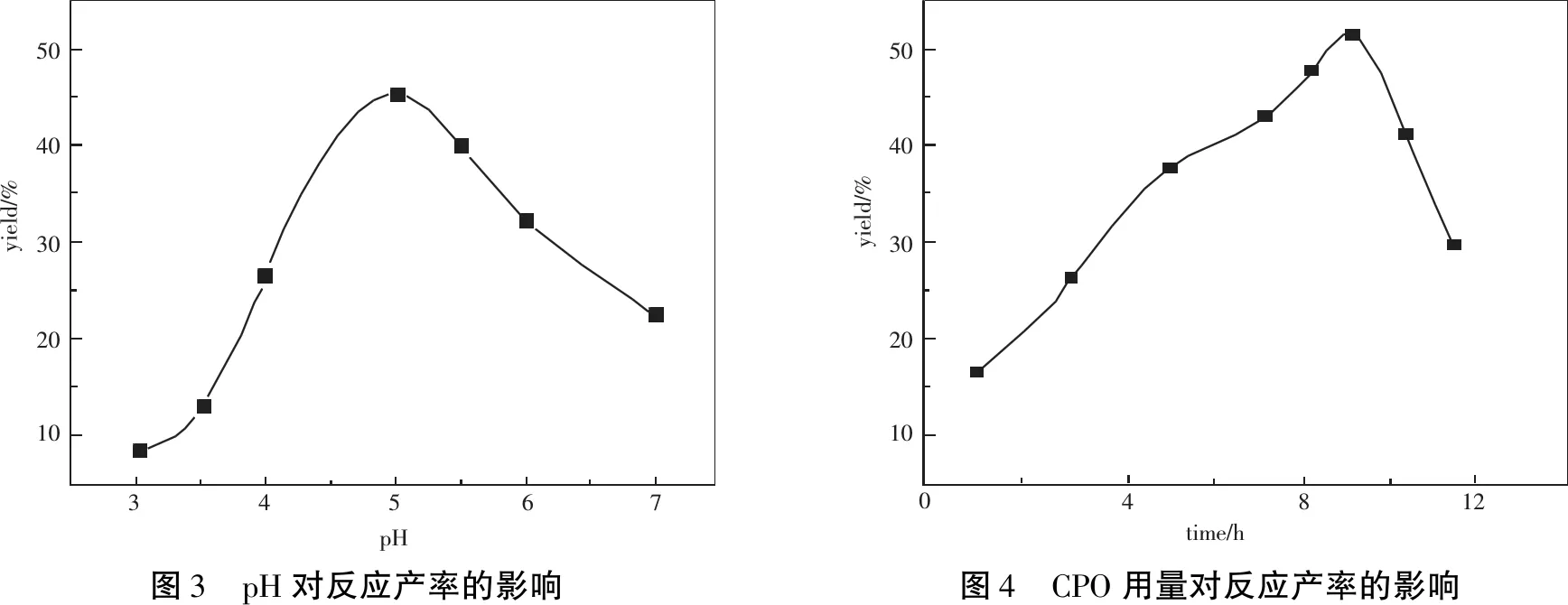
504030201034567pHyield/%504030201004812time/hyield/%图3 pH对反应产率的影响图4 CPO用量对反应产率的影响
2.4 反应时间的影响
确定pH和酶用量后,考察反应时间对CPO催化甘油合成R-2,3-二氯-1-丙醇的影响,结果如图5所示.反应开始,随着时间的延续产率逐渐增大,当反应进行的时间为10 h时,R-2,3-二氯-1-丙醇的产率达到了最大值48.8%.其后随反应时间继续延长,产物产率会逐渐降低.这是因为随着时间的延长导致产物发生聚合,从而降低了产率.因此为了保证获得较高的产率,本体系确定最佳的反应时间是10 h.该反应与合成手性二氯丙醇的其他反应相比,在反应时间上还是有一定的优势.
2.5 温度对反应的影响
为了提高产率,应用前面得到的条件,考察温度对CPO催化甘油合成R-2,3-二氯-1-丙醇的影响,对实验数据作图,结果如图6.CPO在30℃时的活性最好,产物产率达到50.3%.随着温度的升高,酶活性逐渐下降,导致产率降低,温度的变化对该反应产率影响较大.所以确定最佳反应温度为30℃.
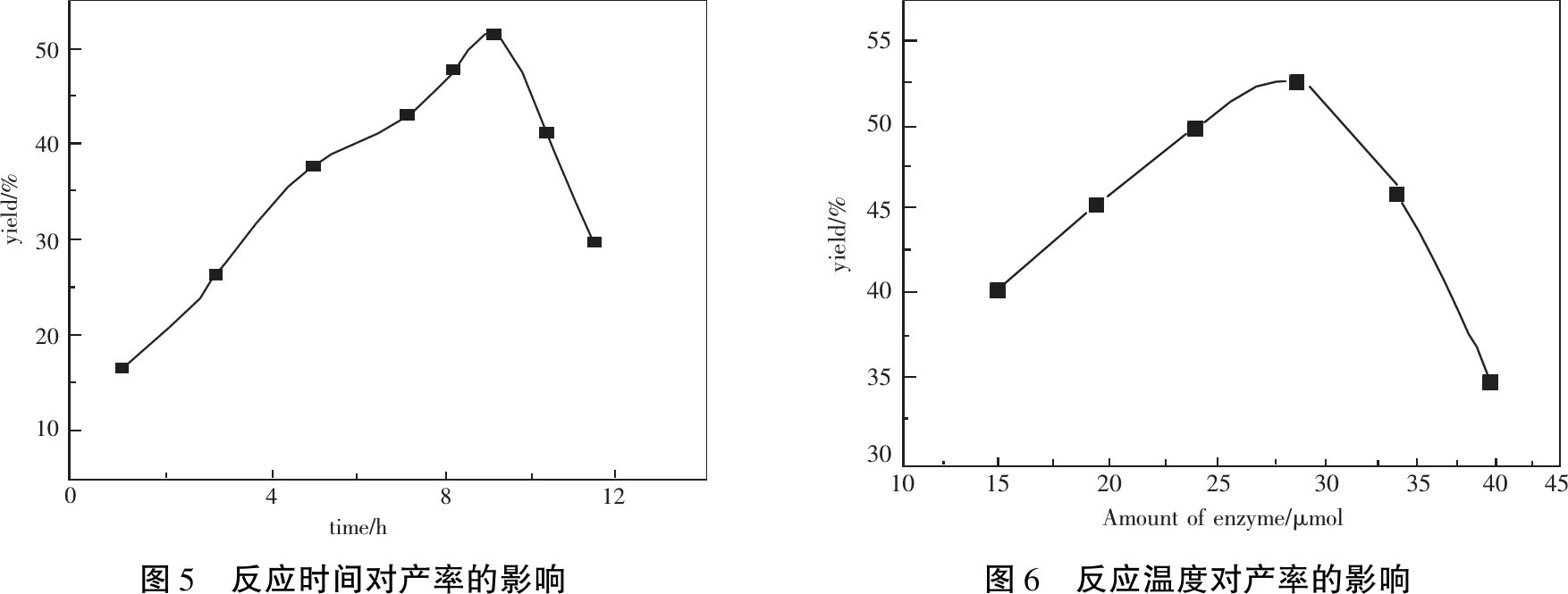
504030201004812time/hyield/%555045403530153010202535yield/%Amountofenzyme/μmol4045图5 反应时间对产率的影响图6 反应温度对产率的影响
2.6 季铵盐对反应的影响
CPO具有亲水性,在有机溶剂中很不稳定,容易失活.而大多数有机底物一般都难溶于水,导致CPO催化的有机合成反应产率均不高.本实验通过前面条件优化后R-2,3-二氯-1-丙醇的产率也仅达到50.3%.为了提高反应的产率,引入季铵盐作为反应体系的添加剂.该类添加剂是一种优良的相转移催化剂,与水相中的亲核试剂组成离子对进入有机相,从而加快反应速率,减少副反应并提高产率.本体系选用四甲基溴化铵(TMABr)、四乙基溴化铵(TEABr)、四丙基溴化铵(TPABr)和四丁基溴化铵(TBABr)作为添加剂,结果如图7所示,可以看出加入季铵盐后产率均提高,其中当在体系中加入0.05 mol · L-1TMABr最高,产率达到了78.6 %,ee值也达到98.4 %.产率提高一方面与CPO本身的结构紧密相关,加入季铵盐后改变了CPO内部结构上疏水性通道与氨基酸残基之间的相互作用,使得CPO活性位点周围产生了大量的疏水性环境,从而使CPO的活性位点和有机底物更容易键合,提高了CPO的催化活性;另一方面底物与季铵盐端基间的静电作用降低了反应的活化能,从而更有利于反应的进行[11].从图7可以看出,添加剂的疏水链越短,越容易接近通道,对CPO催化性能的激活度越高,所以当加入TMABr作为添加剂时,R-2,3-二氯-1-丙醇的产率最高.
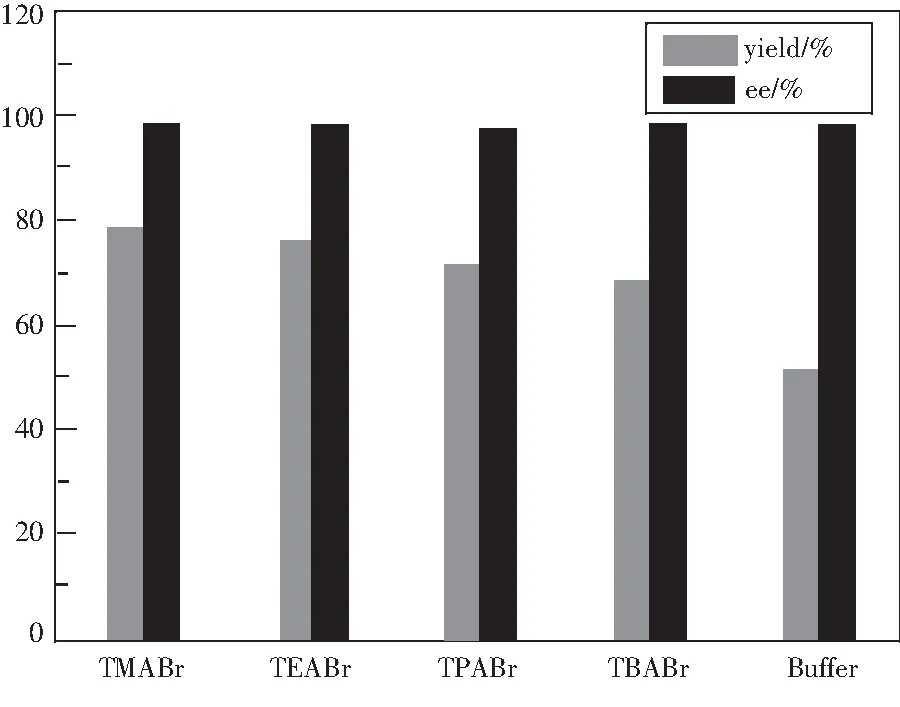
图7 季铵盐对磺化氧化反应的影响
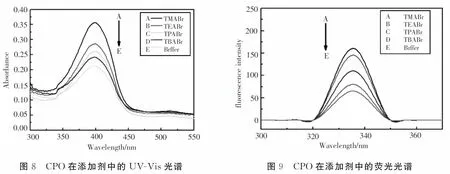
为了对加入添加剂后R-2,3-二氯-1-丙醇的产率提高的原因进一步分析,实验通过UV-Vis光谱仪对加入添加剂后CPO的构象进行了分析,其结果如图8所示,CPO在紫外区的特征吸收峰为398 nm ,这是其结构中血红素辅基卟啉环产生的吸收带,从该实验测试的结果可以看出,当加入季铵盐时,卟啉环的吸收带强度都增强,而在加入四甲基溴化铵时增强最为明显,因为当加入季铵盐时,使CPO结构中的血红素辅基卟啉环活性中心更加暴露,从而紫外吸收强度增大,更有利于底物接近活性中心,使催化活性得到提高,从而使R-2,3-二氯-1-丙醇产率得到提高.
为了进一步对CPO在添加剂中的构象进行分析,采用荧光分光光度计进行光谱测试,结果如图9所示,在不同季铵盐溶液中CPO荧光光谱发生了变化,峰位没有移动,说明此时分子中的肽链没有伸展,氨基酸残基周围的极性没有大的变化.但加入季铵盐的溶液中的荧光强度都比纯缓冲溶液中强,而荧光强度的大小表明CPO侧链微环境的暴露程度,该强度增强表明当加入添加剂季铵盐时CPO结构中的血红素微环境发生了变化,这种变化使得α-螺旋结构加强,从而CPO分子中的铁卟啉环活性中心更易暴露在环境中,内源性荧光活性增强,导致CPO的催化性能提高,从而提高了产率.
3 结论
该合成方法是以CPO为催化剂催化、过氧化氢(H2O2)氧化甘油制备得到R-2,3-二氯-1-丙醇,实验中通过对工艺条件的优化,又采用添加季铵盐提高产率后,反应体系最终产率和ee值分别可以达到78.6%和98.4%.与目前已有的合成方法相比,大大缩短了反应时间.该方法以NaCl作为氯源,减少了污染,同时CPO酶促制备反应快速又高效,并且酶用量极少,具有一定的产业化应用前景.
