白花蛇舌草提取物对肝癌细胞的放疗增敏作用观察
2022-12-24郭驹金凯李美乐唐婷谢裕安
郭驹,金凯,李美乐,唐婷,谢裕安
·论著·
白花蛇舌草提取物对肝癌细胞的放疗增敏作用观察
郭驹1,2,金凯1,李美乐3,4,唐婷1,谢裕安1,2,4,5
1 广西中医药大学研究生院,南宁 530200;2 广西生殖健康与出生缺陷防治重点实验室;3 广西医科大学研究生院;4 广西医科大学附属肿瘤医院实验研究部;5 广西壮族自治区妇幼保健院
观察白花蛇舌草提取物(EHDW)对人肝癌细胞系Huh-7、SMMC-7721的放疗增敏作用。将Huh-7、SMMC-7721细胞分别分成IR组和IR + EHDW组,IR + EHDW组加入40 μg/mL的EHDW培养液,IR组加入同等体积的细胞培养液,继续培养12 h后,两组分别给予0、2、4、6、8 Gy照射剂量的X射线照射5 min,采用平板克隆实验观察EHDW对Huh-7、SMMC-7721细胞增殖能力的影响,以细胞存活分数(SF)表示;采用GraphPad Prism 9.0软件利用单击多靶模型和L-Q模型拟合生存曲线,并使用Sigma Plot V14.5软件计算出各组细胞的放射生物学参数,包括外推数(N)、平均致死剂量(D0)、准阈剂量(Dq)、2 Gy剂量照射时的细胞存活分数(SF2)、放疗增敏比(SER)。取Huh-7、SMMC-7721细胞分成对照组、IR组、EHDW组、IR + EHDW组,EHDW组和IR + EHDW组分别加入40 μg/mL的EHDW培养液,对照组和IR组加入同等体积的细胞培养液,各组细胞继续培养12 h后,IR组和IR + EHDW组给予8 Gy照射剂量的X射线照射5 min,辐照结束后继续培养24 h后更换培养基,48 h后开始收样,采用流式细胞术测算Huh-7、SMMC-7721细胞凋亡率。不同照射剂量下,IR + EHDW组Huh-7、SMMC-7721细胞存活分数均低于IR组(均<0.05)。IR + EHDW组Huh-7、SMMC-7721细胞的SER分别为1.324、1.281。对照组、IR组、EHDW组、IR + EHDW组Huh-7细胞凋亡率分别为20.75% ± 1.48%、54.27% ± 1.58%、63.52% ± 1.76%、75.97% ± 2.02%,组间相比,均<0.05。对照组、IR组、EHDW组、IR + EHDW组SMMC-7721细胞凋亡率分别为24.69% ± 2.18%、35.95% ± 1.19%、52.66% ± 1.04%、77.77% ± 0.89%,组间相比,均<0.05。EHDW可抑制Huh-7、SMMC-7721细胞增殖,增强其放疗敏感性,并诱导细胞凋亡,EHDW对人肝癌细胞系Huh-7、SMMC-7721具有放疗增敏作用。
放疗增敏剂;白花蛇舌草;白花蛇舌草提取物;肝癌;Huh-7细胞;SMMC-7721细胞;放射疗法
肝癌是全球第六大最常诊断、第三大癌症死亡原因的肿瘤,其中肝细胞癌占所有肝癌病理类型的75%~85%[1],5年生存率仅为18%,仅次于胰腺癌[2]。肿瘤治疗中约有70%的患者需要接受放射治疗,并联合靶向及免疫治疗、中医中药等治疗手段,且从中长期获益。目前许多中药已运用于临床,特别是用于治疗恶性肿瘤,尤其是肝癌。白花蛇舌草提取物(extract of hedyotis diffusa willd,EHDW)具有抗肿瘤、抗氧化、抗细菌、增强非特异性免疫和保护神经系统的功能[3],已被广泛应用于消化系统、生殖系统、呼吸系统、骨髓瘤等肿瘤的治疗[4]。EHDW可阻止并抑制多种癌细胞的增殖并诱导其凋亡,如成人脑胶质细胞瘤细胞[5]、腹水肿瘤细胞[6]、人乳腺癌细胞[7]、肝肿瘤细胞[8]等。然而,EHDW增强肝癌细胞放射敏感性的相关研究鲜有报道。2021年5月1日—2022年8月10日,我们观察EHDW对人肝癌细胞系Huh-7、SMMC-7721的放疗增敏作用,现将结果报告如下。
1 材料与方法
1.1EHDW、细胞、试剂及仪器白花蛇舌草购自南京道斯夫生物科技有限公司,主要成分为黄酮类。白花蛇舌草粉末10 g加蒸馏水1 000 mL温火煎煮60 min,加热沸腾30 min,网筛过滤去渣,离心取上清液浓缩为100 mL,0.22 μm过滤器过滤除菌,备用。人肝癌细胞系Huh-7和SMMC-7721细胞(两种放射敏感性不同的肝癌细胞系)均由广西医科大学附属肿瘤医院实验室惠赠。DMEM培养基、胎牛血清、胰酶、青霉素和链霉素均购自Gibco公司。AnnexinⅤ-FITC/PI双染试剂盒购自杭州联科生物技术股份有限公司。超净工作台购自苏州净化设备厂,细胞培养箱购自日本三洋公司,细胞计数仪购自江苏卓微生物有限公司,流式细胞仪购自美国BeckMan公司,医用高能直线加速器购自瑞典Elekta公司,其他试剂和仪器均为国产试剂、设备及装置。
1.2细胞培养取人肝癌HUH-7和SMMC-7721细胞,使用DMEM培养基细胞,培养时加入10%胎牛血清、100 U/L青霉素、100 MG/L链霉素,放入37 ℃、5%CO2及饱和湿度的恒温孵育箱中培养。胎牛血清在56 ℃水浴锅中灭活30 min后冷却至室温再使用。对于血清的分装,需要用无菌的孔径为0.22 μm的一次性的过滤器在细胞房的超净工作台上分装过滤,分装完毕后放-20 ℃保存。
1.3EHDW对HUH-7、SMMC-7721细胞增殖和放疗敏感性的影响观察采用平板克隆实验。选取状态良好的人肝癌Huh-7、SMMC-7721细胞制成细胞悬液,以每孔1×104个细胞接种在6孔板中培养贴壁后,将细胞分为IR组和IR + EHDW组。IR + EHDW组加入40 μg/mL终浓度(经预实验得出)的EHDW培养液,IR组加入同等体积的细胞培养液,继续培养12 h后,两组分别给予0、2、4、6、8 Gy照射剂量[13]的X射线照射5 min,辐照结束后继续培养,每3 d更换一次新鲜培养液,10 d后倒掉全部的培养基直至出现肉眼可见的细胞克隆数目,加入组织细胞固定液3 mL固定细胞30 min,再加入3 mL的Giemsa染液染色1 h,灯箱下计数每个孔板的集落数。以>50个细胞以上的集落为克隆数目,计算出细胞集落形成率(plating efficiency,PE)及细胞存活分数(surviving fraction,SF),以SF表示各组细胞增殖能力。PE=0 Gy照射剂量对照组的细胞克隆数/0 Gy照射剂量对照组细胞接种数×100%;SF=某一照射剂量实验组细胞克隆数/实验组接种细胞数×PE×100%。采用GraphPad Prism 9.0软件利用单击多靶模型SF=1-[1-exp(-Dq/D0)]N和L-Q模型拟合生存曲线,并使用Sigma Plot V14.5软件计算出各组细胞的放射生物学参数,包括外推数(N)、平均致死剂量(D0)、准阈剂量(Dq)、2Gy剂量照射时的细胞存活分数(SF2)、放疗增敏比(sensitizing enhancement ratio,SER)。
1.4EHDW对HUH-7、SMMC-7721细胞凋亡的影响观察采用流式细胞术。选取细胞状态良好的人肝癌Huh-7、SMMC-7721细胞制成细胞悬液,以每孔1×104个细胞接种在6孔板中培养贴壁后,分成对照组、IR组、EHDW组、IR + EHDW组,每组设置3个平行样本。EHDW组和IR + EHDW组分别加入40 μg/mL终浓度的EHDW培养液,对照组和IR组加入同等体积的细胞培养液,各组细胞继续培养12 h后,IR组和IR + EHDW组给予8 Gy照射剂量的X射线照射5 min,辐照结束后继续培养24 h后更换培养基,48 h后开始收样,将收集好的细胞悬液置于离心机以1 000 r/min离心5 min,弃上清留下白色沉淀,再加入Binding Buffer 500 μL和Annexin V-FITC 5 μL一起将细胞混匀,再加Propidium Iodide 10 μL,然后充分混匀,在超净工作台上避光反应5~15 min,1 h内用流式仪检测细胞凋亡情况,测算细胞凋亡率。实验重复3次,取平均值。

2 结果
2.1EHDW对Huh-7、SMMC-7721细胞增殖能力的影响比较IR组、IR + EHDW组Huh-7、SMMC-7721细胞增殖能力比较见表1。由表1可知,不同照射剂量下,IR + EHDW组Huh-7、SMMC-7721细胞存活分数均低于IR组(均<0.05)。
表1 IR组、IR + EHDW组Huh-7和SMMC-7721细胞增殖能力比较( ± s)
注:与IR组同类细胞相比,*<0.05。
2.2EHDW对Huh-7、SMMC-7721细胞放疗敏感性影响IR组、IR + EHDW组Huh-7、SMMC-7721细胞,放射生物学参数见表2。由表2可知,IR + EHDW组Huh-7、SMMC-7721细胞的SER分别为1.324、1.281,提示EHDW可提高Huh-7、SMMC-7721细胞的放疗敏感性。
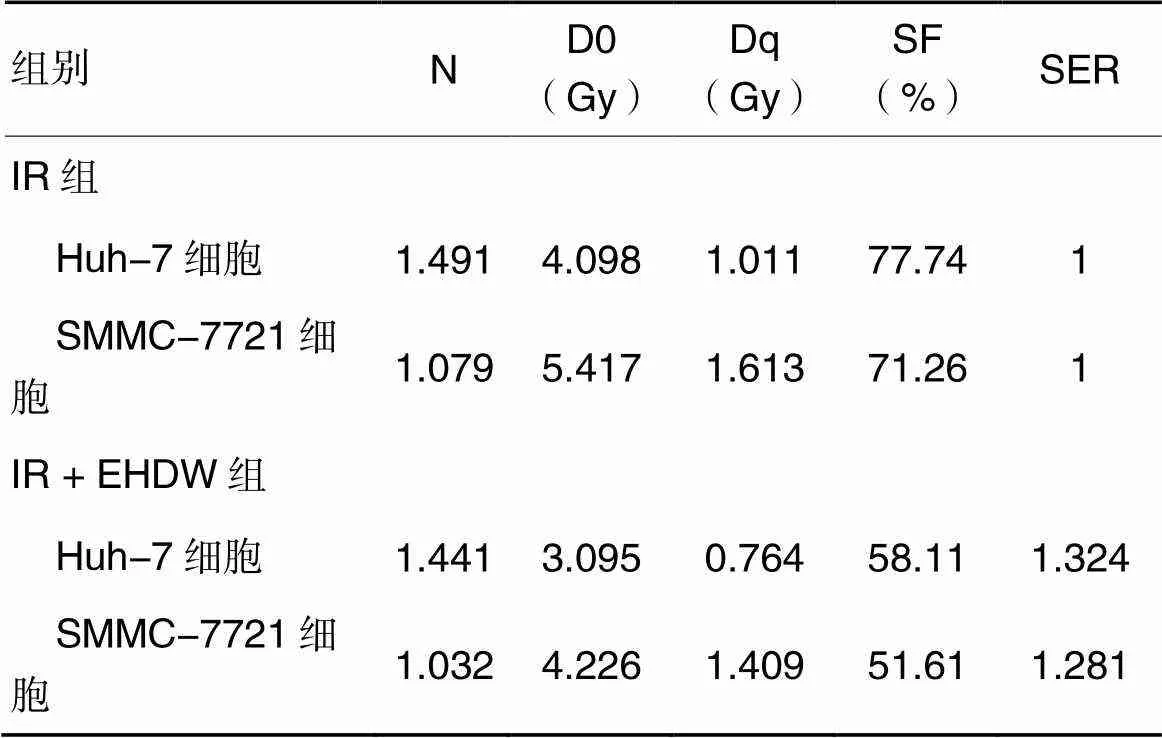
表2 IR组、IR + EHDW组Huh-7和SMMC-7721细胞的放射生物学参数
2.3EHDW对HUH-7、SMMC-7721细胞凋亡的影响比较对照组、IR组、EHDW组、IR + EHDW组Huh-7细胞凋亡率分别为20.75% ± 1.48%、54.27% ± 1.58%、63.52% ± 1.76%、75.97% ± 2.02%,组间相比,均<0.05。对照组、IR组、EHDW组、IR + EHDW组SMMC-7721细胞凋亡率分别为24.69% ± 2.18%、35.95% ± 1.19%、52.66% ± 1.04%、77.77% ± 0.89%,组间相比,均<0.05。
3 讨论
肝癌是我国第五大常见高发恶性肿瘤,其死亡率位列所有癌种的第二位[9],其五年生存率极低,且目前治疗手段对于晚期肝癌治疗效果极差。随着人们对放疗及中医药的不断认识,大量中药不断应用于各种癌症的临床治疗,收到了一定的临床效果。同时,中药也能够增强放射敏感性,大大提高了放射治疗疗效[10]。而放疗增敏剂主要是一种化学制剂或药物,当进行放射治疗时,使用放疗增敏剂可以大大提高放射线对生物体内的杀伤作用,促进DNA裂解使放疗效果进一步加强。本研究根据规范化的放疗增敏实验原则[11],选取能够使人肝癌细胞生长抑制显著的剂量浓度白花蛇舌草提取物,分别对人肝癌Huh-7和SMMC-7721细胞进行放疗增敏实验。本实验选取经预实验处理肝癌细胞的白花蛇舌草提取物终浓度40 μg/mL和经0、2、4、6、8 Gy[13]进行实验处理,实验结果显示:平板克隆实验结果证实了IR + EHDW组人肝癌Huh-7和SMMC-7721细胞系的存活分数显著低于IR组,且结合放射生物学参数,EHDW对人肝癌细胞的放射增敏系数(SER)分别为:Huh-7(SER=1.324)和SMMC-7721(SER=1.281)。流式细胞术结果发现IR + EHDW组处理对人肝癌细胞凋亡率分别是:Huh-7(75.97%)和SMMC-7721(77.7%),以上数据均具有显著的统计学差异。
细胞辐射剂量存活分数曲线描述的是哺乳动物细胞与辐射中所吸收剂量之间的一种量效关系,反映了电离辐射剂量与细胞存活率的关系[12]。细胞存活曲线斜率的倒数为D0值,为细胞平均致死剂量,代表细胞的放射敏感性。Dq为准阈剂量,也称浪费的放射剂量,代表细胞非致死性损伤修复的能力。当细胞接受辐照后,会受到亚致死性损伤,经一段时间后细胞所受损伤可被修复,此过程称为亚致死性损伤修复[13]。SF2为离体培养的肿瘤细胞经2 Gy辐照后的细胞存活分数,为评价肿瘤细胞内在放射敏感性的指标[12]。D0、Dq、SF2数值越小,表明细胞修复损伤能力越小,其内在放射敏感性越高[13]。本研究中,与IR组相比,IR + EHDW组D0、Dq、SF2值均较小,人肝癌Huh-7和SMMC-7721细胞的SER分别为1.324和1.281,表明与IR组相比,经EHDW处理的肝癌细胞内在放射敏感性增高。
相关文献[14]表明,细胞凋亡在肿瘤细胞的放疗敏感性上扮演着重要角色。许多机制可激活细胞凋亡,且多种中药可激活凋亡通路来增强放疗敏感性。有研究[15]显示,雷公藤甲素可通过抑制PI3K/Akt信号通路使人胶质瘤U251细胞凋亡,从而提高胶质瘤细胞放射敏感性。姜黄素联合葡萄糖纳米金颗粒可显著提高乳腺癌MCF-7细胞ROS水平,降低HIF-1α和HSP90的表达,从而促进肿瘤干细胞的凋亡且提高乳腺癌放疗敏感性[16]。同时,白花蛇舌草通过激活p38和ERK1/2 MAPK通路来抑制MMP-9和CAM-1的表达,诱导人乳腺癌MCF-7细胞凋亡并抑制其转移[17]。而白花蛇舌草水提物可通过增加LASP1蛋白表达,使鼻咽癌CNE-1细胞放疗增敏[18]。本研究中,IR + EHDW组对人肝癌Huh-7和SMMC-7721细胞有明显促凋亡作用,其可通过改变细胞凋亡水平来增加肝癌细胞放疗敏感性。
综上所述,X射线照射前加入EHDW可抑制Huh-7、SMMC-7721细胞增殖,增强其放疗敏感性,并诱导细胞凋亡。本实验研究结果可为白花蛇舌草对肝癌细胞具有放射增敏作用提供参考。
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021,71(3):209-249.
[2] ASRANI S K, DEVARBHAVI H, EATON J, et al. Burden of liver diseases in the world[J]. J Hepatol, 2019,70(1):151-171.
[3] 邹香妮,闫珺.白花蛇舌草抗肿瘤化学成分及作用机制研究进展[J].化学工程师,2020,34(3):47-49.
[4] 纪宝玉,范崇庆,裴莉昕,等.白花蛇舌草的化学成分及药理作用研究进展[J].中国实验方剂学杂志,2014,20(19):235-240.
[5] 张焱,邢细红,谢蕊繁,等.白花蛇舌草对人胶质瘤细胞增殖及凋亡的影响及其机制[J].中华实验外科杂志,2010,27(11):1693-1695.
[6] 胡玲,王洪琦,崔娜娟,等.白花蛇舌草对小鼠活体腹水H22肝癌细胞及T细胞的影响[J].广州中医药大学学报,2007,24(4):313-316.
[7] 王信林,宋歌,王艳新,等.白花蛇舌草与半枝莲配伍对乳腺癌细胞MCF-7增殖的影响[J].泰山医学院学报,2019,40(1):31-33.
[8] 汪增秀,吴卫锋.白花蛇舌草有效成分对人肝癌细胞生长影响及相关机制[J].中国老年学杂志,2021,41(21):4838-4841.
[9] RONGSHOU Z, SIWEI Z, HONGMEI Z, et al. Cancer incidence and mortality in China, 2016[J]. JNCC, 2022,2(1):1-9.
[10] 张巧丽,黄金昶.中药放疗增敏剂的研究进展[J].中国临床医生杂志,2014,42(11):23-25.
[11] 魏伟,吴希美,李元建.药理实验方法学(第四版)[M].北京:人民卫生出版社,2010:976-978.
[12] LIU Z Z, HUANG W Y, LIN J S, et al. Cell survival curve for primary hepatic carcinoma cells and relationship between SF(2) of hepatic carcinoma cells and radiosensitivity[J]. World J Gastroenterol, 2005,11(44):7040-7043.
[13] 李晔雄.肿瘤放射治疗学(第五版)[M].北京:中国协和医科大学出版社,2018:285-292.
[14] BALCER-KUBICZEK E K. Apoptosis in radiation therapy: a double-edged sword[J]. Exp Oncol, 2012,34(3):277-285.
[15] SHU M, LI C, ZHONG C, et al. Effects of triptolide on radiosensitivity of human glioma cells and its mechanism[J]. J BUON, 2021,26(4):1549-1555.
[16] YANG K, LIAO Z, WU Y, et al. Curcumin and Glu-GNPs induce radiosensitivity against breast cancer stem-like cells[J]. Biomed Res Int, 2020,2020:3189217.
[17] CHUNG T W, CHOI H, LEE J M, et al. Oldenlandia diffusa suppresses metastatic potential through inhibiting matrix metalloproteinase-9 and intercellular adhesion molecule-1 expression via p38 and ERK1/2 MAPK pathways and induces apoptosis in human breast cancer MCF-7 cells[J]. J Ethnopharmacol, 2017,195:309-317.
[18] 刘畅,郑荣华,温武,等.白花蛇舌草水提物对鼻咽癌细胞放疗增敏的作用及其机制[J].山西医科大学学报,2020,51(3):219-223.
Radiosensitizing effect of extract of Hedyotis diffusa Willd on liver cancer cell lines
1,,,,'
1,,530200,
To observe the radiosensitizing effect of extract of hedyotis diffusa willd (EHDW) on human liver cancer cell lines Huh-7 and SMMC-7721.Huh-7 and SMMC-7721 cells were divided into the IR and IR+EHDW groups, respectively. EHDW culture medium (40 μg/mL) was added to the IR+EHDW group and the same volume of cell culture medium was added to the IR group, and the cells were continued to be cultured for 12 h. After the two groups were given X-ray irradiation at 0, 2, 4, 6 and 8 Gy irradiation doses for 5 min, and the plate cloning assay was used to observe the effect of EHDW on the proliferation ability of Huh-7 and SMMC-7721 cells which was expressed as cell survival fraction (SF). GraphPad Prism 9.0 software was used to fit the survival curves using one-click multi-target model and L-Q model, and the radiobiological parameters of each group were calculated using Sigma Plot V14.5 software, including extrapolation number (N), mean lethal dose (D0), quasi-threshold dose (Dq), cell survival fraction at 2 Gy dose (SF2) irradiation, and radiotherapy sensitization enhancement ratio (SER). Huh-7 and SMMC-7721 cells were divided into the control, IR, EHDW and IR+EHDW groups. EHDW culture medium (40 μg/mL) was added to the EHDW and IR+EHDW groups, and the same volume of cell culture medium was added to the control and IR groups, and the cells in each group were continued to be cultured for 12 h. After the cells in the IR and IR+EHDW groups were given 8 Gy irradiation, we changed the culture medium after 24 h. After 48 h, the cells were collected, and the apoptosis rates of Huh-7 and SMMC-7721 cells were calculated by flow cytometry.The survival fraction of Huh-7 and SMMC-7721 cells in the IR+EHDW group was lower than that in the IR group at different irradiation doses (<0.05), and the SERs of Huh-7 and SMMC-7721 cells in the IR+EHDW group were 1.324 and 1.281, respectively. The apoptosis rates were 20.75%±1.48%, 54.27%±1.58%, 63.52%±1.76%, and 75.97%±2.02% in the control, IR, EHDW, and IR+EHDW groups, respectively, with statistically significant difference between groups (all<0.05). The apoptosis rates of SMMC-7721 cells in the control, IR, EHDW, and IR+EHDW groups were 24.69%±2.18%, 35.95%± 1.19%, 52.66%±1.04%, 77.77%±0.89%, with statistically significant difference between groups (all<0.05).EHDW can inhibit the proliferation of Huh-7 and SMMC-7721 cells, enhance their sensitivity to radiotherapy, and induce apoptosis, and EHDW has a radiosensitizing effect on human liver cancer lines Huh-7 and SMMC-7721.
radiotherapy sensitizer; Hedyotis diffusa Willd; extract of Hedyotis Diffusa Willd; liver carcinoma; Huh-7 cells; SMMC-7721 cells; radiation therapy

10.3969/j.issn.1002-266X.2022.33.001
R735.7
A
1002-266X(2022)33-0001-04
国家重点研发计划项目(NO2019YFC0121901);广西重点实验室运行补助项目(21-220-22)。
郭驹(1990-),男,硕士研究生,住院医师,主要研究方向为肿瘤放射治疗及免疫治疗。E-mail: medicaldreamguoju@gmail.com
谢裕安(1964-),男,博士,教授,博士生导师,主要研究方向为肿瘤免疫与基因治疗。E-mail: 215597239@qq.com
(2022-08-12)
