儿童应用西罗莫司血药浓度波动2例原因分析
2022-12-15徐晓琳韩彤昕成晓玲王晓玲毛华伟
徐晓琳 韩彤昕 成晓玲 王晓玲 毛华伟
西罗莫司(SRL)也称雷帕霉素,是一种免疫抑制药物。在细胞中SRL与亲免蛋白FK结合蛋白-12(FKBP.12)结合,生成免疫抑制复合物,抑制哺乳动物的雷帕霉素靶点(mTOR),从而阻遏T细胞的增殖[1],也可抑制抗体的产生,减少细胞因子引发的T淋巴细胞增殖。近年来,SRL逐渐被应用于器官移植、自身免疫、淋巴管畸形、血管畸形和结节性硬化症等疾病的患儿,显著改善了患儿的生活质量和预后[2-3]。SRL治疗窗窄,特别是当SRL全血谷浓度(Cmin)>15 ng·mL-1时,可导致高甘油三酯血症、PLT减少和WBC减少,随着时间的推移,包括感染高血压、黏膜炎
等不良反应的发生率也会增加[4]。加拿大Drugbank数据库推荐对SRL开展治疗药物监测(TDM)[3],SRL的24 h全血Cmin与浓度-时间曲线下面积(AUC)有良好的相关性[5],推荐通过Cmin调整给药剂量,以提高药物疗效及避免不良反应。但是,有许多因素可能导致Cmin异常,包括分析方法、饮食、采血时间、药物基因型和依从性等,同时药物代谢和药效学的波动中20%~95%可归结为患儿遗传学差异[4]。
本文对2例原发性免疫缺陷病(PID)患儿服用SRL后血药浓度波动的原因进行分析,并结合文献总结诊治经验,旨在提高医务人员对SRL进行TDM的认识,重视药物基因组学在个体化治疗中发挥的重要作用,以促进精准治疗的实施推广。
1 病例报告
例1,女,4.5岁。17月龄时以反复发热、浅表淋巴结肿大为主要临床表现,期间有反复口腔溃疡、鹅口疮,1~2月1次,无明显皮疹,伴皮肤轻微瘙痒,颈部、腋下和腹股沟浅表淋巴结进行性肿大,肝、脾进行性增大,无反复腹泻,无皮肤和肛周脓肿。
例2,女,1岁8月龄。以反复发热,反复感染,RBC、PLT减少,肝、脾、淋巴结肿大为主要临床表现。
图1和图2分别为例1和例2用SRL后血药浓度变化的临床信息时间轴。
2 讨论
PID患儿存在免疫过程失调,导致对感染性疾病、自身免疫性疾病和恶性肿瘤的易感性增加。本文例1因PIK3CD基因突变而致病,PI3Kδ过度活化导致PI3K-AKT-mTOR通路功能增强,打破信号与细胞代谢的平衡,导致细胞功能状态异常。SRL可以抑制PI3K通路的下游,调节mTOR的活性,发挥抗增殖作用,可使患儿免疫学标志物和脾、淋巴结肿大得以改善[6]。SRL以1 mg·m-2·d-1为起始剂量,血药浓度在5~10 ng·mL-1时无临床不良反应,维持剂量在2 mg·m-2·d-1[7]。例2为RAS基因体细胞突变所致的PID,曾有报道KRAS体细胞突变的自身免疫淋巴增殖性疾病(RALD)患者的细胞凋亡缺陷通过PI3K抑制剂得以纠正[8],提示患者可能受益于靶向阻断PI3K-AKT-mTOR途径抑制剂的治疗。

图1 例1重要临床信息时间轴
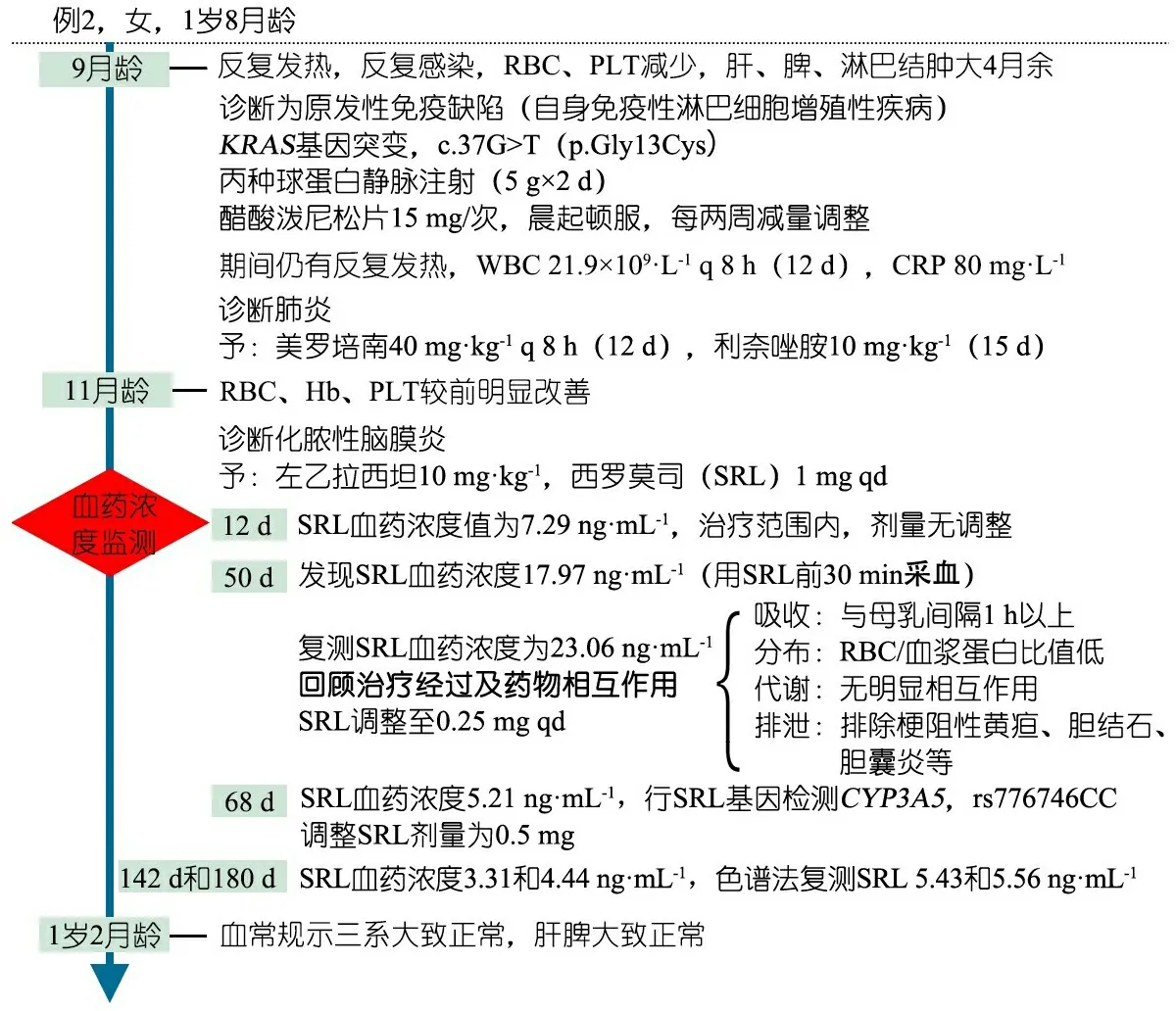
图2 例2重要临床信息时间轴
PID患儿为条件致病菌感染的高危人群[9],例1真菌培养示土曲霉生长,故首选伏立康唑[10]治疗。SRL是CYP3A4的作用底物,与伏立康唑联合使用会导致相互作用,因此说明书限制联合使用。1项对15例异基因造血干细胞移植患者应用伏立康唑和SRL联合治疗的可行性和安全性研究[11]显示,参与者经验上平均减少SRL剂量的33%~50%。只有1例患者获得了较低浓度(12 ng·mL-1)并建议尝试用米卡芬净替代伏立康唑(较少经CYP3A系代谢)或使用低剂量的SRL。目前尚无足够的数据来指导SRL与伏立康唑联用治疗后的经验性减量。所以,两药联用时对SRL进行剂量滴定,开始治疗后进行TDM非常必要[12]。
影响SRS血药浓度变化的原因包括样本、临床和遗传因素。
SRL的血药浓度在初始治疗或调整剂量后的7~10 d达到稳态[13]。推荐的Cmin采血点为下一次口服给药前1 h,若采血点不正确,如在服药后立即采血,则获得的并非Cmin值,可出现浓度值偏高的假象。例1和例2均在治疗7~10 d后进行检测,采血点为当日服药前30 min。目前分析SRL生物样本中血药浓度的方法有免疫法和色谱法(HPLC-MS/MS, WatersXevoTQD),不同方法测得的浓度值结果不可以互换。免疫法对SRL及其代谢产物产生交叉免疫反应,可能使结果产生正偏;而色谱法测定的结果为SRL母体药物浓度,能准确反映患者体内真实的药物浓度[14,15]。免疫法具有高效快速、价格经济的特点,通常临床优先采用[16]。例1和例2采用免疫分析法(Viva-E)检测Cmin,出现异常值后,在同一天使用免疫法对同一样本进行了再次检测,以排除因检测方法引起的数值偏差。
回顾患儿的药物治疗经过及药物相互作用,在药物吸收环节,SRL具有高亲脂性,与禁食状态相比时,给予高脂早餐会导致AUC增加35%[17]。为了使食物对SRL浓度的影响最小化,建议患儿在上午8点时服药并以同一种状态服药,或空腹或在摄入食物后。
SRL在体内95%分布在RBC中,而SRL血药浓度监测中运用干血斑方法,需使SRL从Hb中释放出来,因此,患儿血液中RBC/血浆蛋白比值也会影响患儿的血药浓度[18]。
SRL经CYP3A酶介导代谢过程,本身的量和活性会受到其他药物的影响,环孢素、氮唑类抗菌药物等均会影响其药代动力学[19]。例1开始SRL治疗时,已使用伏立康唑治疗3个月以上(100 mg, q 12 h),药物代谢酶CYP3A4主要被伏立康唑占据。由于酶具有饱和性,在开始SRL治疗后7 d,患儿SRL药物浓度达到危险的高浓度37.8 ng·mL-1,大于治疗范围上限的2倍。
SRL肝脏代谢后,需通过胆汁排泄,若患儿合并梗阻性黄疸、胆结石和胆囊炎等疾病,可使SRL排泄延迟,导致药物蓄积。
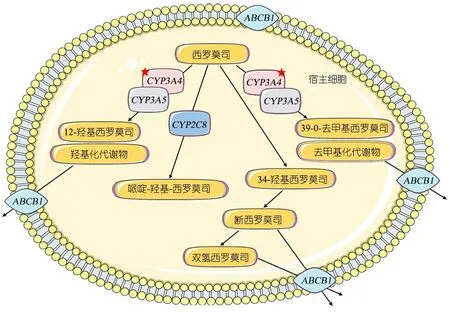
图3 影响SRL体内血药浓度的基因多态性
图3显示,药物基因组学认为药物个体间差异的最关键因素是药物代谢酶、药物转运体及药物靶标的遗传变异。由于编码基因序列的差异[即单核苷酸多态(SNP)],导致个体间药物代谢酶和转运体活性的差异,造成了不同患者对相同药物药代动力学差异[20]。了解患儿的药物代谢酶/转运体基因型,可以在儿童免疫性疾病中检测药物相关基因,在药品选择(规避ADRs、选择敏感性更高的药物)和药品定量(调整剂量)两个环节发挥作用。SRL是CYP450 3A4、3A5和P-糖蛋白(P-gp)的底物[21,22],影响SRL体内过程的药物基因多态性。CYP3A5和ABCB1基因多态性已被证明影响SRL的血药浓度和剂量[23,24]。
研究表明,CYP3A5的变异可以改变血清中活性药物数量。强代谢型只有较少的有效药物可被身体利用,而弱代谢型将提高血药浓度[25]。不同CYP3A5基因型患者血药浓度差异显著,含有CYP3A5*1等位基因患者的SRL血药浓度明显低于*3/*3组(P<0.05),建议当使用基于SRL的治疗时,携带CYP3A5*1等位基因的患者加大SRL剂量以达到足够的血药浓度。例1和例2均为CC基因型,即CYP3A5*3/*3基因型(非表达型)和*1野生型。与基因型CT+TT相比,基因型CC与SRL代谢降低有关,口服清除率明显低于TT或TC型[26,27],因此,CC基因型需要调整为较低的每日剂量,即可达到目标稳定状态的血液浓度。例1(伏立康唑停药后)和例2约减少剂量的50%,便可达到预期治疗浓度。目前,基于CYP3A5药物代谢基因分型与SRL血药浓度的关系的研究并不常见。CYP3A5*3在黑种人中的突变率仅32%,而在高加索人和约旦人中在90%以上[28];在亚洲人群中,中国人的CYP3A5*3突变率为89.1%左右,马来人与印度人均为60%左右。说明SRL对中国儿童可能存在广泛的影响。目前就CYP3A5*3基因型对中国儿童药代动力学影响的相关研究还较少,且主要局限在移植领域,但在基于SRL治疗的患儿中,应重视检测CYP3A5*3的基因型,以指导SRL的精准治疗。
除此之外,还应关注ABCB1基因,也称多药耐药基因 (MDR1),其编码产物为P-gp。P-gp是一种ATP依赖的细胞膜转运蛋白,活性增加时底物将大量被转运至膜外,反之亦然,影响药物的吸收、分布、消除等过程[29]。MDR1基因多态性主要体现在外显子21(G2677T)、26(C3435T)、12(C1236T)[30],3435C>T突变具有重要的功能意义,该突变可导致MDR1的表达量和P-gp功能的明显下降。例2为ABCB1基因rs1045642 T/T型,研究发现ABCB1c.3435 TT基因型患者的环孢素、他克莫司、地高辛的血药浓度也较高[28],推测该位点也作为遗传因素参与了例2血药浓度升高过程。目前PharmGKB (Pharmacogenomics Knowledge Base)对于CYP3A5评级已在Level 2A,说明有中等证据证明位点和用药相关性但对于ABCB1/CYP3A4等的评级在Level 3,说明相关假设尚未开展足够的临床研究与应用,仍需要进一步进行大样本研究验证。
本文讨论了解决SRL浓度变化的临床方案。①样本因素:确认采血点与真实浓度,②临床因素:回顾患儿的药物治疗经过及药物相互作用,③遗传因素:确定患儿的药物代谢酶、转运体、受体靶点基因型。通过对2例患儿的治疗全周期的回顾,提示药物代谢/酶转运体基因型,包括药物相互作用发挥重要的作用。临床方案有助于确定SRL的Cmin异常值的原因,且均应在决定治疗方案调整前加以考虑,优化患儿的SRL综合治疗管理流程。SRL的药物代谢酶、转运体、受体靶点相关SNP位点,是研究的热点,目前较多关注于器官移植后的应用,但是尚未形成定论。随着药理机制研究的深入,SRL不断显示出其在多领域治疗中的潜力。精准医疗的提出和发展,使SRL血药浓度监测的方法得到优化,精确度得到提高,同时临床应用也迫切需要更精准地预测疗效/不良反应、迅速调整患者血药浓度到达治疗范围的技术,比如模型引导的精准用药,基于生理、病理、遗传特征制定给药方案,降低不良反应发生率,使患儿得到更安全、经济的药物治疗。
