不同类型重症肌无力患者的神经电生理特点及临床
2022-12-09刘艳艳陈月秋赵晓丽尹俊雄
刘艳艳,陈月秋,赵晓丽,尹俊雄
重症肌无力(myasthenia gravis,MG)是一种神经肌肉接头功能障碍性疾病[1-2]。根据临床表现可分为以眼外肌麻痹为主的眼肌型MG(ocular myasthenia gravis,OMG)和眼外肌、面部及肢体等全身骨骼肌无力为主的全身型MG(generalized myasthenia gravis,GMG)[3]。近年来相关循证医学证据表明,不同类型的MG患者,不仅其骨骼肌受累范围和病情严重程度不同,其效应分子和抗体类型也存在差异,因而干预后状态亦有不同[4-6]。因此,针对不同类型的MG患者,早期治疗方案的选择及预后评估极其重要。但在临床工作中,各个治疗中心是根据患者年龄、病情程度、进展程度、是否合并胸腺瘤、血清学特点及治疗反应等情况制定个体化治疗方案,目前尚缺乏MG标准治疗方案的多中心随机对照研究证据。因此,本研究回顾性分析了72例MG患者,根据临床分型进行分组比较,旨在分析不同类型MG患者预后的影响因素,为临床医生有效、精准地治疗MG提供一定的思路。
1 对象与方法
1.1 研究对象
收集2018年11月至2020年6月南京医科大学附属脑科医院神经内科疑诊为MG的患者156例的病例资料,根据临床症状、新斯的明试验、神经电生理及MG相关抗体检测进行筛选,最终符合Batocchi诊断标准[7]的患者为72例,根据美国重症肌无力基金会(myasthenia gravis foundation of America, MGFA)临床分型,将72例MG患者分为OMG组及GMG组,其中OMG组患者31例,GMG组患者41例。MG纳入标准:(1)符合MG诊断标准[8],且最终确诊为MG;(2)首次被确诊,未正规治疗;(3)住院期间已完善疲劳试验或新斯的明试验、神经电生理检查、MG相关抗体检测及胸腺影像学(包括纵膈CT或MRI)等检查;(4)所有入组对象均已签署知情同意书。排除标准:(1)有严重心脏、肺部、肝脏及肾脏等基础疾病患者;(2)有其他中枢神经系统疾病、自身免疫性疾病或胸腺疾病以外的肿瘤性疾病患者;(3)随访过程中缺失患者。本研究通过了医院伦理学委员会审查(审批号:2017-KY119-01),所有受试者自愿参与并均签署知情同意书。
1.2 方法
1.2.1 一般资料
收集所有入组患者的基线资料,包括年龄、性别、发病病程、治疗前后改良的美国重症肌无力基金会-疾病严重程度量表(the quantitative MG score of the myasthenia gravis foundation of America,MGFA-QMG)评分、重复神经电刺激阳性部位、是否合并胸腺瘤、MG相关抗体检测类型[包括乙酰胆碱受体(acetylcholine receptor,AchR)抗体、肌肉特异性受体酪氨酸激酶(muscle-specific receptor tyrosine kinase,MuSK)抗体、低密度脂蛋白受体相关蛋白4(low-density lipoprotein receptor-related protein 4,LRP4)抗体及横纹肌抗体、[兰尼碱受体(ryanodine receptor,RyR)抗体、连接素(Titin)抗体]、干预后状态、复发及死亡人数。
1.2.2 治疗方法及抗体检测方法
入组患者均予胆碱酯酶抑制剂加糖皮质激素治疗,部分病情较重患者住院期间加用免疫球蛋白治疗,但所有患者均未使用硫唑嘌呤、环磷酰胺及他克莫司等免疫抑制剂治疗。对明确合并胸腺瘤患者,建议出院后行胸腺切除手术。本研究中AchR抗体的检测:采用放射性免疫沉淀法,通过抗体滴度进行准确定量,滴度<0.50 nmol/L为阴性,滴度≥0.50 nmol/L为阳性;MuSK抗体的检测:采用荧光免疫沉淀法,通过酶标仪读取荧光值来判断结果,红色荧光蛋白为阳性,反之为阴性;LRP4抗体及横纹肌抗体的检测:采用酶联免疫吸附法,通过酶标仪上测492 nm吸光度,以阳性混合血清作为标准血清,大于标准血清吸光度为阳性,反之为阴性。
1.2.3 临床分型和评估方法
根据MGFA临床分型[9],将入组患者分为OMG和GMG(包括Ⅱa型、Ⅱb型、Ⅲ型、Ⅳ型及Ⅴ型);并采用MGFA-QMG对治疗前后MG患者进行病情严重程度的评估。根据MGFA干预后状态分级[8],将完全缓解、药物缓解、微小状态及改善定义为预后良好,将干预后无变化、加重、恶化或死亡定义为预后不良,将原有症状和体征加重或症状改善后再次出现并持续大于24 h定义为复发;恶化是指本已经达到完全缓解、药物缓解或微小状态,又出现了新的临床症状[10]。
1.2.4 神经电生理
所有患者住院期间均行重复神经电刺激(repetitive nerve stimulation,RNS)检查,分别给予尺神经、腋神经及面神经低频(3 Hz、5 Hz)和高频(20 Hz)电刺激,通过肌电图(EMG)记录并计算出复合肌肉动作电位(compound muscle action potentials,CMAP)的波幅递减值;低频RNS结果的判断应为第4或第5波 CMAP波幅和第1波的波幅比,降低15%为阳性或高频第4或第5波之后CMAP波幅和第1波的波幅比降低30%以上定义为RNS异常。
1.2.5 随访和终点事件
在患者出院后第1、3、6及12个月时通过电话或门诊进行随访,随访截止时间为2021年6月。主要终点事件是恶化、复发和死亡;次要终点事件为感染性疾病(如上呼吸道感染、肺部感染及褥疮)。
1.3 统计学方法
2 结果
2.1 基线资料及临床转归
72例MG患者中OMG患者 31例,GMG患者41例。通过比较发现,两组患者RNS均在腋神经刺激时容易出现阳性,且低频RNS阳性率高,但两组比较,差异无统计学意义(P>0.05);与OMG组患者比较, GMG组患者中合并胸腺瘤和单抗体阳性的人数比较多,两组比较差异均有统计学意义(P<0.05)。通过随访,OMG组患者与GMG组患者1年内恶化比例分别为9.7%和17.1%,两组比较差异无统计学意义,但随着病情进展,OMG患者1年内可发展为GMG,且复发风险较高。除此之外, OMG组患者在年龄方面优于GMG组,而在性别、病程及死亡方面比较差异无统计学意义(P>0.05)。结果详见表1。
2.2 短期内随访结果及影响MG干预后状态的多因素分析
入组患者主要终点事件发生率为32%(23例),其中恶化10例(14%),复发7例(10%),死亡6例(8%)。OMG组与GMG组患者随访后的Kaplan-Meier曲线见图1。其中,OMG组主要终点事件发生率为32%(10例),GMG组为32%(13例),两组比较差异无统计学意义(P>0.05)。进一步行多因素回归分析,纳入年龄、性别、神经电生理阳性部位、病程、是否合并胸腺瘤及MG抗体阳性种类作为自变量,预后不良作为因变量,发现合并胸腺瘤、多个抗体阳性是导致MG患者预后不良的危险因素,而病程、年龄、RNS阳性、性别不是MG患者预后不良的相关因素(表2)。入组患者次要终点事件发生率为11%(8例),主要为感染性疾病。

表1 OMG组与GMG组患者基线资料及临床转归分析
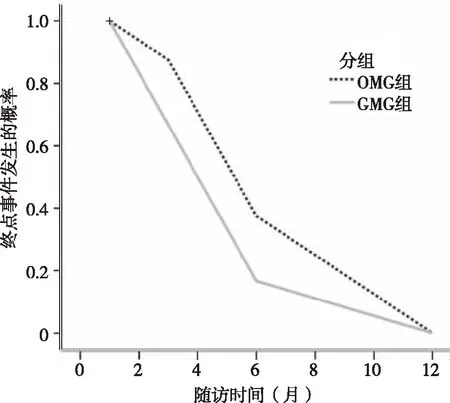
图1 OMG组和GMG组患者随访后主要终点事件的Kaplan-Meier曲线图
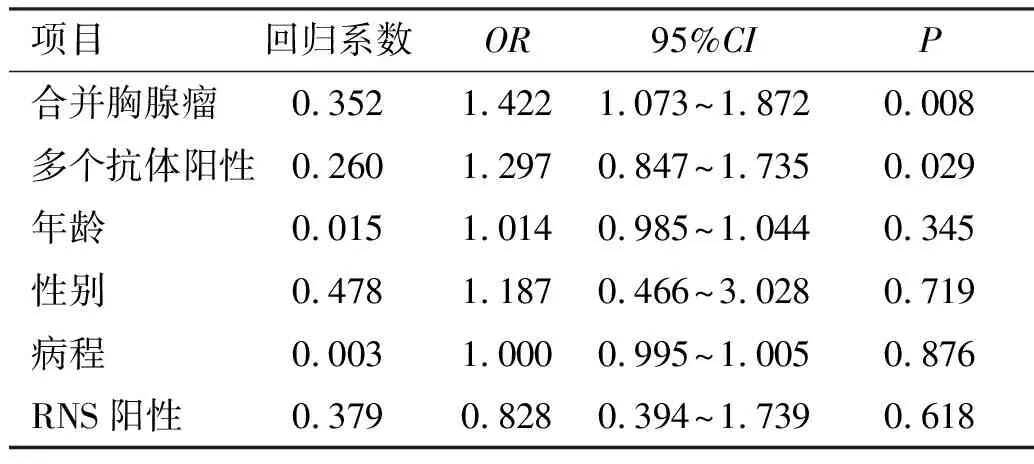
表2 MG患者预后不良的多因素回归分析
3 讨论
MG作为获得性神经肌肉接头相关的自身免疫性疾病,在临床上并不少见。虽然目前治疗方法很多,包括胆碱酯酶抑制剂、糖皮质激素、免疫抑制剂、血浆置换、免疫球蛋白及胸腺切除等,但因其临床异质性较大,所以并不是所有患者都能得到及时有效的、精准化的治疗[12-13]。本研究通过分析影响不同类型MG患者预后的相关因素,旨在为MG患者精准化治疗提供一定的思路。本研究根据MG患者的临床症状,将其分为OMG组和GMG组进行分析,结果显示相较于OMG患者,GMG患者不仅年龄大,还常合并单抗体阳性,多伴胸腺瘤,且经激素和胆碱酯酶抑制剂干预后易出现进展。进一步随访发现,两组间恶化及死亡发生率比较无差异。行多因素回归分析导致MG患者预后不良的危险因素发现,胸腺瘤、多个MG抗体阳性是MG患者预后不良的独立危险因素,而病程、年龄、性别、RNS阳性不是MG患者预后不良的相关因素。
最新流行病学显示,全球MG年发病率约为(4~10)/百万,我国约为0.68/10万,且我国高峰期逐渐向50岁和70岁左右人群倾斜[14-15]。本研究结果与之一致,不管是OMG患者还是GMG患者,发病年龄均在50岁左右。与以往研究结果不同的是,本研究发现,与OMG患者相比,GMG患者年龄更大,这可能与样本量小,存在选择偏倚有关。此外,本研究还发现,与OMG患者相比,GMG患者多伴有胸腺瘤和单抗体阳性。这可能与OMG患者AchR抗原区低暴露导致血清缺乏相应抗体或相应抗体浓度较低,从而未检测出有关[16]。其次,可能与发病机制不同有关。既往研究发现[17],非胸腺瘤的MG患者胸腺组织可分泌大量趋化因子和炎症细胞,进而打破淋巴滤泡B细胞区的微环境,并刺激静止的初始B细胞局部增殖克隆,从而形成典型的生发中心,产生自身抗体,导致MG发病。而伴有胸腺瘤的MG患者,其胸腺组织不仅缺乏正常的髓质及生发中心,且皮髓质结构已紊乱,仅保留了胸腺皮质上皮细胞的部分功能,所以导致阳性选择作用缺乏,使T细胞发育异常,形成缺陷的CD+4/CD+8双阳性T细胞。而缺陷的CD+4/CD+8双阳性T细胞又可迁移至外周,形成自身反应性T细胞。其中自身反应性T细胞就包括了AchR抗原、Titin抗原及RyR抗原,然后这些抗原通过刺激外周淋巴系统辅助B细胞,产生自身反应性抗体,最终导致MG的发病[11,18-19]。因此,合并胸腺瘤的GMG患者,抗体阳性率高,且存在除AchR抗体阳性外的其他抗体阳性,如连接素Titin抗体及RyR抗体。除此之外,通过本研究发现,对于伴有胸腺瘤、MG相关抗体阳性的GMG患者需择期行胸腺切除手术,而对于药物治疗效果不佳的OMG患者也可能从胸腺切除术中获益。
本研究通过跟踪随访,结合K-M生存曲线发现,MG患者主要终点事件发生率为32%,其中恶化发生率为14%,复发率为10%,死亡发生率为8%,OMG组与GMG组各时间点比较,差异无统计学意义。这可能与MG发病机制不仅有体液免疫参与,还有细胞免疫的参与有关。既往大量研究显示,各种辅助性T细胞及其细胞因子不仅参与形成异位生发中心,导致免疫失调,引发自身免疫疾病,还可不断诱导炎症反应,加重组织损伤,导致MG患者的病情恶化[20]。因而相较于正常人,MG患者更易出现感染性疾病,且不管是OMG患者还是GMG患者,因其本身免疫系统存在异常,体内炎症介质不断释放,组织损伤会加重,所以病情会持续恶化。本研究通过多因素回归分析,纳入年龄、性别、神经电生理阳性部位、病程、是否合并胸腺瘤及MG抗体阳性类型等多因素发现,胸腺瘤、多个抗体阳性是导致MG患者预后不良的危险因素,而病程、年龄、性别及RNS阳性不是MG患者预后不良的相关因素。有研究表明,80%的MG患者合并胸腺异常,包括胸腺增生及胸腺瘤,而大多数合并胸腺瘤的MG患者除可检测出AchR抗体外,还可检测出Titin抗体和RyR抗体,且病情重,容易出现恶化,预后差,切除胸腺瘤后仍需要长程免疫抑制剂治疗[8,21]。
本研究尚存在许多不足,首先它是单中心、小样本的回顾性研究,随访时间较短。其次,本研究未对不同类型MG抗体进行亚组分析,且MG抗体检测方法相对单一,敏感性低。而且对于MG患者的治疗,也未采用最新免疫抑制剂治疗,因而对干预后的状态也是有影响的。但以上不足将在后期的研究中得到解决;同时,本研究缺乏对出院后MG患者病情严重程度的量化评估,未行MGFA评估,这些也将在后期的研究中进一步完善。
