黄瓜YABBYs家族及CsYAB1a基因功能初探
2022-11-07程志华张小兰赵剑宇
应 奥 程志华 张小兰 赵剑宇
(中国农业大学 园艺学院/设施蔬菜生长发育调控北京市重点实验室,北京 100193)
黄瓜(Cucumis
sativus
L.)是世界广泛种植的蔬菜作物,属葫芦科黄瓜属1年生草本植物。我国是世界第一大黄瓜生产国和消费国,据FAO数据统计显示,2020年我国黄瓜产量达到7 336万t,占世界总产量的81.2%。黄瓜产量与其花及果实发育过程息息相关。研究表明,种子植物中特有的YABBYs
家族在开花植物的营养生长和生殖生长中发挥重要作用。迄今为止,YABBYs
家族成员已在番茄(Solanum
lycopersicum
L.)、水稻(Oryza
sativa
L.)、小白菜(Brassica
rapa
ssp.chinensis
)、葡萄(Vitis
pseudoreticulata
andVitis
vinifera
L.)、棉花(Gossypium
hirsutum
L.)、玉米(Zea
mays
L.)、白菜(Brassica
campestris
L. ssp.chinensis
var.parachinensis
)和小麦(Triticum
aestivum
L.)等多个物种中被鉴定和研究。黄瓜CsYAB5
和CsCRC
基因分别被报道参与黄瓜的维管模式和形态建成以及果实长度的调控,然而除此之外针对黄瓜YABBYs
家族其他成员的研究报道相对较少。因此,鉴定黄瓜YABBYs
家族成员并探究它们调控黄瓜生长发育的分子机制具有重要意义。YABBY
基因是植物特有的一类转录因子,属于锌指蛋白家族,由2个高度保守的结构域组成:N端C2C2锌指结构域和C端螺旋-环-螺旋(Helix-loop-helix)结构域(称为YABBY结构域)。根据进化关系,它们被分为5个亚家族:CRABS CLAW (CRC)、FILAMENTOUS FLOWER(FIL,又名YABBY1)/YABBY3(YAB3)、INNER NO OUTER(INO,又名YABBY4)、YABBY2(YAB2)和YABBY5(YAB5)。YAB1和YAB3可能源于1次基因复制事件,同属1个亚家族。5个亚家族在早期被子植物类群(即ANA:无油樟目(Amborellales)、睡莲目(Nymphaeales)和木兰藤目(Austrobaileyales))的出现表明开花植物的共同祖先至少含有5个YABBYs
基因。拟南芥(Arabidopsis
thaliana
)的YABBYs
家族包含6个成员:CRC
、YAB4
、YAB1
、YAB3
、YAB2
和YAB5
基因。YAB1
、YAB2
、YAB3
和YAB5
基因是“营养YABBYs
基因”,主要参与侧生器官的极性发育、边缘的形成、叶片的成熟和茎尖分生组织的发育并且调控叶序性;CRC
和YAB4
基因是“生殖YABBYs
基因”,分别在发育中的心皮和胚珠外珠被特异表达。YABBYs
家族参与胁迫响应、叶缘和近轴极性的建立以及器官发育等过程的调控。黄瓜YABBYs
家族的CsYAB5
基因在叶片、花瓣和雄蕊原基的远轴端以及叶脉维管组织表达,调控黄瓜的维管模式和形态建成过程;而CsCRC
基因在心皮和蜜腺的整个发育过程中在远轴端持续表达,参与调控黄瓜果实的伸长。番茄和金鱼草(Antirrhinum
majus
L.)的YABBY
基因与拟南芥YABBY
基因的功能类似,但一些单子叶植物(例如玉米和水稻)的YABBY
基因不能参与极性调控,与拟南芥YABBY
基因的功能差异较大。例如,AtYAB2
和AtCRC
的水稻同源基因OsYAB1
和DROOPING
LEAF
(DL
)在花器官未表现出极性表达模式。除了影响器官发育,YABBY
基因还参与胁迫反应的调控。例如,菠萝(Ananas
comosus
)AcYAB4
基因参与植物耐盐性的调控,大豆(Glycine
max
)GmYAB10
基因与高盐和干旱胁迫有关,南瓜(Cucurbita
moschata
)YABBY
基因对盐胁迫处理有响应。此外,YABBY
基因还受到生长素和赤霉素等激素的调控。本研究以黄瓜YABBYs
家族成员为切入点,通过同源比对、理化性质统计、系统进化树构建、染色体位置绘制、基因结构分析和时空表达分析等方法,旨在对黄瓜YABBY
s基因进行鉴定和分析,同时结合异源转化拟南芥试验,以期对CsYAB1a
基因的生物功能进行初步探究,为进一步在黄瓜中进行深入研究提供理论基础。1 材料与方法
1.1 试验材料
1
.1
.1
植物材料以黄瓜高代自交系品种‘新泰密刺’为试验材料。55~60 ℃温汤浸种30 min后,将充分泡胀的种子均匀摆放在事先铺在培养皿内的湿润滤纸上,于28 ℃暗培养催芽24~36 h,期间保持滤纸湿润。选择下胚轴1~3 cm长的种子播种于营养钵,置于24 ℃光照培养室中生长(16 h光照/8 h黑暗),待黄瓜幼苗长至两叶一心后定植于温室。黄瓜材料用于RNA提取实验和原位杂交实验,分别用液氮和Formalin-Aceto-Alcohol(FAA)固定液保存,置于-80和4 ℃保存备用。
以Columbia
(Col
)生态型拟南芥为试验材料。4 ℃黑暗春化处理3 d后,在超净台中用体积比为3%的次氯酸钠水溶液消毒,播种于Murashige and Skoog(MS)固体培养基,置于24 ℃光照培养室中生长(16 h光照/8 h黑暗)。约10 d后,待其长出2片真叶后移栽到土壤培养基质(m
(草炭)∶m
(蛭石)≈1∶1)进行后续试验。1
.1
.2
试剂与菌株定量实验试剂:EastepSuper总RNA提取试剂盒(目录号:LS1040)购于普洛麦格(北京)生物技术有限公司,FastKing一步法除基因组cDNA第一链合成预混试剂(目录号:KR118)购于天根生化科技(北京)有限公司,TB GreenPremix Ex TaqII (Tli RNaseH Plus) (目录号:RR820A)购于宝日医生物技术(北京)有限公司。
构建载体试剂:质粒小提试剂盒(离心柱型)(目录号:DP103)购于天根生化科技(北京)有限公司,限制性内切酶XbaI和BamHI购于NEB(北京)有限公司,2×PhantaMax Master Mix (Dye Plus)(目录号:P525)、FastPureGel DNA Extraction Mini Kit(产品目录号:DC301)和ClonExpressMultiS One Step Cloning Kit(产品目录号:C113)购于南京诺唯赞生物科技股份有限公司,2×Es Taq MasterMix (Dye)(目录号:CW0690)购于康为世纪生物科技股份有限公司。
原位杂交试剂:DIG RNA Labeling Kit (SP6/T7)购于上海罗氏制药有限公司。
载体和感受态细胞:双元植物农杆菌表达载体pBI121为本实验室保存,DH5α Chemically Competent Cell(目录号:KTSM101L)购于深圳康体生命科技有限公司,GV3101根癌农杆菌感受态细胞(目录号:ZC141)购于北京庄盟国际生物基因科技有限公司。
1.2 试验方法
1
.2
.1
黄瓜YABBYs
基因的鉴定分别在拟南芥基因库TAIR(https:∥www.arabidopsis.org/)和黄瓜基因库CuGenDB(http:∥cucurbitgenomics.org/)查找并保存拟南芥和黄瓜YABBYs
家族全部成员的基因组、CDS、氨基酸序列、黄瓜7条染色体长度以及黄瓜YABBYs
家族成员在染色体的位置信息用于后续分析(表1)。利用黄瓜基因库的BLAST工具(http:∥cucurbitgenomics.org/blast)进行BLASTp比对,筛选标准为E
-value1
.2
.2
拟南芥和黄瓜YABBYs
基因的分析利用ExPaSy的ProtParam工具(https:∥web.expasy.org/protparam/)分析基因的理化性质,利用软件MEGAX构建家族进化树。其中,通过Clustal W工具进行多序列比对,采用NJ邻接法Bootstrap重复1 000次;利用Gene Structure Display Serve 2.0(http:∥gsds.gao-lab.org/)分析基因结构;利用UGENE软件分析保守结构域,将氨基酸多序列比对结果修剪整齐后上传MEME(http:∥meme-suite.org)分析保守基序;通过MG2C_v2.1(http:∥mg2c.iask.in/mg2c_v2.1/)绘制基因在染色体上的位置。
1
.2
.3
黄瓜YABBY基因家族成员的表达分析使用RNA提取试剂盒和反转录试剂盒提取黄瓜各部位RNA并将其反转录为单链cDNA,RNA和cDNA分别置于-80和-20 ℃保存备用(实验步骤见产品说明书)。使用TB Green酶,通过实时荧光定量PCR检测基因表达情况。黄瓜样品内参基因为Ubiquitin
extension
protein
(UBI
),拟南芥样品内参基因为ACTIN2
。利用NCBI的Primer designing工具(https:∥www.ncbi.nlm.nih.gov/tools/primer-blast/)设计荧光定量引物。通过2法计算基因相对表达量。本试验采用3次技术重复,3次生物学重复(引物序列见表2)。1
.2
.4
黄瓜CsYAB1a
基因的原位杂交实验取黄瓜样品置于3.7% FAA固定液中4 ℃保
表1 本研究所涉及基因的信息
Table 1 Gene information used in this study
基因Gene name物种Species基因号LocusCsYAB1aCucumis sativusCsaV3_5G003950CsYAB1bCucumis sativusCsaV3_3G003040CsYAB2Cucumis sativusCsaV3_6G038650CsYAB4aCucumis sativusCsaV3_5G031440CsYAB4bCucumis sativusCsaV3_2G024750CsYAB5aCucumis sativusCsaV3_2G002960CsYAB5bCucumis sativusCsaV3_1G030340CsCRCCucumis sativusCsaV3_5G033400UBICucumis sativusCsaV3_5G031430AtYAB1Arabidopsis thalianaAT2G45190AtYAB2Arabidopsis thalianaAT1G08465AtYAB3Arabidopsis thalianaAT4G00180AtYAB4Arabidopsis thalianaAT1G23420AtYAB5Arabidopsis thalianaAT2G26580AtCRCArabidopsis thalianaAT1G69180AtAGArabidopsis thalianaAT4G18960AtALCArabidopsis thalianaAT5G67110AtAP1Arabidopsis thalianaAT1G69120AtAP3Arabidopsis thalianaAT3G54340AtAS1Arabidopsis thalianaAT2G37630AtAS2Arabidopsis thalianaAT1G65620AtCALArabidopsis thalianaAT1G26310AtCLV3Arabidopsis thalianaAT2G27250AtFTArabidopsis thalianaAT1G65480AtFULArabidopsis thalianaAT5G60910AtHANArabidopsis thalianaAT3G50870AtHEC3Arabidopsis thalianaAT5G09750AtINDArabidopsis thalianaAT4G00120AtKAN1Arabidopsis thalianaAT5G16560AtKAN2Arabidopsis thalianaAT1G32240AtLFYArabidopsis thalianaAT5G61850AtPIArabidopsis thalianaAT5G20240AtSHP1Arabidopsis thalianaAT3G58780AtSHP2Arabidopsis thalianaAT2G42830AtSPLArabidopsis thalianaAT4G27330AtSPTArabidopsis thalianaAT4G36930AtSUPArabidopsis thalianaAT3G23130AtTFL1Arabidopsis thalianaAT5G03840AtWOX1Arabidopsis thalianaAT3G18010AtWUSArabidopsis thalianaAT2G17950AtYUC11Arabidopsis thalianaAT1G21430ACTIN2Arabidopsis thalianaAT3G18780
存,用曙红染色,依次将样品浸泡在FAA水溶液、酒精梯度、二甲苯和石蜡中,最终用石蜡包埋。将石蜡块切成10 μm的切片,在37 ℃水中展片,42 ℃过夜烘片,烘干的石蜡切片4 ℃保存备用。
从CsYAB1a
基因组序列中选取1段约500 bp的特异片段,以此设计引物CsYAB1a
-probe-F/R。以cDNA为模版,使用Taq酶进行PCR扩增。通过电泳检测PCR扩增产物,使用胶回收试剂盒进行产物回收。以回收产物为模版,使用引物CsYAB1a
-SP6和CsYAB1a
-T7为其加上SP6和T7 酶切位点。将扩增产物跑胶验证后回收,回收产物即为探针模版。使用地高辛RNA标记试剂盒合成探针,SP6 探针作为负对照。将石蜡切片依次进行脱蜡、去蛋白、乙酰化和脱水处理后,敷探针50 ℃过夜,使探针与目的片段结合。洗去探针,封闭处理后与抗体共孵育,最后洗去抗体。在避光情况下,使用5-Bromo-4-chloro-3-indolyl phosphate(BCIP)和Nitro blue tetrazolium chloride(NBT)染色处理,3 d后用显微镜观察样品组织染色情况。样品组织的识别参照Bai等,原位杂交实验参照Zhang等。
1
.2
.5
黄瓜CsYAB1a
基因的克隆使用基因克隆引物CsYAB1a
-clone-F/R克隆CsYAB1a
基因CDS序列全长,跑胶验证后回收。回收产物命名为CsYAB1a
-clone,置于-20 ℃保存备用。1
.2
.6
黄瓜CsYAB1a
基因过表达载体的构建及拟南芥遗传转化使用质粒提取试剂盒从大肠杆菌中提取双元植物农杆菌表达载体pBI121质粒,使用限制性内切酶XbaI和BamHI对pBI121进行双酶切。以胶回收产物CsYAB1a
-clone为模版,使用引物CsYAB1a
-clone-XbaI-F和CsYAB1a
-clone-BamHI-R为基因的CDS序列添加同源臂接头。使用同源重组酶将切开的载体和带有同源臂接头的基因片段进行同源重组,将产物转化至DH5α大肠杆菌感受态。筛选阳性克隆送至生工生物工程股份有限公司测序,测序引物为载体35S启动子上特异片段35S-F和CsYAB1a
-clone-R。将返还的测序正确的CsYAB1a
-OX质粒转化至GV3101根癌农杆菌感受态细胞。通过农杆菌蘸花法遗传转化拟南芥。1
.2
.7
转基因拟南芥阳性植株的筛选与鉴定收获农杆菌侵染的拟南芥T代植株种子,使用含40 mg/L硫酸卡那霉素的MS固体培养基进行筛选。提取T代拟南芥叶片DNA进行PCR鉴定,鉴定引物为35S-F和CsYAB1a
-clone-R。对表型发生变化的阳性转基因拟南芥植株进行单株收种,再次播种后即为T代转基因株系。对其进行表型观察和表达分析。表2 本研究所使用的引物序列
Table 2 Primer sequences used in this study
引物用途Purposes ofprimers名称Name序列(5′→3′)Sequence (5′→3′)CsYAB1a-clone-FATGTCATCATCTTCTTGCTCATCCsYAB1a-clone-RTTAGAAATGGGAGACACCAACA克隆CsYAB1a基因CloningCsYAB1a gene CsYAB1a-clone-XbaI-FGAGAACACGGGGGACTCTAGAATGTCATCATCTTCTTGCTCATCCsYAB1a-clone-BamHI-RGGACTGACCACCCGGGGATCCTTAGAAATGGGAGACACCAACA35S-FGTAAGGGATGACGCACAATCqCsYAB1a-FTGATGAGCTCCCTAGGCCACqCsYAB1a-RCTTAGCAGCGGCACTGAAGGqCsYAB1b-FACTGGGCTCATTTCCCTCACAqCsYAB1b-RTTCTCTCCCCCTTGTTGCCCqCsYAB2-FAGAAGCCTTTAGCACAGCAGCqCsYAB2-RGGTGGCAGAAACCCATTGGAGqCsYAB4a-FCCATCTCTTTGATCTGCCCGAqCsYAB4a-RGACTCGAGCAATGGCCACAC黄瓜荧光定量RT-qPCRin cucumberqCsYAB4b-FCCCGGAGAAGAAACAGCGAGqCsYAB4b-RCTCCTTCAGCATTGACTGGCGqCsYAB5a-FACCCACAGGGAAGCCTTCAGqCsYAB5a-RCTCAGATCCATCATTCTTACTCTGCqCsYAB5b-FGGGAAGCATTCAGTACGGCAGqCsYAB5b-RAGCCCTTGGCATTAAACGCTqCsCRC-FTCGAAAGGGTGCTTCCACATCTqCsCRC-RTCTGGGTTTGCAGCTTTGATACGqUBI-FCACCAAGCCCAAGAAGATCqUBI-RTAAACCTAATCACCACCAGCqCsYAB1a-FTGATGAGCTCCCTAGGCCACqCsYAB1a-RCTTAGCAGCGGCACTGAAGGqAtAG-FATAATCAGCATACAAAACTCCAACqAtAG-RATACTTCTCTCTAATCTGCCTTCCqAtALC-FTCCAGACTTTAGCCGTTATGAATGqAtALC-RAGCACATTCCTTGACTTGTTTTAGqAtAP1-FGTTGCTCTTGTTGTCTTCTCCCqAtAP1-RCTCCATCGACCAGTTTGTATTGqAtAP3-FTATTTCTGATGTCGATGTTTGGGCqAtAP3-RACTTTTGTTCTTTTTCTTGGTGGTqAtAS1-FCAGAGGAAGAGCAGAGGCTTGqAtAS1-RCTTCCCACCACTTCCCTAACCqAtAS2-FTGCGCCGCTTGCAAATqAtAS2-RAAATAGGGCGCGAATACACATTqAtCAL-FGGAGAGAAACCAAAGGCATTATCqAtCAL-RTCCTTTCTTTGGAGGTGGTTGAqAtCLV3-FATGGAGAAGCAGAGAAGGCAAAqAtCLV3-RGGGTTCACATGATGGTGCAAqAtCRC-FCTCTCGTTTCTCACCACAACTC
表2(续)
引物用途Purposes ofprimers名称Name序列(5′→3′)Sequence (5′→3′)qAtCRC-RGCTTCTTCTCAGGAGGTTTGACqAtFT-FAACCCTCACCTCCGAGAATATCqAtFT-RTGCCAAGCTGTCGAAACAATATqAtFUL-FAAGAAAGAACCAAGCTATGTTCGqAtFUL-RGGAGGTTACGCAGTATTGAGGCqAtHAN-FTCTCCGCTAACAAGCCAAGTqAtHAN-RGAGCCCACGGAGTACCATTAqAtHEC3-FAGGGAAATGAGAAGAAGAGAAAGGqAtHEC3-RATGAATAATTATAATATGAACCCATCTC拟南芥荧光定量RT-qPCRin ArabidopsisqAtIND-FAAGATCCGAATTCTCAAGAGGATCqAtIND-RAGGGTTGGGAGTTGTGGTAATAAqAtKAN1-FGATCCAGCATTCAAAATCAGGqAtKAN1-RTCCAAATTGATCAAGAAAGTCAqAtKAN2-FTTTGCATGGGAAGTTAATCGqAtKAN2-RTTGTTCCCGAGATGCTTGATqAtLFY-FCATATCTTTCGTTGGGAGCTTCTTGqAtLFY-RCTGAATACTTGGTTCGTCACCTTGqAtPI-FCTTACAACTGGAGCTCAGGCAqAtPI-RGCTCGAGATTAAGACACACAGqAtSHP1-FATACAAGGGACGACAGTTTACGAAqAtSHP1-RCACAAGTTGAAGAGGAGGTTGGTqAtSHP2-FTCTCCGCTCCAAGATTACTGAAqAtSHP2-RCCGACTGGTGAGAAGAAGTAACAqAtSPL-FCTTGGGAAGCCTTGTAGCACqAtSPL-RAGCTCGAGCGTCAGAGAATCqAtSPT-FTCACTTTGGACCTTTCCCTCTCqAtSPT-RCTTTTAGGTCAGGTTGTCCATCqAtSUP-FTTTCTCCTCCATCCTCACCAAGqAtSUP-RTAATCAAACCAATCTCAAGCTCqAtTFL1-FGCTCTTTCCTTCTTCTGTTTCCTCCqAtTFL1-RCAGCGGTTTCTCTTTGTGCGTqAtWOX1-FCTGGATATGTTCGGTCGGATGqAtWOX1-RCTCCACCCGTATATTCGCTGqAtWUS-FGGCTGAGACAGTTCGGAAAGATTqAtWUS-RAGTTGGGTGATGAAGATGGTGTGqAtYUC11-FGGAAACACCAAAAATGTGGACTCqAtYUC11-RACCATTCTTCCCCTTCCAGTGqACTIN2-FCCTTCGTCTTGATCTTGCGGqACTIN2-RAGCGATGGCTGGAACAGAACCsYAB1a-probe-FCAATAGATGATCCAATATTATTCAAAA克隆原位杂交探针Cloning probesused for in situhybridizationCsYAB1a-probe-RGTTATGAGAAGGAGAAAAGAAAGAATCsYAB1a-SP6GATTTAGGTGACACTATAGAATGCTCAATAGATGATCCAATATTATTCsYAB1a-T7TGTAATACGACTCACTATAGGGGTTATGAGAAGGAGAAAAGAAA
1
.2
.8
黄瓜YABBYs
基因启动子的响应元件分析与外源激素喷施处理在黄瓜基因组文件(从黄瓜基因库CuGenDB下载)找到各基因的启动子序列(ATG前3 kb序列),通过PlantCARE网站(http:∥bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析激素响应元件。对黄瓜雌花芽进行外源激素喷施处理,共分为3组:脱落酸组(200 mg/L)、生长素组(50 mg/L)和空白对照组(CK)。向各组添加体积比为0.5%的表面活性剂吐温20以促进喷施液的附着。喷施前及喷施后1、3、6、12、24和48 h取雌花芽用于检测基因表达量的变化。激素处理实验参照Cheng等。
2 结果与分析
2.1 黄瓜YABBYs家族成员鉴定
将拟南芥YABBYs
家族6个成员的蛋白质序列在黄瓜基因组库中进行BLASTp比对,获得8个黄瓜YABBYs
家族成员。将这8个基因在拟南芥数据库进行反向BLASTp比对,根据蛋白相似度依次命名。利用NCBI的Conserved domain search工具确定黄瓜YABBYs
家族成员均含有YABBY超家族结构域。统计黄瓜YABBYs蛋白的理化性质,结果如表3所示。基因等电点集中在7.15~9.51,即黄瓜YABBYs蛋白分子或者表面不带电荷时pH>7;脂肪族氨基酸系数集中在60.23~81.14;亲水系数均<0,表明黄瓜YABBYs蛋白全部为亲水蛋白。表3 黄瓜基因的基本信息
Table 3 Basic information on genes
基因名称Gene name基因号Locus氨基酸数目/aaNumber ofaminoacids分子量Molecularweight等电点TheoreticalpI脂肪族指数Aliphaticindex亲水系数Grand average ofhydropathicity(GRAVY)CsYAB1aCsaV3_5G00395024827 424.928.6667.98-0.408CsYAB1bCsaV3_3G00304018520 590.388.8565.89-0.394CsYAB2CsaV3_6G03865017319 261.859.5165.95-0.609CsYAB4aCsaV3_5G03144021424 622.287.1572.85-0.357CsYAB4bCsaV3_2G02475035239 477.619.3881.14-0.496CsYAB5aCsaV3_2G00296019221 526.248.8867.60-0.542CsYAB5bCsaV3_1G03034019321 678.747.5677.82-0.264CsCRCCsaV3_5G03340017519 293.618.7160.23-0.550
2.2 黄瓜YABBYs基因结构及进化分析
构建拟南芥和黄瓜YABBYs
家族进化树并分析基因结构(图1),14个基因被划分为5个亚家族,依次为:YAB1/YAB3、YAB5、YAB2、CRC和YAB4。每个基因包含6~7个外显子。以上结果表明,黄瓜和拟南芥YABBYs
基因在基因结构和进化关系上具有相似性和保守性。2.3 黄瓜YABBYs基因结构域及保守氨基酸分析
黄瓜YABBYs
家族的8个成员均含有YABBY超家族结构域,它由C2C2锌指结构域和YABBY结构域组成(图2(a))。其中C2C2锌指结构域(图2(b))由半胱氨酸、缬氨酸和亮氨酸等保守氨基酸组成,YABBY结构域(图2(c))由脯氨酸、丙氨酸、谷氨酸、天冬氨酸和赖氨酸等保守氨基酸组成。说明黄瓜YABBYs
基因在蛋白结构上比较保守,可能和其他物种的YABBYs
基因有相似的生物学功能。2.4 黄瓜YABBYs基因染色体定位
8个黄瓜YABBYs
基因分布在5条染色体上。5号染色体上包含的基因最多,为3个,分别为CsYAB1a
、CsYAB4a
和CsCRC
;1、3和6号染色体上均只包含1个基因,分别为CsYAB5b
、CsYAB1b
和CsYAB2
(图3)。
红色三角形和绿色圆形分别代表来自黄瓜和拟南芥中的YABBYs基因。 Red triangles and green circles represent YABBYs gene from cucumber and Arabidopsis, respectively.图1 黄瓜和拟南芥YABBYs基因的进化分析和结构分析Fig.1 Evolutionary and structural analyses of YABBYs gene in cucumber and Arabidopsis

(a)黄瓜YABBYs基因的氨基酸序列比对结果;(b)C2C2锌指结构域;(c)YABBY结构域。相同或相似的氨基酸用深或浅紫色表示,C2C2锌指结构域和YABBY结构域用黑色框标出,C2C2锌指结构域中的典型氨基酸残基用红色星号表示。(a) Amino acid sequence alignment results of CsYABBYs genes; (b) C2C2 zinc finger domain; (c) YABBY domain. The same or similar amino acids were shown in dark or light purple, the C2C2 zinc finger domain and the YABBY domain were marked in black boxes, and typical amino acid residues within the C2C2 domain were indicated with red asterisks.图2 黄瓜YABBYs基因的氨基酸序列比对Fig.2 Alignment of amino acid sequences of CsYABBYs gene
2.5 黄瓜YABBYs基因表达模式分析
为探究8个YABBYs
基因在黄瓜不同组织部位的表达情况,本研究通过实时荧光定量技术对黄瓜幼嫩的茎、叶、雄花芽、雌花芽、雄花、雌花和开花当天子房共7个部位进行表达量检测(图4)。结果表明,黄瓜YABBYs
基因均能在生殖器官中检测到表达。其中,拟南芥中2个生殖YABBYs
基因的黄瓜同源基因CsYAB4a
、CsYAB4b
以及CsCRC
分别在子房或花芽特异表达;5个营养YABBYs
基因的黄瓜同源基因则在7个部位中几乎均能检测到表达;而拟南芥中参与果实开裂过程的FIL
基因的黄瓜同源基因CsYAB1a
主要在花芽、叶片和子房中表达。根据上述结果推测,黄瓜YABBYs
基因可能会影响黄瓜的生殖发育过程。
图3 黄瓜YABBYs基因的染色体定位Fig.3 Chromosomal mapping of CsYABBYs genes

MFB:各种大小混合的雄花芽;FFB:肉眼可见的雌花芽;MF:开花当天的雄花;FF:开花当天的雌花;Ovary:开花当天的雌花子房。误差线为技术学重复间的标准差。 MFB: Male flower buds of various sizes mixed; FFB: Female flower buds visible to the naked eye; MF: Male flowers on the day of flowering; FF: Female flowers on the day of flowering; Ovary: Ovaries of female flowers on the day of flowering. The error line was the standard deviation between technical repetitions.图4 黄瓜YABBYs基因在不同部位的表达情况Fig.4 Expression of CsYABBYs genes in different tissues
2.6 黄瓜CsYAB1a基因时空表达模式分析
荧光定量结果表明,CsYAB1a
基因主要在花芽、叶片和子房中表达(图4(a))。通过原位杂交技术对CsYAB1a
基因的时空表达模式进行探究发现,CsYAB1a
基因在花原基远轴端(图5(a)和(b))、雌雄花芽的花瓣原基(图5(c)和(e)~(f’)),以及雌花芽的子房外果皮(图5(f)和(f”))有较强富集。上述结果表明,CsYAB1a
基因可能参与花和果实的发育调控。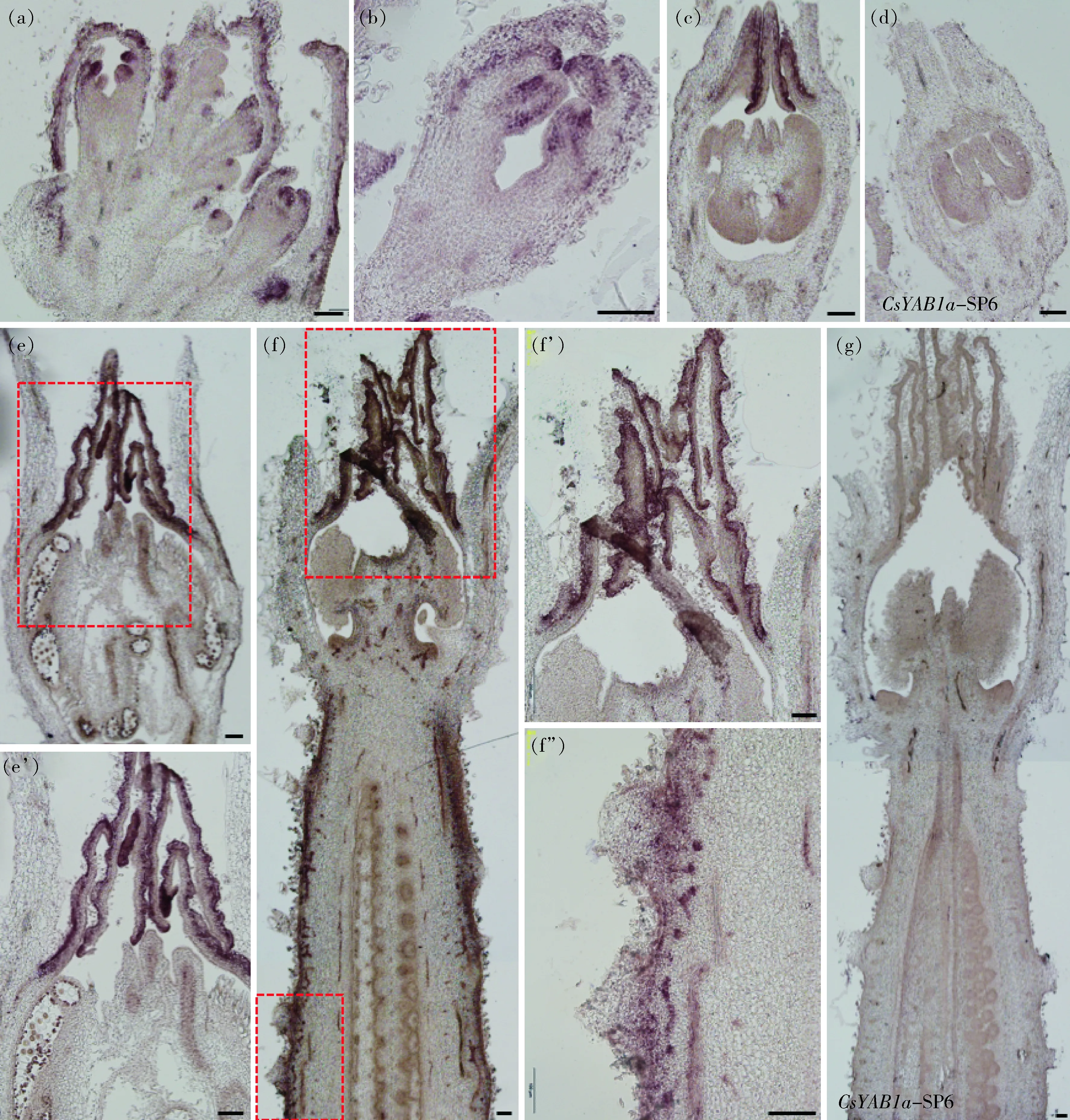
(a)~(b)顶点的花原基;(c)早期雄花芽的花瓣原基;(e)~(e’)雄花芽的花瓣原基;(f)~(f”)雌花芽的花瓣原基和子房外果皮。(e’)、(f’)和(f”)分别为(e)和(f)中红虚线框的放大图;(d)和(g)SP6负对照。标尺=100 μm。(a)-(b) Floral primordium of tips; (c) Petal primordium of early male flower buds; (e)-(e’) Petal primordium of male flower buds; (f)-(f”) Petal primordium and the ovary exocarp of female flower bud. (e’), (f’) and (f”) The enlarged images of the red dotted line box in (e) and (f), respectively; (d) and (g) SP6 were negative control. Scale bars=100 μm.图5 CsYAB1a基因在顶点和花芽的时空表达模式Fig.5 Spatio-temporal expression patterns of CsYAB1a gene at tips and flower buds
2.7 35S::CsYAB1a异源过表达拟南芥表型鉴定及分析
为深入研究CsYAB1a
基因的生物学功能,本研究构建了35S
::CsYAB1a
过表达载体,转化至野生型拟南芥Col
中进行异源过表达,最终筛选得到了8个表型发生明显变化的T代株系(标记为#1~#8),挑选代表性株系#4、#2和#5进行后续取样鉴定和表型数据的统计分析。荧光定量结果显示CsYAB1a
基因在黄瓜花芽和叶片中均有较高的表达水平(图4(a))。因此,本研究检测了CsYAB1a
基因在野生型和转基因拟南芥的茎尖分生组织(SAM)和幼嫩莲座叶的表达水平。结果表明,CsYAB1a
基因在过表达拟南芥的SAM和叶片中均有表达,且在#4、#2和#5株系中表达量依次升高。与此同时,过表达拟南芥的莲座叶、花和果实均出现了显著的表型变化。例如:莲座叶由野生型的椭圆形变为披针形叶(叶形指数=叶长/叶宽>3),过表达拟南芥的莲座叶更为细长(平均长宽分别为野生型的0.6和0.4倍),同时叶片向远轴端(叶背面)卷曲(图6(a))。此外,过表达拟南芥的总状花序包含更多的花(图6(b))。
(a)莲座叶表型;(b)总状花序表型。(a)标尺=1 cm;(b)标尺=1 mm。(a) Phenotype of rosette leaf; (b) Phenotype of SAM. (a) Scale bar=1 cm; (b) Scale bar=1 mm.图6 35S::CsYAB1a异源过表达拟南芥的莲座叶和花序的观察Fig.6 Rosette leaf and SAM observation of 35S::CsYAB1a overexpression Arabidopsis
与野生型相比,过表达拟南芥的雄蕊和心皮数目有所增多,野生型拟南芥花含有6枚雄蕊(4长2短)和1枚由2个心皮形成的圆柱状雌蕊,过表达拟南芥花平均含有6~7枚雄蕊,个别花中甚至含有10枚以上雄蕊(图7(a))。与此同时,过量表达CsYAB1a
基因导致心皮数目增多,继而形成了畸形雌蕊(图7(b)和(c))。畸形雌蕊按照表型可分为3类(图7(b)),从左至右畸形程度依次加深):由3~4个心皮形成的柱状雌蕊、由2~4个心皮并排形成的雌蕊(未融合成柱状)和由2~4个单心皮雌蕊组成的雌蕊群。后2类畸形雌蕊(群)有多个柱头,且发育后期会出现外露的胚珠(图7(c))。
(a)雄蕊表型;(b)雌蕊表型;(c)发育后期雌蕊表型。标尺=1 mm。(a) Phenotype of stamens; (b) Phenotype of pistils; (c) Phenotype of pistils at late stages of development. Scale bar=1 mm.图7 35S::CsYAB1a异源过表达拟南芥花器官的观察Fig.7 Floral organ observation of 35S::CsYAB1a overexpression Arabidopsis
本研究观察和统计了转基因拟南芥果实的表型,与野生型相比,35S
::CsYAB1a
过表达拟南芥的果实和花柄变短,部分果实发育畸形(图8)。成熟野生型拟南芥的果实纵径约为13.5 mm,而过表达拟南芥的果实纵径介于4.1~5.7 mm(图8(a));成熟野生型拟南芥的花柄长度约为6.0 mm,而过表达拟南芥的花柄长度约为3.0 mm(图8(b))。根据上述结果,推测黄瓜CsYAB1a
基因可能调控花和果实的发育。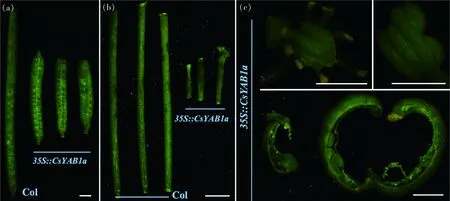
(a)果实表型;(b)花柄表型;(c)畸形果实(在不同发育时期)表型。标尺=1 mm。(a) Phenotype of silique; (b) Phenotype of flower stalk; (c) Phenotype of malformed fruit (in different periods). Scale bar=1 mm.图8 35S::CsYAB1a异源过表达拟南芥果实表型的观察Fig.8 Siliques observation of 35S::CsYAB1a overexpression Arabidopsis
为了对过表达拟南芥出现的表型变化进行解释,本研究选取了27个调控拟南芥花发育和叶片极性的相关基因,包括:AGAMOUS
(AG
)、ALCATRAZ
(ALC
)、APETALA
1
(AP1
)、APETALA
3
(AP3
)、ASYMMETRIC
LEAVES
1
(AS1
)、ASYMMETRIC
LEAVES
2
(AS2
)、CAULIFLOWER
(CAL
)、CLAVATA
3
(CLV3
)、CRC
、FLOWERING
LOCUS
T
(FT
)、FRUITFULL
(FUL
)、HANABA
TANARU
(HAN
)、HECATE
3
(HEC3
)、INDEHISCENT
(IND
)、KANADI
1
(KAN1
)、KANADI
2
(KAN2
)、LEAFY
(LFY
)、PISTILLATA
(PI
)、SHATTERPROOF
1
(SHP1
)、SHATTERPROOF
2
(SHP2
)、SPOROCYTELESS
(SPL
)、SPATULA
(SPT
)、SUPERMAN
(SUP
)、TERMINAL
FLOWER
1
(TFL1
)、WUSCHEL
RELATED
HOMEOBOX
1
(WOX1
)、WUSCHEL
(WUS
)和YUC11
,检测其在转基因拟南芥中的表达量变化。荧光定量结果表明(图9),SPL
、SHP2
、SHP1
、AP1
和CAL
在过表达拟南芥SAM中显著上调,而IND
和HEC3
的表达量则显著下调。同时,叶片极性基因KAN1
、KAN2
以及AS1
在过表达拟南芥莲座叶的表达量显著下调。其余与花发育相关的基因(ALC
、AP3
、CRC
、HAN
、LFY
、PI
、SUP
、TFL1
、WOX1
、WUS
和YUC11
)以及叶片极性基因AS2
则未检测出显著的表达量差异。
**或*表示在t检验下0.01或0.05水平上差异显著。图11同。 ** or * indicates a significant difference at the 0.01 or 0.05 level under t-test. The same as Figure 11.图9 潜在下游基因在35S::CsYAB1a异源过表达拟南芥的相对表达情况Fig.9 Expression of potential downstream genes in 35S::CsYAB1a overexpression Arabidopsis
2.8 黄瓜YABBYs基因启动子激素响应元件分析
为了从另一个角度解释过表达拟南芥出现的表型变化,本研究探究了黄瓜YABBYs
基因和植物激素的关系。利用PlantCARE网站分析黄瓜8个YABBYs
基因启动子(3 kb内)包含的顺式作用元件,结果表明:黄瓜YABBYs
基因的启动子含有10种激素响应元件,对应脱落酸、生长素、赤霉素、茉莉酸甲酯和水杨酸5种植物激素。其中CsYAB2
基因启动子包含激素响应元件最多,达到11个,而CsYAB5a
基因启动子中仅包含2个激素响应元件(图10(a))。另外,脱落酸响应元件占比最大,而水杨酸响应元件占比最小(图10(b))。
ABRE为脱落酸响应元件;AuxRR-core、TGA-box和TGA-element为生长素响应元件;GARE-motif、P-box和TATC-box为赤霉素响应元件;CGTCA-motif和TGACG-motif为茉莉酸甲酯响应元件;TCA-element为水杨酸响应元件。 ABRE is an abscisic acid response element; AuxRR-core, TGA-box and TGA-element are auxin response elements; GARE-motif, P-box and TATC-box are gibberellin responsive elements; CGTCA-motif and TGACG-motif are MeJA response elements; TCA-element is a salicylic acid response element.图10 黄瓜YABBYs基因启动子包含的激素响应元件Fig.10 Hormone response elements contained in the promoters of CsYABBYs genes
CsYAB1a
基因包含3种植物激素的响应元件(图10)。本研究选取YABBYs
家族中激素响应元件占比最大的脱落酸以及与果实长度密切相关的生长素,对CsYAB1a
基因最为富集的雌花芽进行外源脱落酸和生长素喷施处理,后续取样检测基因的表达量变化。多次取样导致组间植物样本存在差异,本研究选取同样具有脱落酸和生长素响应元件且在雌花芽表达量最高的CsCRC
基因作为响应趋势的参照(图11)。外源脱落酸喷施处理后,CsYAB1a
和CsCRC
基因均呈现先降低后升高的趋势,喷施处理1 h和24 h后出现显著上调(图11(a)和(c))。外源生长素喷施处理后,两者呈现先升高后降低的趋势,喷施生长素1 h和6 h后出现显著上调和下调(图11(b)和(d))。2个基因对外源激素喷施处理均有响应,且变化趋势相似(说明结果可信),CsCRC
基因的响应则更明显。上述结果表明,35S
::CsYAB1a
异源过表达拟南芥的表型变化可能与激素水平变化有关,YABBYs
家族部分成员可能通过脱落酸或生长素途径调控黄瓜的生长发育。3 讨论与结论
3.1 YABBYs基因的进化及结构分析

图11 外源激素喷施处理后CsYAB1a和CsCRC基因的响应情况Fig.11 Response of CsYAB1a and CsCRC genes after exogenous hormone spraying
YABBY
是一类被子植物特异的转录因子。YABBY
成员调控叶片和花器官的发育。截至目前,YABBY
基因的数量在多个物种中被报道研究,番茄含有9个YABBYs
基因,分布在12条番茄染色体中的7条;水稻含有8个YABBYs
基因,它们形成了4个亚群;小白菜含有12个YABBYs
基因,分布在20条白菜染色体中的6条;玉米含有13个YABBYs
基因。陆地植物苔藓(Bryophyta)和石松(Lycopodiophyta)没有YABBY
成员,因此认为该基因家族是种子植物特有的。YABBY
转录因子在种子植物中得到了广泛研究,但多数仅为物种内基因家族成员的鉴定、表达分析以及进化方面的工作,其家族成员的生物学功能有待进一步探究。本研究通过对拟南芥YABBYs
家族6个成员的蛋白序列进行同源比对,得到了8个黄瓜YABBYs
家族成员;拟南芥和黄瓜的YABBYs蛋白同源相似度较高(54%~71%);进化分析结果表明,黄瓜YABBYs
家族的8个成员被划分为5个亚家族,这与拟南芥YABBYs
基因的进化情况一致。研究表明,YAB1
和YAB3
基因可能源于1次基因复制事件,在拟南芥中两者存在功能冗余,在黄瓜中没有鉴定到AtYAB3
的同源基因。另外,AtYAB1
、AtYAB4
和AtYAB5
基因在黄瓜中分别对应2个同源基因,体现了黄瓜YABBYs
家族的特异性。同时,拟南芥和黄瓜YABBYs
家族14个成员的外显子均为6~7个,暗示YABBYs
基因在不同物种中较为保守。YABBY
基因由N端的C2C2锌指结构域和C端的YABBY结构域组成,它们与高迁移蛋白盒(HMG-box)的前2个螺旋序列类似,是1种特殊的并置结构域,在其他真核生物中没有发现。这2个结构域与DNA的特异性结合有关。8个黄瓜YABBYs
基因均包含C2C2锌指结构域和YABBY结构域,表明YABBYs
基因具有保守性。上述同源比对、系统发育、基因结构、染色体定位和保守结构域的结果在Yin等研究中得到进一步验证。3.2 CsYAB1a基因的表达模式及功能
FIL
基因(又名YAB1
)在起始原基的远轴端表达,决定远轴端细胞的命运。FIL
基因还参与花发育,并在拟南芥以外的其他物种中得到研究。例如:大豆GmFILa
基因参与拟南芥叶片近远轴端极性的调控、影响花期和顶端分生组织的发育;绿竹(Bambusa
oldhamii
)BoYAB1
基因参与拟南芥叶片发育和花期调控,异位过表达会导致拟南芥花期延迟和叶片向远轴端卷曲;此外,FIL
基因还影响花青素的积累。本研究利用荧光定量和原位杂交技术对CsYAB1a
基因表达模式进行检测发现,黄瓜CsYAB1a
基因在花原基远轴端、雌雄花芽的花瓣原基以及雌花芽的子房外果皮有明显富集。在拟南芥中异源过表达CsYAB1a
基因导致雌雄蕊发育畸形、果荚变短和叶片细长并向远轴端卷曲等。上述结果表明,CsYAB1a
基因的功能相对保守且可能参与黄瓜果实和叶片发育的调控过程。前人研究表明,拟南芥spl
突变体的雌雄蕊发育均受到抑制,且FIL通过和SPL蛋白互作来调控珠被发育;IND
和HECs
基因同属非典型bHLH转录因子家族,拟南芥ind
和hec3
突变体分别出现成熟果实不开裂和育性降低的表型;KANs
和ASs
基因参与近远轴端建成和维管发育,kan1kan2kan3
三重突变体会形成近轴化叶片;as1
和as2
突变体表现出极性缺陷。根据前人的报道和荧光定量结果,我们推测35S
::CsYAB1a
异源过表达拟南芥出现的表型可能与CsYAB1a
基因引起AtSPL
、AtIND
、AtHEC3
、AtKAN2
、AtAS1
和AtKAN1
基因的表达量变化有关。此外,AtSPL
和AtIND/HEC3
的黄瓜同源基因(分别为CsSPL
和CsIVP
)对于黄瓜的生长发育至关重要。黄瓜CsSPL
沉默植株的雄雌生殖力均显著下降,花粉畸形,胚珠发育受到抑制;黄瓜CsIVP
-RNAi转基因植株表现出多种发育缺陷,例如:植株矮壮、叶片变形、花发育异常和雄性不育。上述3个基因的表达水平在CsYAB1a
转基因拟南芥中发生了显著变化,表明CsYAB1a
基因可能与其有直接的关联,详细调控机制需在黄瓜中做进一步的验证分析。3.3 黄瓜YABBYs基因可能参及激素调控途径
植物激素对植物的生长发育至关重要。前人研究表明,YABBY
受生长素和赤霉素等激素的影响。例如:水稻OsYABBY
4基因通过促进赤霉素通路调控植株高度,外源施用赤霉素可恢复过表达OsYABBY1
引起的半矮化表型。此外,多个物种的YABBY
基因对外源喷施激素有响应,例如:毛竹(Phyllostachys
edulis
)PeYABBYs
基因对外源喷施赤霉素和脱落酸有响应,小白菜BcYABBYs
基因和大豆GmFILa
基因对外源喷施生长素、脱落酸和水杨酸有响应,菠萝AcYABBY
基因对外源喷施乙烯和脱落酸有响应。黄瓜YABBYs
基因启动子的激素响应元件中脱落酸响应元件占比最大。对黄瓜雌花芽进行外源脱落酸和生长素喷施处理,取样检测CsYAB1a
和CsCRC
基因的表达量变化,结果表明,2个基因对外源激素喷施处理均有响应,且变化趋势相似,CsCRC
基因的响应更为明显。结合前人研究结果推测YABBYs
家族部分成员可能通过脱落酸或生长素途径来调控黄瓜果实的生长发育。本研究为深入解析黄瓜YABBYs
基因的功能奠定了基础。