人脑胶质瘤组织Six1、IGF2蛋白表达与临床病理特征、细胞增殖和预后的关系
2022-10-10赵乐,李涛
赵 乐,李 涛
陕西省榆林市第二医院神经外科,陕西榆林 719000
人脑胶质瘤是中枢神经系统常见的恶性肿瘤,其发病率占全部颅内肿瘤的35%~60%,全球每年约有19万新发病患者,但仅有5%的患者生存时间超过5年,具有发病率高、复发率高、病死率高以及治愈率低的特点,严重威胁患者生命健康[1]。目前,临床诊断人脑胶质瘤主要依靠影像学检查及术后病理诊断,虽能帮助大部分患者确诊,但在临床鉴别和分级中仍存在一定局限性,影响其诊断价值[2]。随着分子病理诊断学的发展,生物标志物检查被逐渐应用于临床诊断中枢神经系统疾病。同源异形框基因为转录调控因子,具有特异性调节基因的表达作用,其中Six1在细胞增殖、分化、黏附等细胞生理功能中发挥重要作用,据临床研究发现,乳腺癌[3]、肝癌[4]等诸多恶性肿瘤患者中存在Six1的异常高表达。胰岛素样生长因子-2(IGF2)为胚胎生长因子,近年来有研究证实IGF2的表达与肿瘤的良恶性相关,且在结直肠癌[5]、非小细胞肺癌[6]等肿瘤组织中呈高表达。本研究通过探讨人脑胶质瘤组织Six1、IGF2蛋白表达与临床病理特征、细胞增殖和预后的关系,以期为临床诊断提供参考。
1 资料与方法
1.1一般资料 选取2016年1月至2018年1月在本院接受诊治的人脑胶质瘤患者切除的瘤组织80例设为观察组,另选取同期本院收治的非脑瘤患者手术切除的脑组织40例设为对照组。对照组患者年龄15~75岁,平均(53.34±7.12)岁;男22例,女18例。观察组患者年龄12~72岁,平均(52.63±6.75)岁;男44例,女36例。两组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会审核批准,所有研究对象均签署知情同意书。纳入标准:(1)根据临床症状、体征检查确诊为人脑胶质瘤[7],并行手术切除治疗患者;(2)术前未进行放疗、化疗治疗者;(3)临床病历资料完整者。排除标准:(1)严重心、肝、肾功能不全者;(2)合并其他恶性肿瘤者;(3)既往有精神疾病者;(4)合并有活动性感染、血液系统疾病者。
1.2主要试剂 兔抗人IGF2、Six1单克隆抗体均购自美国Abcam公司,荧光定量试剂盒、逆转录试剂盒和免疫组化试剂盒均购自北京中衫金桥生物技术有限公司。
1.3方法 采用SP免疫组化法检测Six1、IGF2蛋白免疫反应性。使用10%甲醇溶液固定标本,采用石蜡包埋,将标本切成5 μm薄片后进行脱水处理、EDTA抗原修复液高压修复之后,使用3%双氧水阻断内源性过氧化物酶30 min,加入1∶500浓度的兔抗人一抗4 ℃过夜。过夜取出后室温恢复,采用磷酸盐缓冲液(PBS)清洗后,加入兔抗人二抗37 ℃孵育30 min,二氨基联苯胺(DAB)显色试剂盒显色后苏木精复染,随后封片,整个SP免疫组化过程严格按照说明书操作步骤进行。试验过程中,以PBS代替一抗作为阴性对照。
1.4结果判定 Six1、IGF2蛋白阳性信号均定位在细胞质内,阳性细胞为呈棕黄色或棕褐色颗粒。(1)根据阳性细胞染色强度进行结果判定:0分为染色强度无色;1分为淡黄色(弱阳性);2分为棕黄色(中等强度);3分为棕褐色(强阳性)。(2)根据阳性细胞百分比进行结果判定:0分为阳性细胞占比0%;1分为阳性细胞占比<0%~10%;2分为阳性细胞占>10%~49%;3分为阳性细胞占>49%~75%;4分为阳性细胞占比>75%。(3)染色指数=阳性细胞染色强度评分×阳性细胞百分比评分:染色指数0分为阴性表达(-);染色指数1~2分为低阳性表达(+);染色指数3~5分为中阳性表达(++);染色指数>6分为高阳性表达(+++)[8]。增殖细胞核抗原(PCNA)与Ki-67阳性信号均位于细胞核中。PCNA、Ki-67标记指数(LI)判断标准:随机选择10个400倍视野进行细胞计数,一共计数>1 000个细胞的基础上计算LI(计数时不包括血管内皮阳性细胞)。LI(%)=阳性细胞数/总计数细胞数×100%[9]。
1.5随访 采用电话联系或者门诊复查的方式对研究对象进行36个月的随访,随访时间至2021年1月。将患者第1次手术时间至死亡日期或随访截止日期视为总生存时间(OS)。
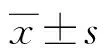
2 结 果
2.1两组Six1、IGF2蛋白阳性表达情况比较 观察组Six1、IGF2蛋白阳性表达率均明显高于对照组(P<0.05),见表1、表2。

表1 两组Six1蛋白阳性表达情况比较[n(%)]

表2 两组IGF2蛋白阳性表达情况比较[n(%)]
2.2人脑胶质瘤组织Six1、IGF2蛋白表达与患者临床病理特征的关系 Six1、IGF2蛋白阳性表达在人脑胶质瘤患者不同病理类型、肿瘤最大径、肿瘤病理分级、年龄、性别之间差异无统计学意义(P>0.05);Six1、IGF2蛋白阳性表达率在人脑胶质瘤患者不同肿瘤分化程度间比较差异有统计学意义(P<0.05),且肿瘤分化程度越低,Six1、IGF2蛋白阳性表达率越高(P<0.05),见表3。

表3 Six1、IGF2蛋白表达与人脑胶质瘤患者临床病理特征的关系[n(%)]
2.3人脑胶质瘤组织Six1、IGF2蛋白表达与Ki-67 LI、PCNA LI的关系 Six1蛋白阳性表达患者的Ki-67 LI、PCNA LI均明显高于Six1蛋白阴性表达患者(P<0.05),且随着Six1蛋白阳性表达程度的增加,Ki-67、PCNA LI随之升高(P<0.05),见表4。

表4 人脑胶质瘤组织Six1、IGF2蛋白表达与Ki-67 LI、PCNA LI的关系
2.4Six1与IGF2蛋白在人脑胶质瘤组织中表达水平的相关性分析 Pearson相关性分析结果显示,Six1与IGF2蛋白在人脑胶质瘤组织中表达水平呈正相关(r=0.399,P<0.05)。
2.5人脑胶质瘤组织Six1、IGF2蛋白表达与患者预后的关系 3年的随访结束后共获访76例,失访4例,76例患者中死亡41例,生存35例。Six1蛋白阴性表达患者的生存率为62.96%(17/27),高于Six1蛋白阳性表达患者的36.73%(18/49),差异有统计学意义(Log-rankχ2=4.029,P=0.045);IGF2蛋白阴性表达患者的生存率为57.50%(23/40),高于IGF2蛋白阳性表达患者的33.33%(12/36),差异有统计学意义(Log-rankχ2=4.903,P=0.027)。
2.6COX回归分析人脑胶质瘤患者预后的影响因素 建立COX比例风险回归模型(逐步后退法,α保留=0.05,α剔除=0.10),以人脑胶质瘤患者预后状况为应变量,赋值1=死亡,0=生存,t=生存期。自变量为肿瘤分化程度、IGF2蛋白表达情况、Six1蛋白表达情况,赋值见表5。回归结果显示,低肿瘤分化程度、IGF2阳性表达、Six1阳性表达均是影响胶质瘤患者预后的危险因素(P<0.05),见表6。

表5 COX回归自变量赋值情况

表6 人脑胶质瘤患者预后的影响因素分析
3 讨 论
人脑胶质瘤是中枢神经系统常见恶性肿瘤,发病率占成人颅内肿瘤的40%,其以浸润性方式生长,导致手术治疗难以完全切除瘤体,治疗效果差,患者具有较高的病死率[10-11]。随着分子生物学检测技术的不断发展,研究者逐渐开始从肿瘤组织蛋白质分子表达等角度进一步了解胶质瘤发病机制,为临床进行生物靶点治疗或判断胶质瘤患者预后提供参考。Six是一类特殊的转录调控因子,参与调控特异性基因表达,Six1作为Six家族的重要成员,在乳腺癌中可通过HBO1和AIB1组蛋白乙酰转移酶调节糖酵解,促进体外和体内的Warburg效应和肿瘤生长[12]。胰岛素样生长因子(IGF)是一类功能细胞调控因子,其分泌细胞广泛分布在人体肝、肾、肺、脑等组织中,IGF2是肝脏和许多其他组织产生的一种相对分子质量为7.5×103的肽,具有家族一系列典型生物学特性,对细胞的增殖分化发挥一定作用[13]。
本研究结果发现,人脑胶质瘤患者Six1、IGF2蛋白阳性表达率均明显高于同期非脑瘤患者,呈高水平表达;低分化人脑胶质瘤患者Six1、IGF2蛋白阳性表达率明显高于中、高分化人脑胶质瘤患者。提示人脑胶质瘤分化程度越低,Six1、IGF2蛋白阳性表达率越高,进一步提示Six1、IGF2蛋白表达与人脑胶质瘤的发生发展密切相关。这可能与两者在细胞的增殖、分化、迁移、黏附、凋亡中发挥重要作用有关。临床研究发现,过度表达的Six1能够逆转由过度表达的微小RNA(miR)-155-3p诱导的细胞凋亡所引起的细胞周期分布、增殖,而miR-155-3p可通过调节Six1的表达,促进胶质母细胞瘤的进展[14]。王文斐等[15]的研究表明,IGF2在胶质瘤的发生发展中发挥一定的作用,且其表达随着病理分级的增加而升高。
肿瘤细胞增殖是反映肿瘤恶性程度的重要指标,与肿瘤的发生发展、浸润、转移密切相关,细胞的恶性增殖是肿瘤的重要特征。PCNA、Ki-67均为增殖细胞相关的核抗原,能够有效反映细胞增殖的活跃程度[16]。本研究结果发现,Six1、IGF2蛋白阳性表达患者Ki-67 LI、PCNA LI均明显高于其阴性表达患者,且随着Six1、IGF2蛋白阳性表达程度增加,Ki-67 LI、PCNA LI随之升高。提示Six1、IGF2蛋白表达与人脑胶质瘤细胞增殖活跃程度密切相关,在肿瘤细胞增殖中发挥重要作用。Six1基因主要定位于人染色体14q23上,产物蛋白由同源异型结构域N-末端与Six结构域组成,与DNA特定结合后调节下游基因表达[17]。近年来研究发现,Six1是转录因子E2F1的转录靶基因,将转录活性维持在有丝分裂早期,对细胞的增殖、分化等方面起重要的作用,Six1蛋白在多种肿瘤中表达上调,活化细胞周期调节因子,促进肿瘤细胞增殖、浸润,从而在肿瘤的发生发展中发挥重要作用[18]。IGF2基因为内源性印记基因,据研究证实,IGF2基因的印迹丢失易引起IGF2蛋白过度表达,从而抑制肿瘤细胞的凋亡,促进肿瘤细胞增殖、转化[19]。
本研究结果还发现,Six1、IGF2蛋白阳性表达患者随访3年的生存率明显低于Six1蛋白阴性表达患者(P<0.05)。COX回归分析结果显示,低肿瘤分化程度、IGF2阳性表达、Six1阳性表达均是影响人脑胶质瘤患者预后的危险因素。提示Six1、IGF2蛋白可作为评估患者预后的有效指标,对患者预后有显著影响,Six1、IGF2蛋白阳性表达患者的预后较差。LI等[12]也证实了Six1可以通过调节糖酵解促进肿瘤生长。IGF2蛋白通过与受体结合介导RELA/p65、MAPK/ERK/Raf/Ras等通路,经甲硫氨酸脑啡肽信号传导上调肿瘤细胞血管内皮生长因子水平,对调节肿瘤组织血管生成起到关键作用,从而促进肿瘤的生长、浸润,患者往往预后不良[20]。本研究Pearson相关分析结果显示,Six1与IGF2蛋白在人脑胶质瘤组织中表达水平呈正相关(P<0.05)。提示Six1、IGF2蛋白两者在人脑胶质瘤患者组织的表达情况可作为判断预后的生物标志物,二者联合检测可能成为人脑胶质瘤生物标记的新指标,亦可能成为人脑胶质瘤基因治疗的潜在靶点,为临床制订更为合理和有效的治疗方案提供依据。
综上所述,Six1、IGF2蛋白在人脑胶质瘤患者组织中呈高表达,且肿瘤分化程度越低,肿瘤细胞增殖越活跃,Six1、IGF2蛋白阳性表达率越高。Six1、IGF2蛋白阳性表达患者的生存期较短,预后较差。
