中性粒细胞胞外陷阱对类风湿关节炎成纤维化样滑膜细胞mRNA表达谱的影响
2022-10-08黄赛赛耿林玉丁从珠
孙 玥,黄赛赛,耿林玉,丁从珠,王 红
0 引 言
类风湿关节炎(rheumatoid arthritis, RA)是一种临床常见的系统性自身免疫疾病,可累及手、足等多关节,典型临床表现为关节肿胀、疼痛等。RA的主要病理特征为滑膜炎,未控制的滑膜炎引发软骨破坏和骨质侵蚀, 临床上可导致严重关节畸形、功能丧失及高死亡率[1]。RA是严重危害人类健康的主要致残性疾病之一,但是目前RA滑膜炎的发病机制尚有待深入研究。
中性粒细胞胞外陷阱(neutrophil extracellular traps, NETs)是由活化的中性粒细胞向细胞外释放的网状物,主要是由核蛋白和颗粒蛋白构成[2]。近年研究显示,NETs与RA疾病的发生发展密切相关。在RA患者的外周血和滑膜中NETs生成增多,并且NETs数量与C反应蛋白、血沉、抗瓜氨酸化蛋白抗体滴度均有很强的相关性[3]。动物实验表明抑制NETs的生成可以有效缓解关节炎病情和减轻滑膜炎症[4]。成纤维化样滑膜细胞(fibroblast-like synoviocytes, FLS)是参与RA滑膜炎的核心细胞[5]。在本研究中,我们观察NETs对RA FLS基因表达谱的影响,试图揭示NETs参与RA滑膜炎的可能机制。
1 材料与方法
1.1 实验材料收集RA患者8例以及8例健康志愿者(healthy control, HC)外周血5 mL分别作为RA组和对照组,以Polymorphprep分离液(Axis-Shield,德国)分离外周血的中性粒细胞,同时收集上述两组的血清。
1.2免疫荧光测定NETs将分离的中性粒细胞以含10%胎牛血清(fetal Bovine Serum, FBS)的RPMI 1640培养基混悬,并以1×105的数量种植于含聚赖氨酸的玻片上,培养15 min后,用4%多聚甲醛固定细胞。用含有10%FBS、1%牛血清蛋白、0.05%Tween20的PBS封闭细胞过夜。以5 μmol/L Sytox green染料(Thermo Fisher,美国)孵育细胞10 min标记NETs产物DNA后,荧光显微镜下观察NETs的形成。
1.3ELISA检测游离核小体的水平NETs产生过程中伴随细胞核物质的释放,游离核小体被作为评估NETs生成的特异性生物标志物。RA组与对照组的血清中NETs组分游离核小体的水平通过商品化的Cell Death Detection ELISA试剂盒(Roche,美国)进行定量检测。其检测具体步骤参照试剂盒给定的操作说明。
1.4NETs的诱导实验将健康对照者1例的中性粒细胞以1×106的数量接种在24孔板中,用含10% FBS的RPMI 1640培养基培养4 h。以50 nmol/L 的佛波酯(Phorbol Myristate Actetate, PMA)(Sigma,美国)刺激上述中性粒细胞,在37 °C下放置60 min,以诱导NETs形成。收集中性粒细胞上清液,用10 U/mL的微球菌核酸酶(Thermo Fisher,美国)在37 °C条件下消化NETs 20 min。收集上清液,并在4 °C条件下,以3000xg的速度旋转10 min,以去除完整的细胞。离心后获得的上清液(NETs)冻干,混悬于3倍体积的培养基中,用于FLS的刺激实验。
1.5FLS的分离培养及刺激实验滑膜组织标本从3例RA患者全膝关节置换术中获取。取得的滑膜组织24 h之内带入超净工作台。在无菌条件下,仔细剔除滑膜附属的血管、脂肪和其他软组织,加入含10%FBS的DMEM培养液,通过贴壁法培养FLS。当原代培养的细胞生长至约90%融合时,以胰酶消化法进行传代培养。取3代稳定的传代细胞用于实验。将FLS以1×106的数量接种在6孔板中,以含10%FBS的DMEM培养基培养,加或不加方法1.4中所分离的NETs刺激,分为未刺激的FLS组(n=3)和NETs刺激后的FLS组(n=3)。24 h后收集培养的FLS,用Trizol试剂盒(Takara,日本)从FLS中分离总RNA,交由生工生物工程(上海)股份有限公司进行mRNA表达谱芯片(Agilent,美国)检测。对6个样本的芯片数据进行分析,包括原始数据归一化、样本间比较分析、基因表达分析、差异基因筛选、差异基因聚类、差异基因的GO(Gene Ontology)分析以及KEGG(Kyoto Encycloedia of Genes and Genomes)通路富集分析等。
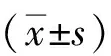
2 结 果
2.1 RA组NETs显著增多与对照组(6.67±1.45)相比,RA组外周血中NETs形成数量(18.67±2.33)显著增多(P<0.05),见图1;与对照组(0.11±0.02)相比,RA组血清中NETs组分游离核小体的水平(0.20±0.02)也显著升高(P<0.05)。

a:对照组; b:RA组
2.2差异基因筛选火山图(Volcano Plot)在同一平面内展示了NETs刺激后FLS基因表达的探针数目及分布,。图中灰点表示没有显著差异表达的基因,红点代表上调表达的基因,蓝点代表下调表达的基因,见图2。基因芯片结果进一步提示与未刺激的FLS对比,NETs刺激培养后的FLS共有差异表达mRNA469个,其中mRNA上调257个,下调212个,见图3。

图2 差异基因火山图

a: NETs刺激后的FLS组; b:未刺激的FLS组
2.3NETs对RA FLS基因表达谱的影响以未刺激的FLS作为对照,用基因芯片分析NETs对RA FLS基因表达谱的影响。全基因组学分析显示NETs可以作用于RA FLS:①上调TRAF家族成员关联NFκB激活因子、肿瘤坏死因子受体、热休克蛋白等炎性反应相关基因的表达;②上调转化生长因子、血小板源生长因子受体等促细胞增殖相关基因的表达;③上调趋化因子受体CCR4、Ig样域蛋白黏附分子1等细胞迁移相关基因的表达;④上调可以破坏软骨的金属蛋白酶ADAM10基因的表达;⑤下调细胞程序性死亡、细胞生长阻滞、DNA损伤相关基因的表达,见表1。

表1 全基因组分析NETs对RA FLS基因表达谱的影响
2.4差异基因GO分析及KEGG通路富集分析对2.2筛选的差异基因进行GO分析和KEGG通路富集分析,取得的GO和信号通路是按照富集因子(enrich factor)的值从大到小降序排列,分别取前30个结果作图。GO分析结果显示差异基因主要参与了成纤维细胞生长因子受体通路、核小体组装、组蛋白去甲基化、成纤维细胞凋亡、染色质沉默和DNA修饰等生物学过程,见图4。KEGG通路富集分析结果显示差异基因主要涉及细胞黏附、细胞周期、TGF-β信号通路、MAPK信号通路等经典信号通路,见图5。

图4 差异基因GO分析

图5 差异基因KEGG通路富集分析
3 讨 论
在RA发病的早期阶段,外周循环和滑膜关节中都存在大量的中性粒细胞,提示中性粒细胞在导致RA发病过程中发挥重要作用[6]。我们的研究和前人的研究表明,RA患者外周血和滑膜关节里NETs的形成显著增多[3]。在NETs形成的信号通路中,蛋白激酶C活化肽基精氨酸脱亚胺酶,后者是瓜氨酸化蛋白生成的关键酶[7]。大量研究证实NETs是RA患者体内瓜氨酸化自身抗原的重要来源[8-10]。除了产生自身抗原,NETs还可以通过多种途径参与RA的发病。研究提示NETs可以直接或间接影响多种免疫细胞,促进白细胞介素(interleukin, IL)-1β、IL-6、肿瘤坏死因子等炎性细胞因子的表达[11-12]。此外,NETs的形成伴随氧化应激反应,后者可加剧RA的组织破坏[13]。
FLS是RA滑膜炎及关节破坏的重要参与者[14]。在健康人中,FLS主要参与细胞外基质和滑液的组成,从而润滑和滋养软骨组织。然而,在RA中FLS具有侵袭性表型,表现为增殖过度、凋亡障碍、迁移粘附能力增加,导致滑膜衬里层转变为侵袭性增生组织,并参与血管翳的形成[15]。
我们的基因芯片结果表明,NETs可作用于RA FLS,上调细胞增殖、细胞迁移相关基因的表达,下调细胞程序性死亡、细胞生长阻滞、DNA损伤相关基因的表达。既往研究表明基因突变和表观遗传修饰可以导致RA FLS表型的改变。表观遗传修饰可通过染色质的化学修饰或其他机制,在不改变DNA序列的情况下影响FLS的基因活性和表达。对RA FLS甲基组的初步研究量化了细胞的整体甲基化状态,数据表明RA FLS总体上是低甲基化的。在体外使用DNA甲基化抑制剂5-氮杂胞苷抑制甲基化,可以直接影响正常FLS的表型,导致FLS的侵袭性表型[16]。我们的GO富集分析进一步表明NETs可以影响FLS的核小体组装、组蛋白去甲基化、染色质沉默以及DNA修饰等生物学过程。因此,我们的研究结果提示NETs可能通过影响表观遗传修饰的方式,改变细胞增殖、凋亡及迁移等相关基因的表达,最终导致RA FLS形成侵袭性表型。
除了形成侵袭性表型,RA FLS还可以产生致病炎性介质,如细胞因子和蛋白酶,从而导致RA关节软骨和骨的破坏。在RA的血管翳-软骨界面,FLS介导基质金属蛋白酶(matrix metalloprotein, MMP)的过度产生,如MMP1、MMP3和MMP13,破坏关节组织中富含胶原的结构[17]。我们的基因芯片结果表明NETs可作用于RA FLS,上调后者肿瘤坏死因子受体、热休克蛋白以及金属蛋白酶ADAM10基因的表达。上述结果表明NETs可诱导RA FLS炎性细胞因子和蛋白酶的表达,进而参与RA滑膜炎和组织破坏。
基于筛选出的差异基因,我们在研究中也进行了KEGG通路富集分析,结果显示NETs可以影响FLS的TGF-β信号通路、MAPK信号通路等经典信号通路。既往研究表明,与健康人相比,MAPK信号通路在RA FLS中高度激活。体外实验证实抑制MAPK信号通路,可以减少RA FLS的侵袭、迁移和增殖等细胞行为[18]。在K/BxN血清诱导的关节炎模型实验中进一步发现,抑制MAPK信号通路可以有效缓解关节炎小鼠的滑膜炎病情[19]。因此,未来的研究可以进一步探讨NETs是否通过影响MAPK信号通路等细胞内过程,改变RA FLS的生物学功能。
综上,本研究通过全基因组学分析表明NETs可诱导RA FLS的侵袭表型和炎症反应,提示NETs可能通过影响FLS生物学功能参与RA滑膜炎。此项工作从新的角度阐明RA滑膜炎的发病机制,揭示了NETs在RA发病过程中的重要作用,并且为后续深入研究NETs参与RA滑膜炎的分子学机制提供了基础。