不同浓度牛磺酸对猪精液负压条件常温保存效果的影响
2022-09-22王赫川李天峰郭铭晖周彦芝李雁冰魏国生李井春
王赫川,张 涵,李天峰,王 骞,张 群,郭铭晖,孙 超,周彦芝,李 远,李雁冰,魏国生,李井春
(黑龙江八一农垦大学动物科技学院,大庆 163319)
猪精子质膜的低胆固醇/磷脂导致其对冷休克高度敏感,因而在生产实践中一般在15~18 ℃下保存猪精液,以尽可能维持其各项生理性能的稳定。虽然精子的获能反应及顶体反应等关键生理过程需要适当浓度的活性氧(ROS),但精子在保存过程中仍不可避免地要遭受细胞外环境胁迫导致的过量ROS,ROS对精子顶体完整性、质膜完整性及线粒体活性等均会产生不可逆影响。因此在精液稀释剂中添加抗氧化物质是目前家畜精液保存的常见手段之一。
牛磺酸(β-氨基乙磺酸)是半胱氨酸的重要衍生物,于1827年从牛胆汁中分离并命名为Gallen-Asparagin,1838年正式改名为牛磺酸[1]。牛磺酸具有神经保护、抗炎、免疫调节及抗氧化等生理作用[2-5]。牛磺酸的抗氧化能力主要通过以下4个方面体现:参与自由基清除;维持线粒体电子传递链在应激状态下的完整性;稳定生物膜系统;抑制机体特定的ROS产生酶类[6]。Vasco等[7]研究表明,精液在常温保存时直接与空气中的高浓度氧接触,相较于冷冻保存不可避免地产生更多ROS,并持续对精子产生毒害作用。同时当环境中ROS堆积量超过其清除速度时会产生氧化应激,导致精子的脂质过氧化反应(LPO),表现为质膜脂肪酸流失、质膜流动性及完整性降低等[8]。
常温保存环境中氧的存在也会加剧精子的氧化应激进而造成死亡,而负压环境能够有效降低环境氧浓度以减弱精子的活动强度,尽可能地降低精子能量消耗及氧化应激情况[9]。李琦等[10]在常压及不同负压条件下使用Modena稀释剂17 ℃保存猪精液,结果表明―0.04 Mpa环境下的猪精子代谢水平与氧化应激显著降低,能够较好地提升猪精液的保存质量。本研究拟在―0.04 Mpa条件下向Modena稀释剂中添加不同浓度牛磺酸,并在17 ℃下保存猪精液11 d,检测精子活力、活率、畸形率、动力学参数、总抗氧化能力(T-AOC)及H2O2含量,分析负压条件下牛磺酸对猪精液常温保存质量与抗氧化能力的影响,以期为猪精液保存技术的发展提供参考。
1 材料与方法
1.1 材料
2~3岁健康长白猪4头,选自黑龙江八一农垦大学实验猪场。采用手握法采集精液,并确保采精频率一致(每周2次)。光学显微镜检查精液,选取呈浅灰白或乳白色且精子估测活力≥0.7、微腥无异味的精液作为试验材料。检测完毕后,将4头公猪的合格精液混合并在1 h内送回实验室,期间注意避免剧烈晃动以减少对精子的机械性损伤。
1.2 主要试剂及仪器
牛磺酸(江苏佰耀生物科技有限公司);柠檬酸钠及NaHCO3(天津博迪化工有限公司);葡萄糖及链霉素(北京博奥拓达科技有限公司);柠檬酸及Tris(西陇科学股份有限公司);EDTA-2Na、牛血清白蛋白(BSA,Sigma公司);青霉素(浙江金华康恩贝生物制药有限公司);H2O2及T-AOC检测试剂盒(北京索莱宝科技有限公司)。计算机辅助精子分析系统(CASA,南宁松景天伦生物科技有限公司);XDS-1B型倒置生物显微镜(上海精密仪器仪表有限公司);DH5000BII型恒温培养箱(天津市泰斯特仪器有限公司);TDL-60型低速离心机(上海安亭科学仪器厂);85-1型恒温磁力搅拌仪(金坛荣华仪器制造有限公司);XW-80A型漩涡混合仪(海门市其林贝尔仪器制造有限公司);CP114型电子分析天平(奥豪斯仪器(上海)有限公司)。
1.3 稀释剂配制
准确称量葡萄糖6.875 g、柠檬酸钠1.725 g、Tris 1.413 g、BSA 1.000 g、柠檬酸0.725 g、EDTA-2Na 0.650 g、NaHCO30.250 g、青霉素0.0185 g、链霉素0.0125 g,加入双蒸水混合溶解并定容至250 mL配成Modena精液稀释剂,用0.22 μm滤器过滤后置4 ℃保存备用。
1.4 精液分组及处理
在Modena稀释剂中分别添加不同浓度牛磺酸,使最终浓度分别为1、5、10 mmol/L,置于4 ℃备用。将精液平均分为4份,1 800 r/min离心5 min,弃上清后使用血球计数板检测精子密度,用0(对照组)、1、5、10 mmol/L牛磺酸的Modena稀释剂将精子密度调整至1×108/mL。将稀释后的各组精液分装入试管并半旋紧置于负压瓶中,使用真空泵调整瓶内气压至―0.04 Mpa,负压瓶置于17 ℃恒温箱中保存11 d。每12 h对所有试管进行缓慢混匀1次。
1.5 测定指标及方法
1.5.1 动力学参数测定 分别在精液保存的第0、1、3、5、7、9、11天检测每组精液中精子的活力、活率、畸形率、曲线速度(VCL)、平均路径速度(VAP)及鞭打频率(BCF)。活力指前进运动精子占总体的百分率;活率指具有运动能力精子占总体的百分率;畸形率指尾段缺失、头部缺损、过度弯曲精子占总体的百分率;VCL指精子前进曲线瞬时速度的平均值;VAP指精子平均运动轨迹的速度;BCF指精子尾部每秒的鞭打次数。
提前将CASA的加热载物台预热至37 ℃。每组取20 μL精液,加入17 ℃预处理的Modena稀释剂40 μL进行稀释。稀释完成后置于37 ℃、5% CO2恒温培养箱中复苏10 min,之后取10 μL精液滴加于载玻片上,缓慢盖上盖玻片使其形成均匀液膜,调节CASA至视野清晰。每组随机选择5个观测视野,每个视野中精子计数不少于100个。
1.5.2 抗氧化能力测定 按试剂盒说明书测定精液T-AOC及H2O2含量,每组均设置4次重复。
1.6 数据统计及分析
用Stat View 5.0对试验数据进行单因素方差分析(One-Way ANOVA),用Duncan氏法进行组间多重比较,结果用平均值±标准差表示。P<0.05表示差异显著。
2 结 果
2.1 不同浓度牛磺酸对精子活力及活率的影响
2.1.1 不同浓度牛磺酸对精子活力的影响 由表1可知,在1~11 d中,3个牛磺酸组与对照组精子活力均存在显著差异(P<0.05),其中5 mmol/L牛磺酸组总体保存效果最佳。第1、3、5天时,3个牛磺酸组间精子活力差异不显著(P>0.05);第7、9、11天时,5 mmol/L牛磺酸组精子活力均显著高于1与10 mmol/L牛磺酸组(P<0.05),但1与10 mmol/L牛磺酸组间精子活力差异不显著(P>0.05)。
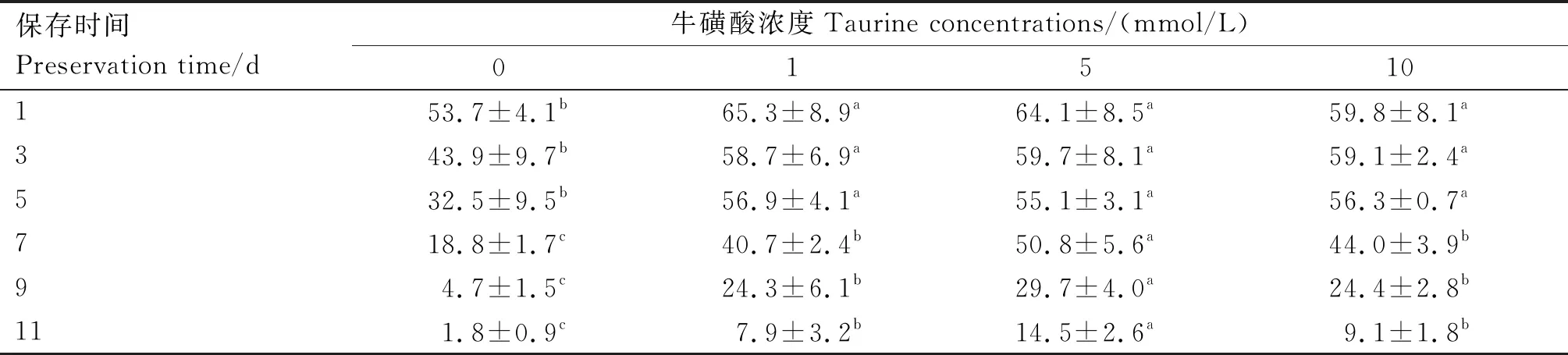
表1 不同浓度牛磺酸组猪精子活力
2.1.2 不同浓度牛磺酸对精子活率的影响 由表2可知,在1~11 d中,3个牛磺酸组与对照组间精子活率均差异显著(P<0.05),其中5 mmol/L牛磺酸组总体保存效果最佳。在第1、3天时,3个牛磺酸组间精子活率差异不显著(P>0.05);第5天时,5与10 mmol/L牛磺酸组精子活率显著高于1 mmol/L牛磺酸组(P<0.05);第7、9、11天时,5 mmol/L牛磺酸组精子活率显著高于1与10 mmol/L牛磺酸组(P<0.05),而1与10 mmol/L牛磺酸组间精子活率差异不显著(P>0.05)。

表2 不同浓度牛磺酸组猪精子活率
2.2 不同浓度牛磺酸对精子畸形率的影响
由表3可知,第1天时,5与10 mmol/L牛磺酸组精子畸形率显著低于对照组(P<0.05),1 mmol/L牛磺酸组与对照组相比则差异不显著(P>0.05);第3天时,5 mmol/L牛磺酸组精子畸形率显著低于1 mmol/L牛磺酸组(P<0.05);第5天时,所有处理组(0、1、5、10 mmol/L)间精子畸形率均无显著差异(P>0.05);第7天时,3个牛磺酸组间精子畸形率无显著差异(P>0.05),但均显著低于对照组(P<0.05);第9天时,5 mmol/L牛磺酸组分别与1及10 mmol/L牛磺酸组间精子畸形率无显著差异(P>0.05);第11天时,5 mmol/L牛磺酸组精子畸形率显著低于1及10 mmol/L牛磺酸组(P<0.05)。

表3 不同浓度牛磺酸组猪精子畸形率
2.3 不同浓度牛磺酸对精子动力学参数的影响
2.3.1 不同浓度牛磺酸对精子VAP的影响 由表4可知,第1天时,所有处理组间精子的VAP差异均不显著(P>0.05);第3、5、7、9、11天时,各牛磺酸添加组精子的VAP均显著高于对照组(P<0.05);第7、9、11天时,5 mmol/L牛磺酸组精子的VAP显著高于10 mmol/L牛磺酸组(P<0.05)。
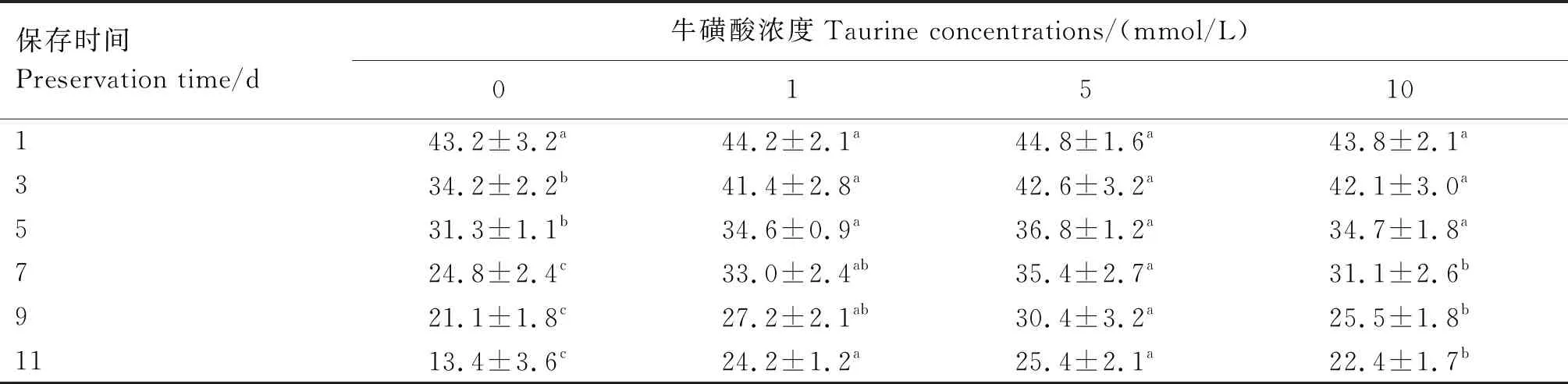
表4 不同浓度牛磺酸组猪精子VAP
2.3.2 不同浓度牛磺酸对精子VCL的影响 由表5可知,第1、3、5、7天时,5与10 mmol/L牛磺酸组精子的VCL显著高于1 mmol/L牛磺酸组与对照组(P<0.05);第9、11天时,5 mmol/L牛磺酸组精子的VCL显著高于其他各组(P<0.05),1与10 mmol/L牛磺酸组间精子的VCL差异不显著(P>0.05),但均显著高于对照组(P<0.05)。

表5 不同浓度牛磺酸组猪精子VCL
2.3.3 不同浓度牛磺酸对精子BCF的影响 由表6可知,第1、3、5天时,所有处理组间精子的BCF差异均不显著(P>0.05);第7、9、11天时,5 mmol/L牛磺酸组精子的BCF显著高于其他各组(P<0.05),1与10 mmol/L牛磺酸组间精子的BCF差异不显著(P>0.05),但均显著高于对照组(P<0.05)。
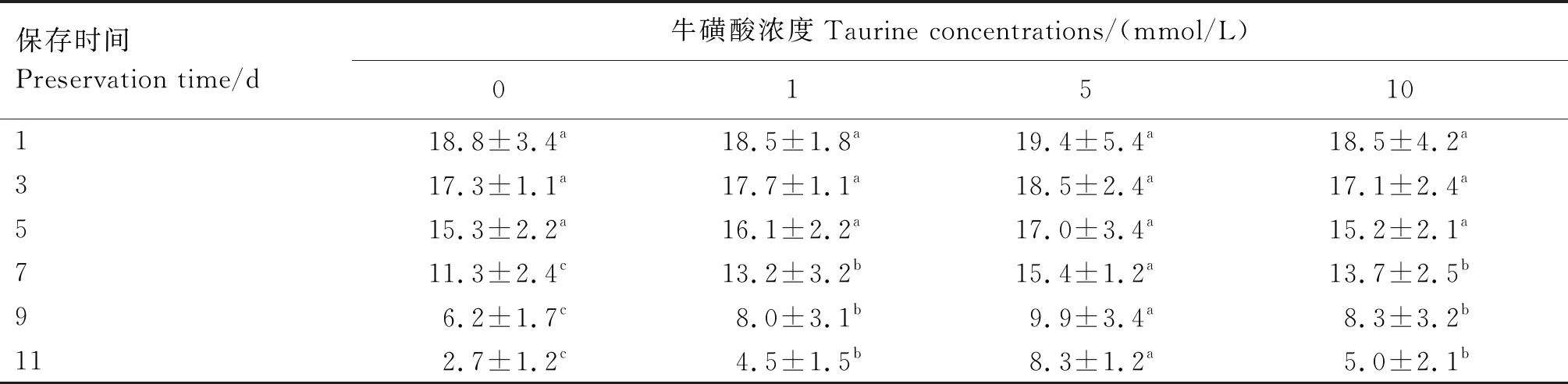
表6 不同浓度牛磺酸组猪精子BCF
2.4 不同浓度牛磺酸对精子抗氧化能力的影响
2.4.1 不同浓度牛磺酸对精子T-AOC的影响 由表7可知,第1、3、5、7、9天时,3个牛磺酸组精子T-AOC均显著高于对照组(P<0.05),其中5 mmol/L牛磺酸组精子T-AOC显著高于其他各组(P<0.05);第1、7、9天时,1与10 mmol/L牛磺酸组精子T-AOC差异不显著(P>0.05);第3、5天时,10 mmol/L牛磺酸组精子T-AOC显著高于1 mmol/L牛磺酸组(P<0.05)。

表7 不同浓度牛磺酸组猪精子T-AOC
2.4.2 不同浓度牛磺酸对精子H2O2含量的影响 由表8可知,第1、3天时,所有处理组间精子H2O2含量均无显著差异(P>0.05);第5、7、9、11天时,3个牛磺酸组间精子H2O2含量均显著低于对照组(P<0.05);第9天时,5 mmol/L牛磺酸组精子H2O2含量显著低于1与10 mmol/L牛磺酸组(P<0.05);第11天时,5 mmol/L牛磺酸组猪精子中H2O2含量最低。

表8 不同浓度牛磺酸组猪精子H2O2含量
3 讨 论
3.1 不同浓度牛磺酸对精子活力、活率及畸形率的影响
精子的活力及活率是评定精液品质的重要直观指标之一,畸形率可反映精子的运动与受精能力,其中尾部畸形如打结、缠绕、卷曲等对精子的影响最为明显。Rezaee等[11]研究发现,牛磺酸呈浓度正依赖性地改善了双酚A(BPA)诱导的氧化应激小鼠的精子活力、活率及运动速度。本试验使用的负压处理经相关试验证明能够有效减弱精子的活动强度,并通过与各类抗氧化剂协同处理,进一步提升猪精液常温保存质量。Li等[9]研究表明,负压处理能够有效提升猪精液在17 ℃保存时的活力,同时延长了保存时间。Perumal等[12]报道,牛磺酸可有效提升5 ℃保存的大额牛精子的活力及活率,牛精子相较于猪精子对低温具有更强的抵抗能力,同时遭受冷打击的程度也较低。Aly等[13]研究发现,牛磺酸可以改善由硫丹造成的大鼠睾丸重量下降与精子活力降低,对ROS造成的谷胱甘肽过氧化物酶(GSH-Px)及超氧化物歧化酶(SOD)活性减弱具有改善作用。研究表明,100 mmol/L的牛磺酸反而会降低精子活力,可能是由于较高的浓度改变了精子质膜的通透性并破坏了精子结构,因此不能通过直接提高浓度的方式改善牛磺酸对精子的常温保存效果[14],本试验中10 mmol/L牛磺酸组的猪精子的活力及活率出现一定程度的下降,推测其原因可能与此有关。本研究结果表明,向Modena稀释剂中添加5 mmol/L牛磺酸对负压保存猪精子的活力及活率均有良好改善作用,结果与谢东淇等[15]研究一致。本试验中牛磺酸对精子畸形率的改善作用较为明显,但牛磺酸各添加组间差异在试验1~9 d时不明显。5 mmol/L牛磺酸对精子畸形率有较好的抑制作用,但牛磺酸对精子畸形率的最长抑制时间及相关作用机制仍有待进一步研究。
3.2 不同浓度牛磺酸对精子动力学参数的影响
VAP、VCL是评价精子运动性能的关键指标,与受精能力成正比,BCF也与精子品质存在密切关系[16-17]。精子的各项动力学参数在保存过程中会不可避免地发生下降,目前向稀释剂中添加的各类抗氧化物质主要目的是使这种趋势减缓,以达到延长保存时间的目的。猪精子质膜的特殊成分比例导致其对氧化应激的抵抗力较差,极易造成VAP、VSL、BCF等动力学参数的降低,进而削弱其与卵母细胞的结合能力。牛磺酸的抗氧化能力已经得到广泛验证,本试验向Modena稀释剂中添加牛磺酸有效减缓了猪精子各项动力学参数的降低情况,保证了其在人工授精(AI)时仍具有一定的穿卵动力。Slanina等[18]研究表明,牛磺酸对常温保存火鸡精子VCL具有显著改善作用。张柳明[14]研究发现,20 mmol/L牛磺酸可以在一定程度上改善常温保存湖羊精子的VAP、VCL等运动性能参数。本研究结果显示,5 mmol/L牛磺酸对常温下负压保存猪精子的VAP、VCL及BCF指标均有显著改善作用,能够在一定程度上提高精子活性与受精能力。但陈宠霞等[19]发现,10 mmol/L牛磺酸对液态保存下家兔精子VAP指标具有一定的改善作用。说明牛磺酸对精子的动力学参数具有改善作用,但各物种精液保存的最适牛磺酸浓度存在差异,仍需进一步研究与探讨。
3.3 不同浓度牛磺酸对精子抗氧化能力的影响
T-AOC是反映机体抗氧化系统对自由基清除能力的重要指标之一,H2O2作为非自由基ROS的重要组成部分可诱导细胞发生氧化应激[20-21]。线粒体作为精子运动的动力源,其功能强弱直接影响了精子运动性能的高低,并进一步决定了精子的受精能力。细胞线粒体同时也是产生超氧化物的主要来源,精子在遭受氧化应激后诸如Bcl-2相关X蛋白(Bax)等促凋亡因子将导致细胞色素C(CytC)由线粒体释放入胞质,激活Caspase级联反应并最终发生细胞凋亡[22]。虽然本试验中牛磺酸表现出了良好的抗氧化能力,但牛磺酸保护线粒体免受氧化应激的潜在机制仍不清楚[23]。研究表明,牛磺酸不直接参与ROS的清除,但可通过促进细胞内还原型谷胱甘肽(GSH)的生成以降低氧化应激水平[24]。Wang等[25]发现,牛磺酸可经由肿瘤抑制蛋白53/细胞周期检测点激酶1(p53/Chk1)途径有效保护紫外线处理的培养细胞免受氧化应激。Lou等[26]研究证实,牛磺酸通过Wnt/β-连环蛋白(Wnt/β-catenin)通路对H2O2介导的成骨细胞氧化损伤产生显著保护作用,本试验中牛磺酸能够抑制猪精液中H2O2含量的增加,通过降低精子的氧化压力有效提升了猪精液的常温保存质量。Balamurugan等[27]通过负压技术减少精液稀释剂中的溶解氧含量后,显著降低了冷冻保存水牛精子的ROS与LPO水平,本试验中采用的负压保存技术虽与此技术路线不同,但也在一定程度上降低了精子外环境中的氧含量,对猪精子常温保存具有积极意义。本研究结果显示,负压条件下5 mmol/L牛磺酸组精子的T-AOC及H2O2含量2项指标均优于其他处理组,这与刘琦[28]研究结果一致。本试验中T-AOC在试验周期内衰减速度较快,在11 d时几乎检测不到,推断牛磺酸可能对猪精子T-AOC的维持有一定局限,因此在负压条件下添加牛磺酸常温保存猪精子的适宜时间为9 d以内。
4 结 论
本研究结果表明,负压条件下稀释剂中添加5 mmol/L牛磺酸提高了常温保存猪精子的活力及活率,并降低了畸形率,改善了精子的VAP、VCL及BCF等动力学参数,在一定程度上提升了精子的T-AOC并显著降低了H2O2含量,且5 mmol/L牛磺酸在负压条件下常温保存猪精液9 d以内效果最佳。
