关中奶山羊睾丸不同发育阶段代谢物的差异分析
2022-09-22邹家浩张永涛李德娴李雪清余梦琦袁宇欣
王 广,邹家浩,张永涛,李德娴,李雪清,余梦琦,陈 璐,袁宇欣,李 广
(西北农林科技大学动物科技学院,奶羊产业技术创新实验室,杨凌 712100)
睾丸作为雄性性腺,具有生精和内分泌作用,其功能障碍易造成性功能减退或不育[1],一方面导致公畜繁殖力低下,生产效益降低;另一方面,也会引起雄性不育。影响关中奶山羊生殖功能的因素较多,布氏杆菌病、空气污染、电离辐射、慢性炎症、睾丸炎等均有生殖毒性,可影响关中奶山羊的生殖器官和精液品质,最终导致不育,从而极大程度上制约了关中奶山羊的精准繁育。近年来,随着分子细胞生物学技术的发展及其在生殖医学领域的广泛应用,包括睾丸功能在内的雄性生殖生理研究有了长足的发展,一些以前无法确诊的疾病找到了病因,雄性不育的治愈率也有所提升。但是目前睾丸功能的检查技术主要包括形态检查、睾丸活检和透光试验等[1-2],过程较为复杂,也缺乏相应的生物标志物,使其在临床实践中的应用受到了很大的限制。代谢组学是探究代谢物动态变化与疾病发生关系的一门新兴学科,代谢物作为生化反应的终点,体现了生物功能的最终效应,直接指示异常的生理状态,可作为疾病发生的标志物[1,3]。利用代谢组学研究睾丸的生理病理特征,不仅可以促进雄性生殖生理的研究,而且可以加快睾丸生物标志物的筛选,有利于促进相关疾病的诊治。通过代谢组学研究发现,在睾丸支持细胞中烟碱酸、烟酰胺、肉碱、磷酸腺苷、谷氨酰胺均有显著变化[4-5],在不孕症患者精液中乙酰肉碱、胞苷和尿苷水平显著降低,溶血磷脂和溶血磷脂酰乙醇胺水平显著上升[1,6-7]。Ebrahimi等[8]采用NMR和HPLC技术对口服东革阿里后大鼠的精子数量进行代谢组学分析发现,在精子数量增加的大鼠尿液中检测到较高浓度的丙氨酸和葫芦巴碱,而乙醇浓度显著降低,东革阿里中的苦味素通过增强睾丸间质细胞睾酮类固醇生成或降低乙醇含量来促进精子发生。
睾丸的发育是一个渐进的生理过程,睾丸是雄性畜禽最重要的生殖器官之一,其发育进程与精子发生过程密切相关。关中奶山羊是陕西关中地区的优良奶山羊品种,关中奶山羊一般在1月龄断奶,在24月龄达到体成熟;1月龄曲精细管内生殖母细胞排列疏松,精母细胞尚未形成,24月龄各级精母细胞、精子大量形成,精母细胞附于基膜。在生产实践中,关中奶山羊睾丸发育不良往往产生少精、弱精、畸形精和无精症状,给关中奶山羊产业带来很多不必要的损失。目前,从代谢组学角度探讨关中奶山羊睾丸发育代谢机制的研究较少。鉴于此,本试验采用非靶向代谢组学(液相色谱-质谱(LC-MS))技术对断奶期(1月龄)和体成熟期(24月龄)的关中奶山羊睾丸组织进行了代谢组学比较分析,以期从代谢组学方面揭示关中奶山羊睾丸的发育机制,为今后深入探究睾丸正常生精功能的维持、繁殖障碍疾病的诊断和治疗提供参考。
1 材料与方法
1.1 材料
选取同一养殖环境下1月龄(G1组)和24月龄(G24组)健康的雄性关中奶山羊共12只,每组6只,用手术去势法分别采集睾丸组织,立即用生理盐水洗去表面血渍,并将提取好的睾丸组织放入灭菌瓷盘中,于超净台下对睾丸组织进行切割,将处理好的睾丸样本迅速放入预冷好的、无酶的、耐―196 ℃超低温的10 mL冻存管内,将封装好的睾丸样本冻存管投入液氮速冻3 h后取出,放入―80 ℃保存备用,将其中来源于相同年龄段的6个睾丸组织样本,视为生物学重复。
1.2 方法
1.2.1 样品前处理 使用天平精确称取30 mg组织样品放入1.5 mL EP管内,加入20 μL内标(L-2-氯苯丙氨酸,0.3 mg/mL,甲醇配制),加入400 μL甲醇-水溶液(CH3OH∶H2O=4∶1,V/V),加入2个小钢珠,―20 ℃预冷2 min后,放入研磨机中研磨(60 Hz,2 min);冰水浴超声萃取10 min,―20 ℃静置10 min;4 ℃、13 000 r/min离心10 min,取300 μL上清液装入LC-MS进样小瓶中挥干;用300 μL甲醇-水溶液(CH3OH∶H2O=1∶4,V/V)复溶(涡旋30 s,超声3 min);―20 ℃静置约2 h;4 ℃、13 000 r/min离心10 min,用注射器抽取150 μL上清液,通过0.22 μm的有机相针孔过滤器过滤后,移送到LC进样小瓶,完成LC-MS分析;质控样本(QC)由每个样品的提取液等体积混合后配制而成,每个QC的总体积与样品大小一致,且每个提取试剂使用前均在―20 ℃进行预冷。
1.2.2 代谢组学数据采集 本研究使用由Dioex U3000与UHPLC超高效液相串联QE plus超高液相质谱仪所构成的液质联用体系,并配备了加热电喷雾离子源ESI(赛默飞世尔科技公司),样品质谱信息收集部分使用ESI正负离子扫描模式。色谱柱条件:色谱柱为ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm),柱温为45 ℃,流速为0.35 mL/min,进样容积2 μL,流动相A为水(含0.1%甲酸),流动相B为乙腈(含0.1%甲酸)。通过梯度式洗脱程序实现分离:5% B 0.01 min;5% B 2 min;30% B 4 min;50% B 8 min;80% B 10 min;100% B 14 min;100% B 15 min;5% B 15.1 min;5% B 16 min。全部样品分析过程中保持在4 ℃,质量范围在100~1 000质荷比(m/z)。全谱扫描的分辨率为70 000,HCD质谱/质谱扫描的分辨率为17 500,浏览碰撞能量分别设为10、20和40 eV。
质谱仪的工作方式为:喷雾电压为3 800 V(+)和3 200 V(-),护套气流量,任意40个装置;辅助气流量,任意8个单元;毛细血管温度为320 ℃;探针加热器温度为350 ℃;S-透镜射频电平为50 Ω。在整个分析过程中,定期为每个样本注射QC,为每个样本提供一组数据,从而可以评估可重复性。
1.3 数据统计分析
原始LC-MS数据由Progenesis QI v 2.3软件处理(纽卡斯尔非线性动力学公司),用于基线滤波、峰值识别、积分函数、保留时间校准、峰值校准和标准化。主要参数为:5 ppm前体耐受性、10 ppm产物耐受性和5%产物离子阈值。化合物鉴定采用了精确的质荷比、二级片段和同位素分布,使用人代谢组数据库(HMDB)、Lipidmaps v 2.3、Metlin、EMDB、PMDB和自建数据库进行定性分析。通过去除组中50%的缺失值(离子强度=0)的任何峰,将零值替换为最小值的1/2,并通过对化合物的定量分析结果进行检测,以进一步处理提取的数据,结果总分低于36分(满分60分)的化合物也被视为不准确并被删除。数据矩阵由正、负离子数据组合而成。
将所得数据矩阵输入SIMCA 14.0软件系统(Umetrics AB公司)完成模式识别,先使用无监督的主成分分析(PCA)来研究各样品中间的总体布局和整体解析流程的运动稳定性,再使用有监督的偏最小二乘法分析(PLS-DA)、正交偏最小二乘法分析(OPLS-DA)来区分各组所有中间代谢结构轮廓的总体差异性,从而发现2组的差异代谢物。根据Fiehn数据库对代谢物进行分配,并计算2组差异代谢物的FoldChange值,经过log2转换后,log2FoldChange>0表示上调,log2FoldChange<0表示下调;通过-log10P-value计算自由差异代谢物的原始P值,-log100.05=1.30,-log10P-value>1.30为显著性差异,-log10P-value<1.30为无显著性差异。试验通过多维和单维分析方法相结合的方式来检测区域间的不同代谢物,利用Pearson相关系数衡量不同代谢物间的线性相关程度,并对差异代谢物进行通路富集分析,检测准则为:OPLS-DA模型第一主成分的VIP值>1,t检验的P<0.05。
2 结 果
2.1 多元统计分析

表1 G1和G24组间多元统计分析结果
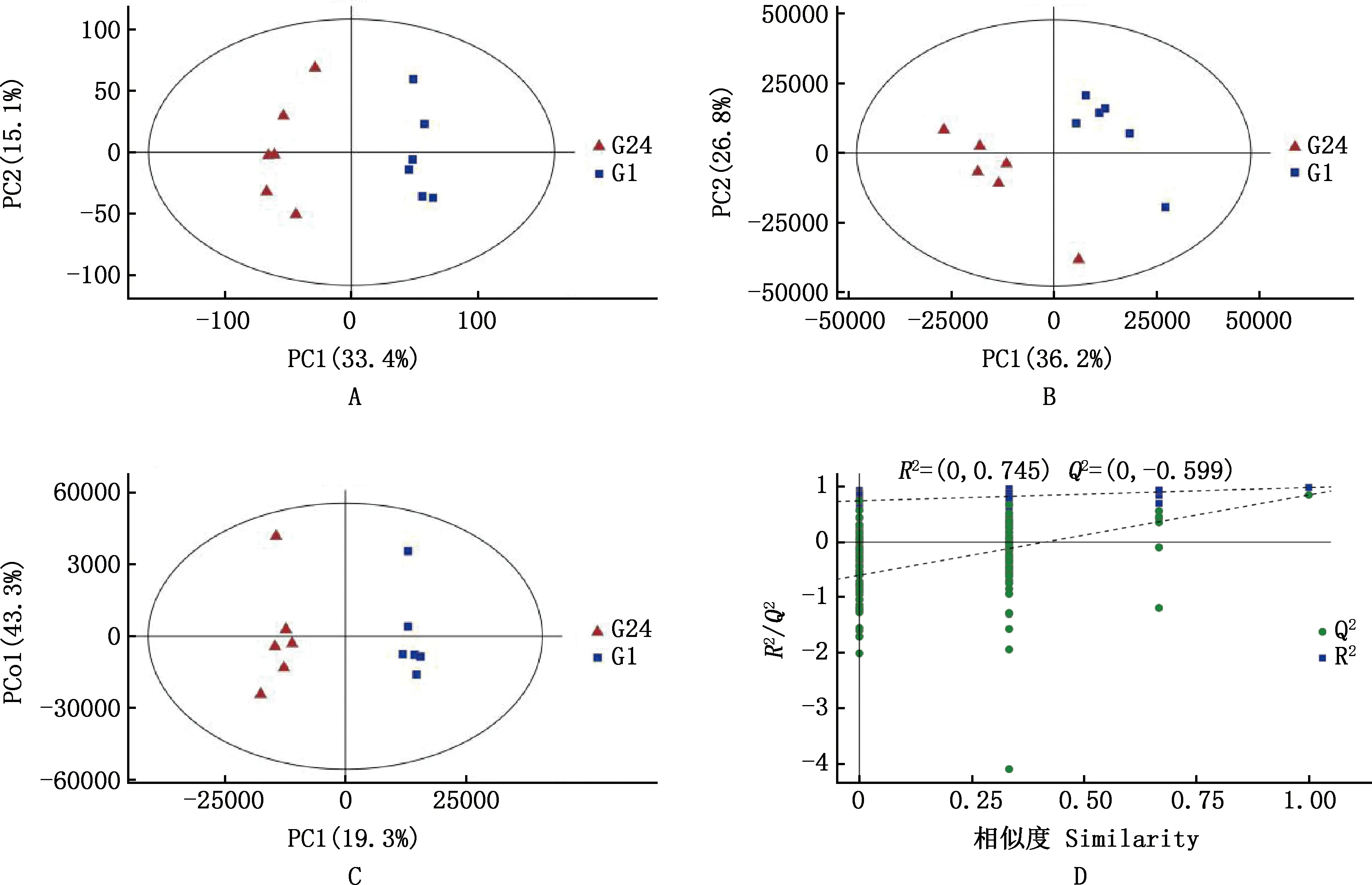
A,PCA得分图;B,PLS-DA得分图;C,OPLS-DA得分图;D,响应排序检验图
2.2 单变量统计分析
由图2可知,右边矩形区域的点表示代谢物表达上调,左边矩形区域的点表示代谢物表达下调,下方矩形区域的点表示代谢物表达没有显著性差异,在1(G1)和24(G24)月龄关中奶山羊睾丸组织中共筛选出334个差异代谢物,其中137个显著上调,197个显著下调(图3)。
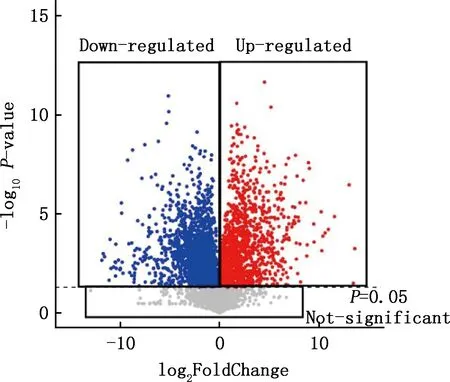
图2 所有代谢物的火山图
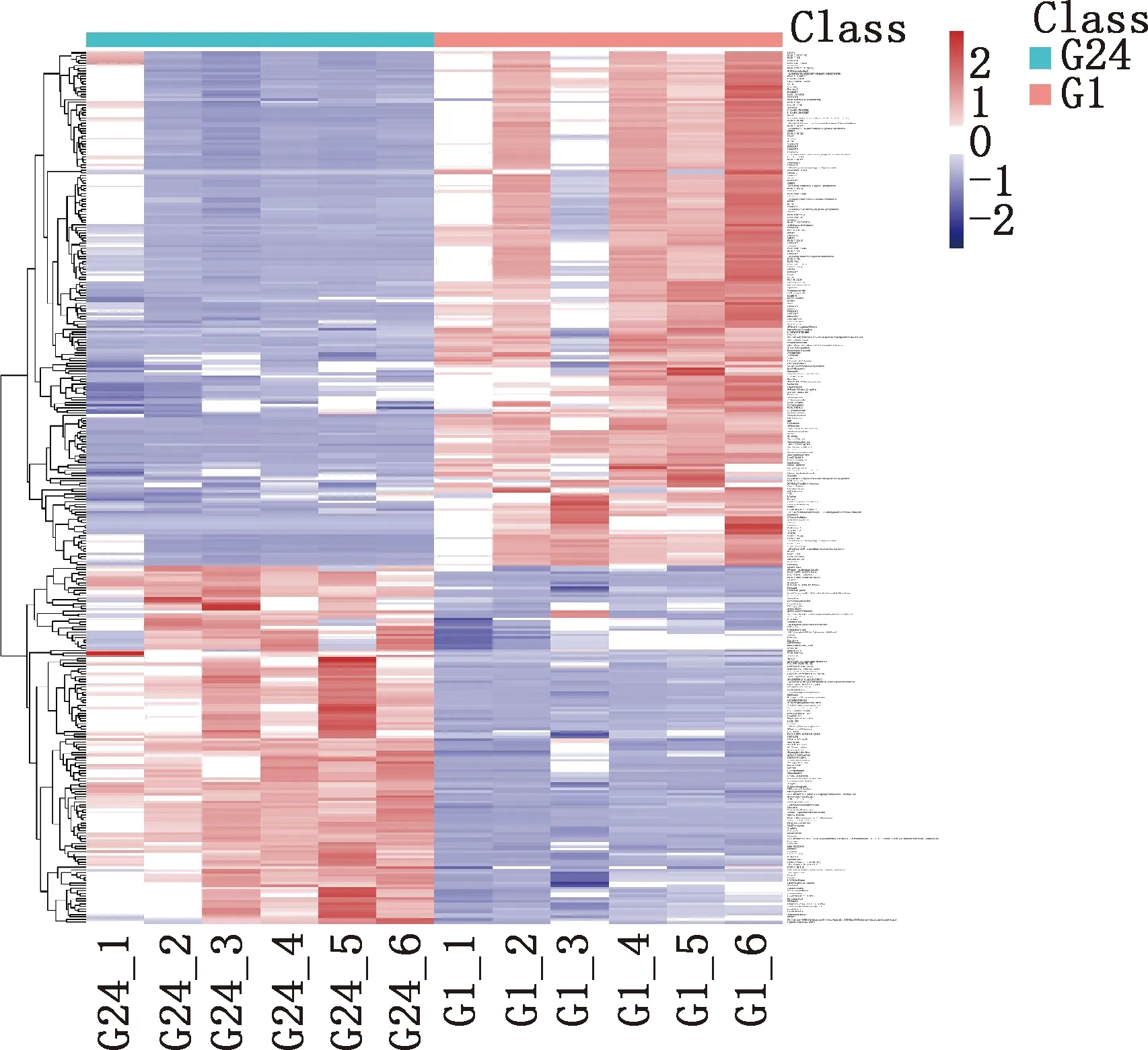
图3 所有代谢物的层次聚类分析热图
2.3 差异代谢物的筛选与鉴定
通过OSI/SMMS结合HMDB、Lipidmaps和Metlin三大数据库来确定差异代谢物,通过差异代谢物热图、VIP及P值筛选差异代谢物火山图,选出前36个差异代谢物,G1和G24组差异代谢物主类包括21个脂质和类脂质分子、6个有机酸及其衍生物、6个未分类的衍生物、3个苯丙烷和聚酮化合物。其中,脂质和类脂质分子包括16个甘油磷脂、2个鞘脂、2个脂肪酰基、1个聚酮化合物;有机酸及其衍生物包括4个羧基及其衍生物、1个有机杂环化合物、1个有机氮化合物;未分类的衍生物包括6个无类别的化合物;苯丙烷和聚酮化合物包括1个3,4-二氢香豆素、2个肉桂酸及其衍生物(表2)。
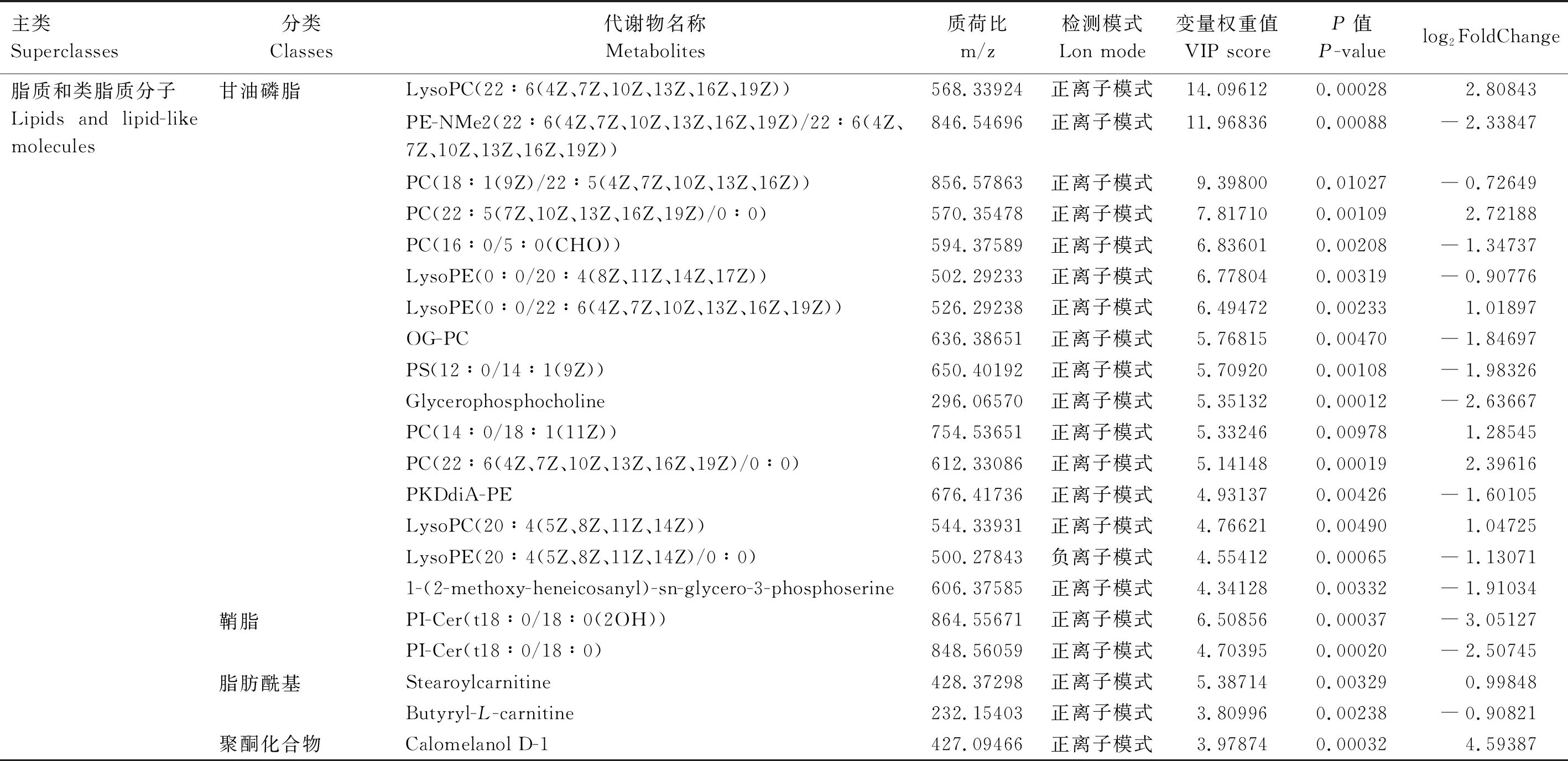
表2 G1和G24组前36种显著差异代谢物
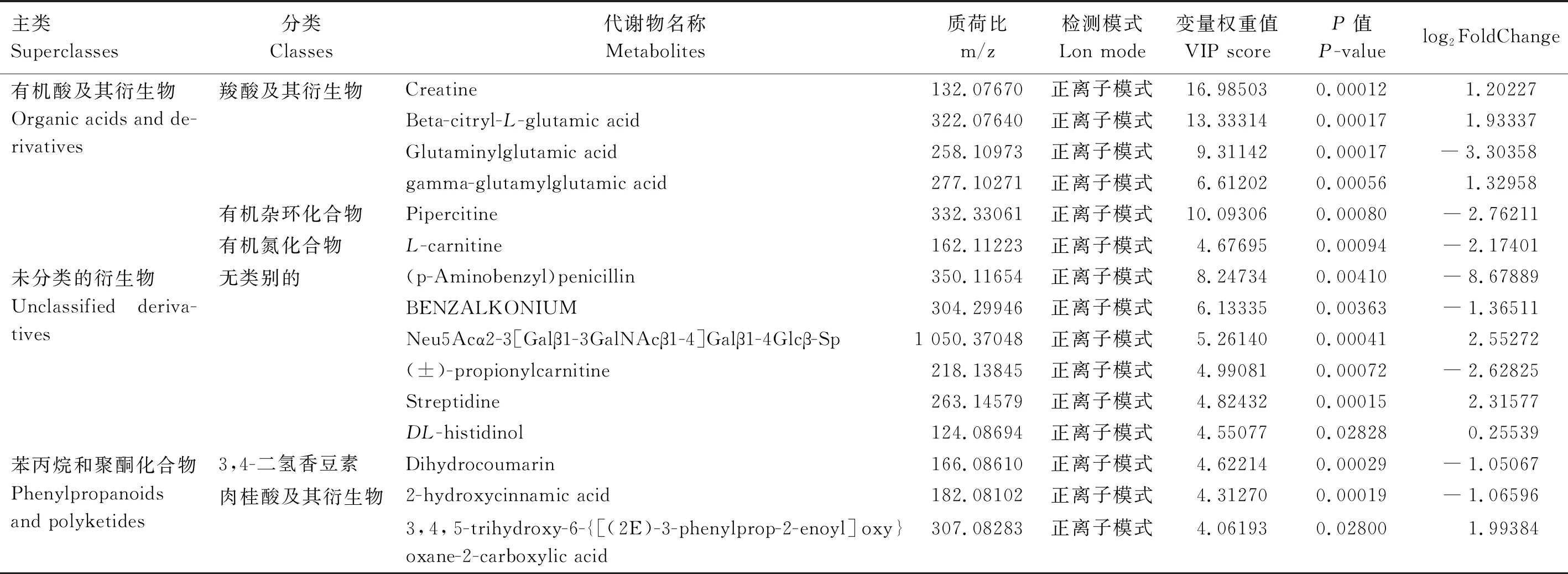
续表
2.4 差异代谢物的相关性分析
利用Pearson相关系数可以衡量2个代谢物之间的线性相关程度,根据VIP值大小选取前50个差异代谢物进行可视化分析1和24月龄关中奶山羊睾丸代谢物之间的相关性,范围为―1.0(最大负相关)~1.0(最大正相关),0表示没有相关性。由图4可知,在1和24月龄关中奶山羊睾丸发育过程中,脂质和类脂质分子与甘油磷脂呈最大正相关,羧基及其衍生物与甘油磷脂呈最大负相关。

矩形外,正相关;矩形内,负相关;不同大小的圆圈表示Pearson系数的相关性
2.5 代谢通路的富集分析
通过对前20个差异代谢物的KEGG ID与代谢物生物学(MBROLE)途径分析,富集了睾丸组织发育代谢过程中潜在的差异代谢通路。由图5可知,-log10P-value>1.5的代谢通路是试验中最关键的通路,在这些代谢途径中,生物模块参与的极显著代谢通路有7条,分别为肿瘤中的胆碱代谢、精氨酸和脯氨酸代谢、肿瘤中的中心碳代谢、精氨酸生物合成、铁死亡、GABA能突触和蛋白质消化吸收(P<0.01);生物模块参与的显著代谢通路有11条,分别为D-谷氨酰胺和D-谷氨酸代谢、谷胱甘肽代谢、近端小管碳酸氢盐再生、氨酰-tRNA生物合成、甘油磷脂代谢、ABC转运蛋白、牛磺酸和亚牛磺酸代谢、氨基糖和核苷酸糖代谢、丙氨酸、天冬氨酸和谷氨酸代谢、mTOR信号通路和细胞凋亡(P<0.05)。
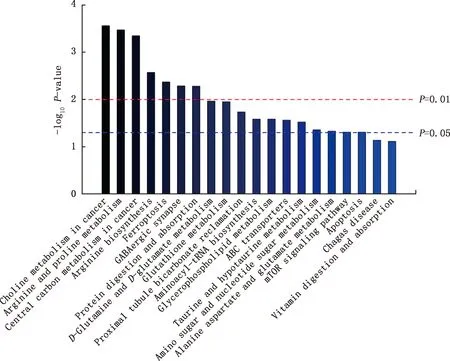
图5 前20条代谢通路富集图
经差异代谢物富集分析,从1和24月龄关中奶山羊睾丸发育代谢通路发现7条关键通路,分别为肿瘤中的胆碱代谢、精氨酸和脯氨酸代谢、肿瘤中的中心碳代谢、铁死亡、谷胱甘肽代谢、氨酰-tRNA生物合成、牛磺酸和亚牛磺酸代谢(表3)。
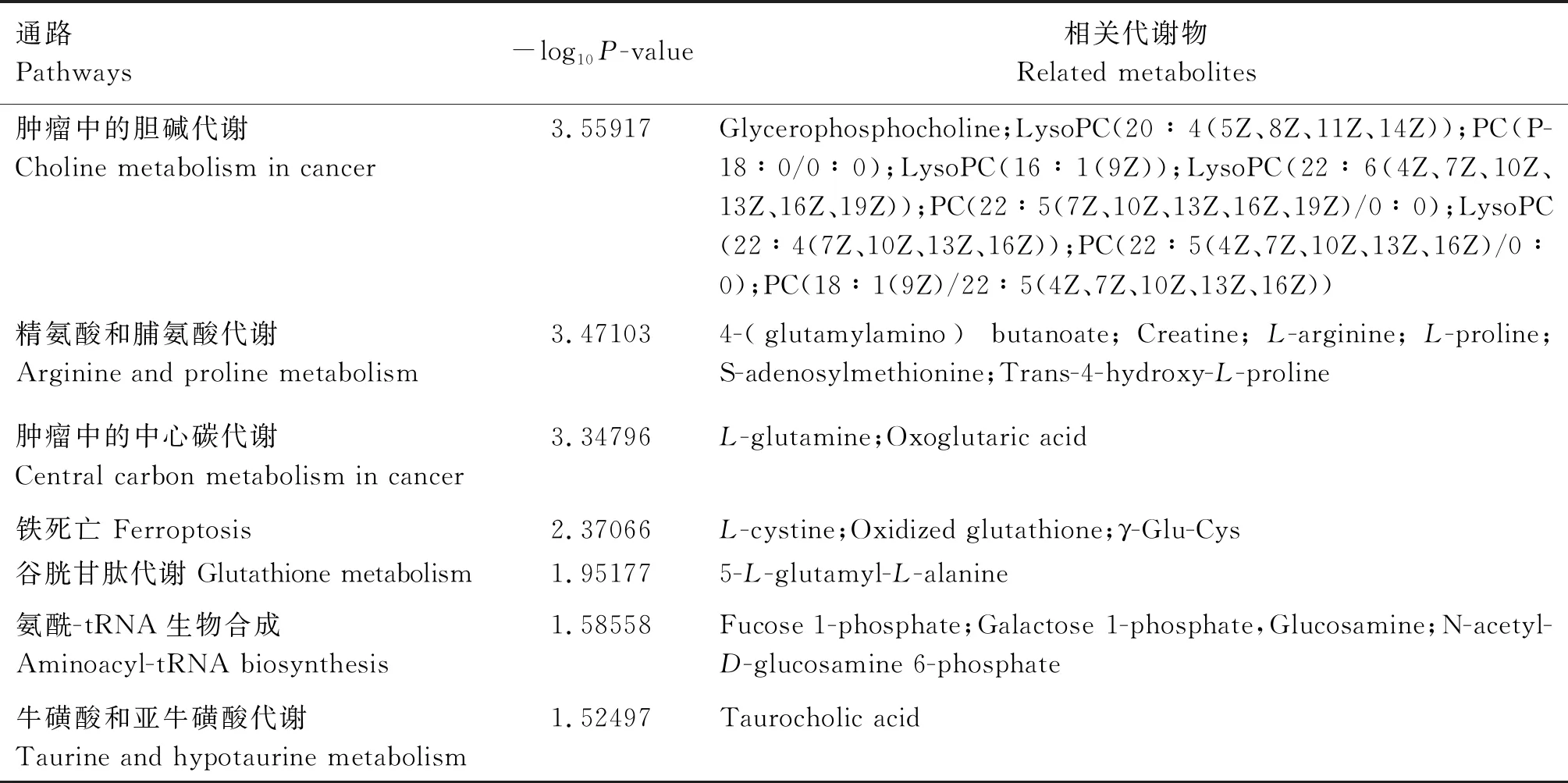
表3 G1和G24组睾丸发育代谢的潜在通路
3 讨 论
睾丸的生长发育和功能完善受到体内外许多重要因素的影响,如哺乳动物的遗传特点、饲养管理方式、营养水平和内分泌代谢方式等,而这些因素的改变通常都会通过作用于机体的重要基因而起到生物学作用[9-10]。本研究发现,睾丸生长发育成熟、功能完善前后的代谢物有显著变化。基因组组学和蛋白质组学分别是从基因和蛋白质层面探寻生命的活动,而实际上细胞内许多生命活动是发生在代谢物层面的[11],如细胞信号释放、能量的传导、细胞间通信等都是受代谢物控制的。代谢组学是继基因组研究和蛋白质组学后新发展起来的又一个学科,是系统生理学的主要部分,之后得以快速发展和渗入许多应用领域,如动物健康及其发育机理等。代谢组学中最常见的分析方法还有核磁共振光谱(NMR)、气相色谱-质谱(GC-MS)和LC-MS[12-13]。通常GC-MS用于分析小分子质量的挥发性化合物,而LC-MS用于分析小分子质量的非挥发性化合物[14]。目前,LC-MS技术已是生物代谢组学分析中比较完善的技术手段之一,其对样本前处理也较为简单,且检测到的代谢物多为有机酸、氨基酸、核苷酸及某些脂类[15-16]。近年来,对睾丸的研究重点集中在小鼠、猪、牦牛和人的睾丸基因组、转录组及蛋白质组分上[17-24],但目前在关中奶山羊睾丸代谢组层面其发育机理尚不明确。
本试验分析了1和24月龄关中奶山羊睾丸生长发育过程中差异代谢物的变化,共鉴定出334个差异代谢物,组间差异均有生物学意义,其中显著上调137个,显著下调197个;进一步筛选出前36个显著差异代谢物,分别为脂质和类脂质、有机酸及其衍生物、未分类的化合物、苯丙烷和聚酮化合物四大类。其中,脂质和类脂质变量的权重数值最大,主要参与细胞外生长过程和分子物质信息的传递功能,脂质和类脂质缺失也会引起细胞膜受损,而磷脂中所含的乙酰基团深入到中枢神经细胞间隙与胆碱相互作用,从而产生乙酰胆碱,乙酰胆碱也是向各类中枢神经细胞间传送信息的重要分子物质[25],而有机酸及其衍生物则有着促进细胞生长发育的重要作用,苯丙烷的表达水平和功能直接关系到动物的免疫能力和生长发育的平衡,聚酮化合物则利用多级或级联式传递程序引发细胞的生长发育、繁殖、分裂、凋亡等生物学过程,并同时参与炎症、肿瘤等病理过程[26],此外,它还与RAS、PI3K、Akt等生物学信号系统有着广泛联系。
本研究中,在1和24月龄关中奶山羊睾丸发育过程中,脂质和类脂质分子与甘油磷脂呈最大正相关,羧基及其衍生物与甘油磷脂呈最大负相关,表明脂质和类脂质分子在睾丸发育过程中具有促进作用,羧基及其衍生物具有一定的颉颃和平衡作用,脂质和类脂质、有机酸及其衍生物、苯丙烷和聚酮化合物均能影响睾丸组织的免疫能力和生长发育的代谢。本试验富集到7条潜在的关键代谢通路,涉及氧化应激、能量代谢、细胞凋亡三大块,分别为肿瘤中的胆碱代谢、精氨酸和脯氨酸代谢、肿瘤中的中心碳代谢、铁死亡、谷胱甘肽代谢、氨酰-tRNA生物、牛磺酸和亚牛磺酸代谢。曾婷等[27]研究指出,谷胱甘肽代谢、脂质代谢和铁代谢都与铁死亡的发生密切相关。在本试验关中奶山羊睾丸发育代谢过程中,谷胱甘肽代谢通路和铁死亡通路的发生也同时存在,与前人研究结果一致。Hara等[28]研究发现,精氨酸和脯氨酸代谢过程中ArgⅡ酶表达量很少,主要在哺乳动物外周组织(包括神经元、肾脏、血管和肌肉细胞)中表达为线粒体蛋白,对一氧化氮、脯氨酸和多胺的合成具有重要的调控作用[29]。本试验中,精氨酸和脯氨酸代谢发生在睾丸组织代谢过程中,且精氨酸和脯氨酸代谢通路极显著,说明精氨酸对脯氨酸的合成有一定的调控作用。因此,在1~24月龄关中奶山羊发育代谢过程中,这7条潜在的代谢通路可为后续研究哺乳动物睾丸、精子的发育及治疗雄性繁殖障碍疾病提供参考依据。
4 结 论
本研究共筛选出334个差异代谢物,其中显著上调137个,显著下调197个;并筛选出前36种显著差异代谢物,分别为脂质和类脂质分子、有机酸及其衍生物、未分类化合物、苯丙烷和聚酮化合物四大类。对不同代谢物进行富集分析得到7条关键代谢通路,可能是睾丸发育过程的潜在代谢通路。
