miR-181a调控小胶质细胞ZEB1对缺血性脑卒中模型炎症反应机制的影响
2022-08-09柯维春苏庆杰陈向红王超
柯维春 苏庆杰 陈向红 王超
(海南医学院第二附属医院,海南 海口 570000)
缺血性脑卒中(CIS)又称脑梗死,是指脑血液循环障碍导致的神经功能缺损综合征,发病率和致死致残率极高,严重威胁人类的生命健康〔1,2〕。贾琎等〔3〕认为CIS相关发病机制与生化机制、血流动力学改变及病理生理学机制有关,血糖、血压、颈动脉粥样硬化及炎症反应等均是CIS发病的高危因素。在分子作用机制中,有研究证实急性CIS的发生发展与miRNA关系密切〔2〕。尽管如此,CIS相关机制仍未完全阐明,因此开展相关研究以进一步了解其机制具有重要的意义。锌指E盒结合同源框(ZEB)1是锌指结构转录因子家族的一员,存在与肌肉、神经系统和淋巴细胞等系统中,李道静〔4〕认为ZEB1蛋白表达可影响急性CIS后的炎症损伤机制。 本研究旨在观察CIS模型大鼠炎症反应及大脑皮层组织miR-181a和ZEB1蛋白水平变化情况,利用细胞实验分析miR-181a对小胶质细胞的调控作用,初步探讨miR-181a调控小胶质细胞ZEB1影响CIS模型炎症反应的机制。
1 材料与方法
1.1实验材料 实验细胞及动物:小胶质细胞(BV2)购自北京协和医院基础所细胞中心。清洁级健康SD大鼠36只,6~8周龄,雌雄各半,体重(285±10)g,SD大鼠购自实验中心。本实验研究通过了动物伦理。符合道德伦理要求。
实验试剂:12%水合氯醛购自青岛青尔源药业有限公司,磷酸盐缓冲液(PBS)和原位末端标记染色(TUNEL)试剂盒(购自南京凯基生物科技发展有限公司),Trizol 试剂(购自上海Invitrogen公司),PCR试剂盒(购自Promega公司),miR-181a拮抗剂(miR-181a inhibitor)、激动剂(hsa-miR-181a)及空白对照(miRNA Neg-tive Control)由上海达科为生物技术公司合成,RIPA裂解液(购自上海碧云天公司)。ZEB1一抗(批号:sc-263052,购自上海优宁维生物科技股份有限公司),NF-κB一抗(批号:XY-ABS194,购自上海熹垣生物科技有限公司),GAPDH一抗(批号:532941,购自北京中杉金桥公司)。
实验仪器:实时荧光定量PCR仪属Applied Biosystems产品,高速离心机属德国Eppendorf公司产品,电泳仪和凝胶成像系统属美国Bio-Rad公司产品 。
1.2CIS模型建立及分组 将SD大鼠进行雌雄分类后,从雌、雄两个整体中各随机选取8只大鼠分别分为对照组、假伤组和模型组,每组16只。模型组大鼠根据文献方法〔5〕建立CIS模型,具体步骤如下:用12%水合氯醛对大鼠进行麻醉后,在无菌操作台上用手术剪剪开大鼠颈部皮肤,充分暴露颈部血管,小心分离大鼠右侧颈总动脉、颈内动脉和颈外动脉,使拴线从大鼠颈外动脉残端插入颈内动脉,直至距颈外动脉与颈内动脉分叉处1.8 cm处停止。线栓停留1.5 h后拔除栓子,制备CIS模型,拔除栓子后,将大鼠尾部提起,可见大鼠左侧前肢屈曲则视为造模成功。假伤组大鼠以相同的步骤分离大鼠右侧颈总动脉、颈内动脉和颈外动脉,但不插入栓线,对照组大鼠未进行任何干预。
1.3大鼠血清高敏C反应蛋白(hs-CPR)、白细胞介素(IL)-6和肿瘤坏死因子(TNF)-α表达水平检测 抽取大鼠尾静脉血3 ml,在室温条件下以3 000 r/min转速离心10 min,分离出大鼠血清用于实验指标检测。采用免疫比浊法检测血清CRP表达水平,酶联免疫吸附试验(ELISA)检测IL-6和TNF-α的表达水平。
1.4RT-PCR检测大鼠大脑皮层组织miR-181a和ZEB1 mRNA的表达量 利用颈椎脱臼法处死各组大鼠,取大鼠大脑皮层组织约1 g置入研磨器中,加入液氮粉碎研磨,再加入组织裂解液裂解组织,采用Trizol法提取组织总RNA,检测提取RNA的浓度和纯度后,按照PCR逆转录试剂盒说明书进行逆转录反应,PCR引物:miR-181a上游:5′-GTCGTATCCAGTGCAGGGTCCGAGGTA-3′、下游:5′-TTCGCACT GGATACGACACTCACC-3′;ZEB1上游:5′-GCACAA CCAAGTGCAGAAGA-3′、下游:5′-CATTTGCAGATTGAGCTGA-3′;GAPDH上游:5′-GAAGGTGAAGGTC GGAGT-3′、下游:5′-GAAGATGGTGATGGGATTTC-3′。设置好qRT-PCR体系,设置反应条件:95℃ 5 min,95℃ 30 s,55℃ 30 s,72℃ 35 s,共40个循环。以GAPDH为内参,用2-ΔΔCt公式计算miR-181a和ZEB1 mRNA的相对表达量。
1.5Western印迹检测大鼠大脑皮层组织ZEB1蛋白表达量 利用颈椎脱臼法处死各组大鼠,取大鼠大脑皮层组织约1 g置入研磨器中,加入液氮粉碎研磨,再加入组织裂解液裂解组织,提取大脑皮层组织总蛋白,使用二喹啉甲酸(BCA)蛋白定量试剂盒对提取的总蛋白进行定量,按比例加入4×蛋白上样缓冲液,95℃变性5 min,置于-20℃保存备用。设置浓缩胶电压为80 V,分离胶电压为120 V进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转印。取聚偏氟乙烯(PVDF)膜用TBST洗膜5 min,共3次,加入到2%牛血清蛋白(BSA)Tris-HCL缓冲盐溶液(BSATBS)配制封闭液中进行封闭,室温摇床孵育2 h。洗膜后先后加入一抗工作液(ZEB1抗体)和二抗工作液,进行一抗孵育和二抗孵育。将新鲜配制的电化学发光(ECL)液滴加到PVDF膜表面,转移至成像分析系统暗箱中曝光,采集图像并分析。蛋白定量:以GAPDH为内参进行分析,以相对光密度值代表蛋白相对表达量,实验至少重复3次,实验结果取3次均值。
1.6BV2培养 取BV2进行复苏,将复苏后的细胞置于含10%胎牛血清培养基中,放入条件为5%CO2、37℃培养箱进行培养,待细胞贴壁时,每隔2~3 d传代1次,观察细胞贴壁生长且状态良好后,按1×106/ml接种于6孔板中。
1.7细胞转染 取100 μl 1×106/ml的上述细胞接种于96孔板中,分别转染miRNA Negtive Control、miR-181a inhibitor和激动剂hsa-miR-181a,分为空白对照组、抑制表达组和促进表达组,每组设立8个复孔,观察相关指标的变化。
1.8转染细胞相关指标检测 收集96孔板中的各组细胞,利用RT-PCR(方法同1.2.3)检测转染细胞miR-181a和ZEB1 mRNA的表达量,Western印迹(方法同1.5)检测转染细胞ZEB1蛋白表达量。
1.9统计学方法 采用SPSS22.0软件进行方差分析,两两比较行LSD-t检验。Kruskal-WallisH秩和检验,两两比较用Nemenyi检验,Pearson相关分析。
2 结 果
2.1各组血清炎症因子hs-CPR、IL-6和TNF-α表达水平比较 3组血清炎症因子hs-CPR、IL-6和TNF-α表达水平差异均有统计学意义(均P<0.05)。与对照组比较,假伤组和模型组hs-CPR、IL-6和TNF-α表达水平均明显升高(均P<0.05),且模型组均明显高于假伤组(均P<0.05)。见表1。

表1 各组血清炎症因子hs-CPR、IL-6和TNF-α表达水平比较
2.2各组大脑皮层组织miR-181a、ZEB1蛋白及ZEB1 mRNA相对表达量比较 3组脑组织miR-181a、ZEB1蛋白及mRNA相对表达量差异均有统计学意义(均P<0.001)。与对照组和假伤组比较,模型组miR-181a、ZEB1蛋白及mRNA相对表达量均明显升高(均P<0.05)。见图1、表2。

图1 Western印迹检测ZEB1蛋白表达

表2 各组大脑皮层组织miR-181a、ZEB1蛋白及mRNA相对表达量比较
2.3模型组大脑皮层组织miR-181a、ZEB1蛋白及mRNA相对表达量与炎症因子相关性 血清hs-CPR、IL-6和TNF-α表达与miR-181a相对表达量呈正相关(均P<0.001),与ZEB1蛋白及mRNA相对表达量呈负相关(均P<0.05)。见表3。
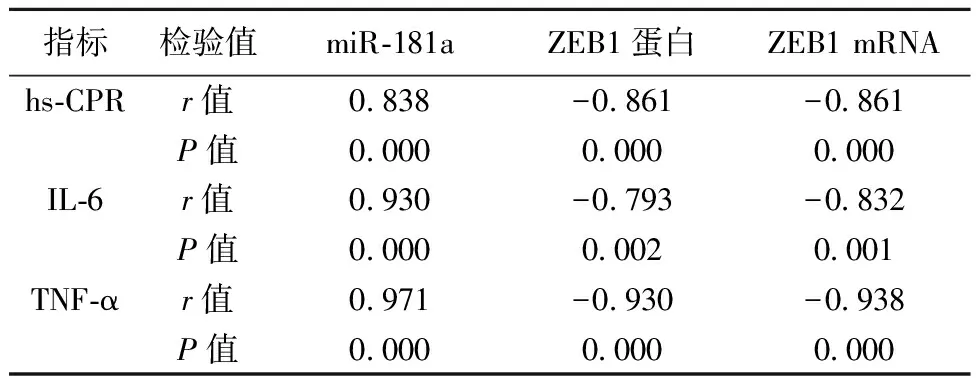
表3 模型组大鼠皮层组织miR-181a、ZEB1蛋白及mRNA表达与炎症因子相关性
2.4各组转染细胞miR-181a相对表达量 3组转染细胞miR-181a相对表达量差异具有统计学意义(P<0.05)。与空白对照组(1.04±0.07)比较,抑制表达组miR-181a相对表达量明显下降(0.59±0.05,P<0.05),促进表达组miR-181a相对表达量明显升高(2.40±0.13,P<0.05)。
2.5各组转染细胞ZEB1蛋白及mRNA相对表达量比较 3组转染细胞ZEB1蛋白及mRNA相对表达量差异均有统计学意义(均P<0.05)。与空白对照组比较,抑制表达组ZEB1蛋白及mRNA相对表达量明显升高(P<0.05),促进表达组ZEB1蛋白及mRNA相对表达量明显降低(P<0.05)。见图2、表4。
图2 Western印迹检测ZEB1蛋白表达
表4 各组转染细胞ZEB1蛋白及mRNA相对表达量比较
3 讨 论
CIS相关机制研究中,需要获取大脑皮层组织进行实验研究,而脑部是人重要中枢系统,并不能在人体上进行取材。因此,在符合伦理学的要求下可用动物模型代替,尽管人与动物基因稍有差异,但在保证动物模型发病机制与人CIS发病机制相同的情况下,动物模型用于实验研究具有重要的意义。动物模型是以适用于人体为最终目的,动物的选择及模型建立成功与否直接关乎实验成败,目前关于CIS模型建立的报道较多,研究显示猪、鼠、兔均可用于CIS模型建立〔6~8〕。本实验研究考虑大鼠容易饲养、体型适中便于手术操作及大脑皮层组织取材量较少等因素,而且采用Zea Longa线栓法制作大鼠CIS模型具有成功的先例〔5〕,因此使用SD大鼠建立模型是可行的。模型组大鼠在拔除栓子后,提起其尾部可见左侧前肢屈曲,提示造模成功,为接下来实验奠定了基础。
炎症是公认的CIS发病原因,研究显示机体发生炎症反应时大量表达各种炎性细胞因子,可加重大脑皮层组织的缺血损伤〔9〕。IL-6、TNF-α及hs-CRP作为重要的炎症指标,CIS患者的血清IL-6、TNF-α及hs-CRP水平在一定程度上可反映大脑皮层组织的损伤程度〔10~12〕。本研究结果结果提示假伤组和模型组大鼠机体内均发生炎症反应,模型组表达水平更高是由于缺血后发生脑卒中造成的。微小RNA(miRNA)可以特异性结合靶基因mRNAs的非编码区,发挥促进或抑制靶蛋白翻译的功能,调控蛋白质编码基因而影响到生物学功能〔13〕,miRNA在中枢神经系统表达丰富,并且在神经系统发育和功能上起到重要作用。研究显示miR-377基因敲除可减轻缺血性再灌注的脑损伤〔14〕,miR-940通过VEGF调节脑梗死后血管生成影响CIS模型的脑损伤〔15〕。miR-181由4种高度保守的成熟miRNA构成,主要位于3条不同的染色体上,能够启动G0/G1期,从而促进细胞的分裂和增殖〔16〕。本研究结果提示大鼠发生CIS后其大脑皮层组织miR-181a表达升高,miR-181a与CIS发生相关,这与miR-181a诱导的脑缺血再灌注损伤有关〔17〕。ZEB1在人脑胶质中高度表达,研究显示在突变的低级别胶质瘤中ZEB1表达增加〔18〕,细胞异质性与人脑胶质母细胞瘤中ZEB1亚型特异性表达有关〔19〕。另一方面,小胶质细胞ZEB1上调可减轻急性CIS后的脑损伤〔20〕。本研究结果与李道静〔4〕结果相似,提示CIS发生可促使大脑皮层组织大量分泌ZEB1。结果表明miR-181a降低和ZEB1升高对抑制炎症反应作用具有积极作用。
大脑皮质层中富含小胶质细胞,小胶质细胞被激活后有两种极化表型,即经典激活型小胶质细胞(M1型)和替代激活型小胶质细胞(M2型),分别起着促炎与抑炎的作用〔21〕。小胶质细胞作为中枢神经系统损伤的第一道防线,在激活炎症反应中起主导作用。本研究结果表明抑制miR-181a可上调ZEB1的表达。
