贝利尤单抗联合环孢素治疗难治性系统性红斑狼疮继发免疫性血小板减少1例并文献复习
2022-08-08秦梅杰田茂露杨宇齐
秦梅杰,田茂露,杨宇齐,查 艳,袁 静
(1.遵义医科大学,贵州 遵义 563003;2.贵州省人民医院 肾内科, 贵州 贵阳 550002)
系统性红斑狼疮(systemic lupus erythematosus, SLE)是一种以致病性自身抗体产生和免疫复合物形成并介导多系统损伤的自身免疫性疾病。其中,血液系统受累仅次于肾脏受累,自身免疫性血小板减少症是SLE常见的血液学表现,10%~15%的患者存在血小板减少[1],严重威胁患者生命。现报道1例难治性SLE继发免疫性血小板减少的病例,并通过相关文献探讨贝利尤单抗联合环孢素治疗SLE合并顽固性血液系统损害的临床疗效。
1 临床资料
患者女,26岁,因“皮下瘀斑伴腹痛10天”于2020-11-25入院。现病史:10天前患者无明显诱因出现全身多发皮下瘀斑,牙龈出血,剑突下疼痛、近端指间关节及腕关节疼痛,新发面部皮疹,颞部头发变少。2天前患者感剑突下疼痛加重伴心悸、乏力、恶心、呕吐胃内容物,间断发热(最高体温39.8 ℃),于2020-11-25收入院。既往史:6年前因间断发热1月余就诊于我院血液科并诊断为“成人Still病”,予口服“激素、羟氯喹”治疗,病情稳定后停药。1年余前因怀孕1月于外院妇科终止妊娠后,偶感四肢关节疼痛于我院门诊检查发现抗核抗体-核颗粒型、抗ds-DNA抗体、抗SS-A抗体等自身抗体强阳性,明确诊断“SLE”。后于我院门诊定期复诊,规律服用甲泼尼龙片8 mg ,1次/d、羟氯喹0.1 g, 2次/d,受新型冠状病毒肺炎疫情影响,最后一次门诊复诊时间为2020年7月23日,当时患者无不适,复查血常规、肝肾功能、补体正常,血沉、C反应蛋白轻度升高,继续口服激素及羟氯喹。入院体格检查:体温36.7 ℃,心率86次/min, 呼吸20次/min,血压125/76 mmHg(1 mmHg=0.133 kPa),贫血貌,颜面可见散在皮疹,全身皮肤黏膜多发皮下瘀斑,双侧颞部头发较稀疏,心肺腹查体无特殊,双下肢无水肿。辅助检查(2020-11-26):白细胞计数11.48×109/L,红细胞计数1.34×1012/L,血小板计数16.0×109/L,血红蛋白42.0 g/L,中性粒细胞百分比79.1%,中性粒细胞绝对数9.08×109/L;外周血破碎红细胞、凝血六项未见异常;C反应蛋白82.66 mg/L;总胆红素30.3 μmoL/L,直接胆红素12.0 μmoL/L,间接胆红素18.3 μmoL/L, 谷丙转氨酶及谷草转氨酶未见异常;乳酸脱氢酶982 U/L, 肌酐55μmoL/L,尿酸350 μmoL/L。床旁胸片示双肺纹理清晰,肺内未见明显实质性病变。
入院后,给予甲强龙冲击治疗3天,剂量分别为:300 mg,500 mg,800 mg、口服环孢素75 mg, 2次/d、口服硫酸羟氯喹片0.2 g, 2次/d、酚磺乙胺止血、保护胃黏膜等治疗,并密切监测生命体征。动态复查相关检验指标:白细胞计数10.27×109/L,红细胞计数1.57×109/L,血红蛋白51.0 g/L, 血小板计数5.0×109/L,血沉25.00 mm/小时,补体C3 0.85 g/L,补体C4 0.14 g/L,24小时尿蛋白0.11 g,抗人球蛋白抗IgG阴性(-),抗人球蛋白抗C3阴性(-),狼疮抗凝物、抗心磷脂抗体IgG、IgM(-),抗SS-A抗体阳性(+++),抗ds-DNA抗体1∶10,Ro-52阳性(+++),抗SS-B抗体阳性(++),抗Scl-70抗体弱阳性,抗组蛋白抗体弱阳性,抗线粒体M2型抗体弱阳性,抗核抗体-核颗粒型1∶3 200,抗核抗体-胞浆颗粒型1∶100;抗中性粒细胞胞浆抗体阴性,行SLE疾病活动型指数(SLEDAI-2000)评分为14分(低补体、抗ds-DNA抗体阳性、血小板减低、脱发、关节痛、皮疹、发热)。入院时患者及家属表示既往骨髓穿刺排除原发性骨髓病变,诊断SLE,拒绝行骨髓穿刺检查。为避免延误救治,患方知情同意后,针对SLE危象立即启动激素冲击联合环磷酰胺及人免疫球蛋白静脉滴注方案治疗。给予静脉输注环磷酰胺0.4 g,并输注人免疫球蛋白20 g连续5天调节免疫。激素冲击治疗3天后,甲强龙调整为40 mg/d, 静脉滴注,并输注洗涤红细胞及血小板对症改善贫血及血小板减低。
2020-11-30(入院第5天)复查白细胞计数11.68×109/L,红细胞计数1.80×1012/L,血红蛋白60.0 g/L,血小板计数6.0×109/L,于2020-12-01(入院第6天)开始配合使用血浆置换辅助治疗共4次,清除循环中异常自身抗体,皮下注射重组人血小板生成素7 500 U共3次。经积极治疗8天,疗效不佳,考虑难治性SLE合并血液系统损害。
因一线药物疗效不佳,于2020-12-04(入院第9天)排除生物制剂禁忌后,予利妥昔单抗500 mg静脉滴注以诱导B淋巴细胞凋亡。2020-12-07(入院第12天)复查血小板计数14.0×109/L,2020-12-09(入院第2周)复查血小板计数11.0×109/L,示顽固性血小板减低,对激素、环磷酰胺、环孢素、丙种球蛋白及血浆置换等多种治疗手段短期应答不佳,遂行骨髓穿刺细胞学检查,髓象:①增生活跃;②粒系百分率增高,形态大致正常;③红系百分率减低,少数成熟红细胞嗜多色性红细胞,个别泪滴状红细胞及盔形红细胞,可见红细胞碎片(占3.5%);④淋巴百分率减低,形态大致正常;⑤全片未见巨核细胞,血小板散在少见。外周血象:①白细胞总数大致正常;②粒细胞百分率增高, 见个别幼稚粒细胞;③成熟红细胞形态同骨髓所见;④淋巴百分率减低,形态大致正常;⑤血小板散在少见。未见血液系统肿瘤等原发性血液系统疾病所致血小板减少表现,随即开始第2轮激素冲击治疗,甲强龙500 mg,连续3 d。患者血小板重度减低,随时可能出现颅脑及内脏出血而危及生命,治疗过程中应答不佳。患者卧床状态,间断咳嗽,考虑为感染高风险人群,与患者及家属沟通暂停环磷酰胺,并于2020-12-15将利妥昔单抗更换为相对安全的贝利尤单抗(10 mg/kg, 前3次每2周给药1次,随后每4周给药1次),用药3 d后复查:白细胞计数10.03×109/L,血红蛋白86.0 g/L,血小板计数33.0×109/L,予出院(图1)。嘱患者离院后卧床休息,避免光晒、劳累、情绪激动等加重疾病的诱因,切忌自行停药或减量,每半月复查血常规、补体等相关指标。
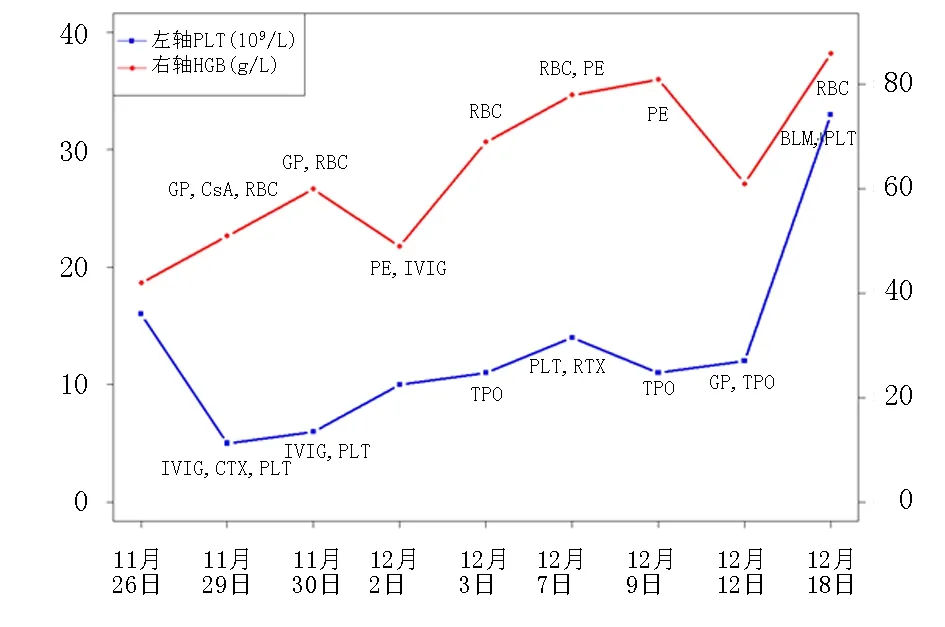
图1 住院期间血红蛋白、血小板变化情况 注:GP:激素冲击;CsA:环孢素;IVIG:免疫球蛋白;CTX:环磷酰胺;PE:血浆置换;TPO:血小板生成素;RBC:输注红细胞;PLT:输注血小板;RTX:利妥昔单抗;BLM:贝利优单抗
患者离院后,规律输注贝利尤单抗,于2021-12-30(第1次返院)复查白细胞计数8.49×109/L,血红蛋白135.0 g/L,血小板计数292.0×109/L,补体C3 1.29 g/L,补体C4 0.27 g/L(后期随诊见图2)。现维持使用甲泼尼龙片2 mg, 1次/d,硫酸羟氯喹片0.2 g, 1次/d,环孢素25 mg 1次/d,贝利尤单抗在病情稳定9个月后,因经济原因由每4周给药1次调整为8周1次,规律监测,患者病情控制良好,未出现感染、高血压、血糖异常等不良反应。
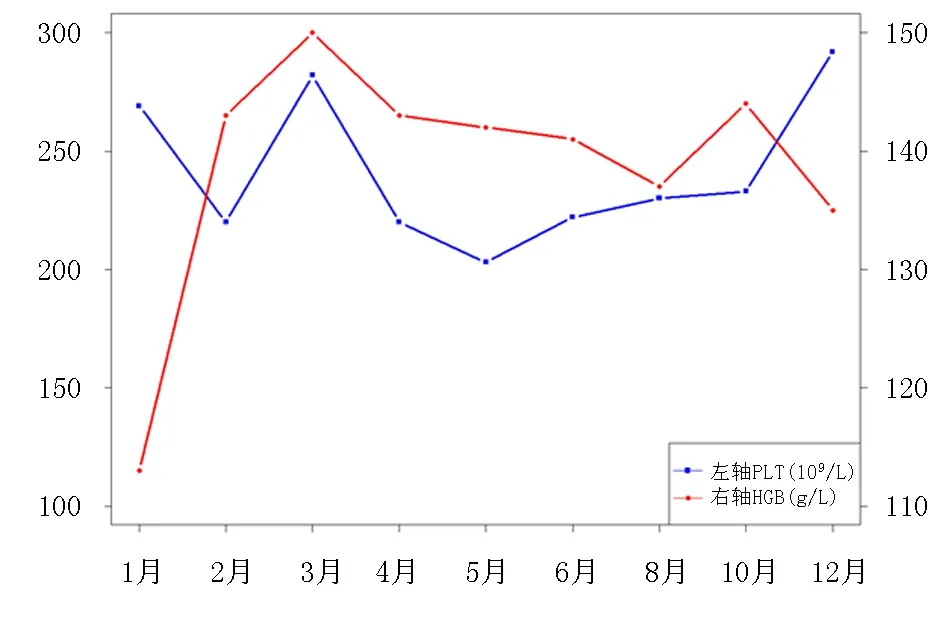
图2 2021年随访期间血红蛋白、血小板变化情况
2 讨 论
SLE是一种以多系统受累为临床特征的自身免疫性疾病,10%~15%的SLE病例出现血小板减少[1],但导致血小板减少的机制尚未明确。有研究表明,体液免疫及细胞免疫均参与SLE合并血小板减少的发病过程[2]。Baroni等[3]认为外周血小板的清除和血小板生成障碍可能是导致SLE患者血小板减少的原因之一。临床上,我们将对多种药物治疗效果不佳甚至无效的SLE继发血小板减少称之为难治性SLE继发血小板减少[4]。《2020中国系统性红斑狼疮诊疗指南》指出[5],在明确SLE合并血液系统损害的情况下,应尽早予大剂量糖皮质激素冲击治疗,效果不佳者,可加用免疫抑制剂,包括环磷酰胺、硫唑嘌呤、环孢素和霉酚酸酯。但存在危及生命的出血或血小板计数严重减低的患者的治疗反应差异很大[6]。利妥昔单抗是一种消耗B淋巴细胞的抗CD20单克隆抗体,低剂量利妥昔单抗治疗SLE合并重度难治性血小板减少症的缓解率达80%,可有效改善患者预后[7-8],所以在上述治疗均无明显改善或存在危及生命的血液系统损害时,使用利妥昔单抗是一种安全、经济、有效的治疗措施[5-6]。
SLE患者清除异常B细胞的能力遭到了破坏,异常B细胞得以存活而致病。增殖诱导配体(a proliferation-inducing ligand, APRIL)和B淋巴细胞刺激因子(B lymphocyte stimulator, BLyS)是B细胞分化成熟的关键因子,在SLE患者中APRIL和BLyS过度表达导致B细胞过度增殖分化[9]。贝利尤单抗是一种完全人源化IgG1-λ单克隆抗体,能够与可溶性BLyS特异性结合,抑制异常B细胞增殖分化,减少自身抗体生成和免疫复合物沉积[10]。贝利尤单抗是一种耐受性良好且已证实有效的药物,其安全性与安慰剂相当[11],与现有的SLE治疗方法联合使用几乎没有明显的额外风险,是唯一被美国食品和药物管理局及欧洲药品管理局许可用于治疗活动性和难治性SLE的生物制剂[10]。复旦大学的一项研究表明,在活动性原发性免疫性血小板减少症患者中,B细胞活化因子(B-cell-activating factor, BAFF)及中性粒细胞活化增加,中性粒细胞通过干扰血小板上的P-选择素(CD62P)而增加BAFF水平,两者相互作用使血小板减少、疾病活动度增加,贝利尤单抗的靶向BAFF治疗可以中断中性粒细胞的作用,是治疗免疫性血小板减少的潜在方法之一[12]。一项对贝利尤单抗治疗狼疮性肾炎的国际研究二次分析发现,贝利尤单抗还能够显著降低SLE人群中肾脏相关事件、死亡事件和狼疮性肾炎的爆发风险[13]。由Urowitz等[14]进行的长期研究发现,治疗5年后,与安慰剂相比,贝利尤单抗显著降低了器官损害的发生率。使用贝利尤单抗的患者发生严重感染的可能性不高,但如果发生感染,可能会增加致命性感染的风险[15]。所以,在治疗过程中动态监测各项炎症指标、对疾病发展做出预判及适当管理非常重要,确保在最小不良反应的情况下获得最佳的临床疗效。Kraaij等[16]经过2年的随访研究发现,对于严重难治性SLE(包括狼疮性肾炎)患者早期使用甲强龙冲击治疗(1 mg/kg,最大60 mg/d,逐渐减至维持剂量≤7.5 mg/d),予霉酚酸酯(mycophenolate mofetil, MMF)进行早期免疫抑制并很快停用,可避免造成过度免疫抑制。第0、2周予利妥昔单抗1 000 mg静脉注射,第4、6、8周予贝利尤单抗单抗10 mg/kg静脉注射,每4周治疗1次并维持至104周。此方案治疗后,所有抗ds-DNA抗体阳性患者转阴,抗C1q、甚至可提取核抗原自身抗体明显下降并长期维持,在2年病程中阻止了B细胞的完全再生。
本例在应用激素、环磷酰胺、环孢素、丙种球蛋白、重组人血小板生成素及输注血小板、红细胞等多种治疗措施后,血小板、血红蛋白波动曲线均有增幅,但并没有恢复正常且不能长期维持,对药物短期应答不佳、存在感染高危风险,血小板持续低下引起内脏及颅内出血风险增高。患者入院2周,病情未见明显改善,患者及家属情绪紧张,未予利妥昔单抗第二疗程及足够的药物等待期。在前期治疗基础上,生物制剂方案由利妥昔单抗调整为更安全的贝利尤单抗,后复查血小板、红细胞较前明显回升。随访1年余,患者对贝利尤单抗的耐受性良好,激素、羟氯喹、环孢素已逐步减至最低维持剂量,贝利尤单抗调整为每8周使用1次,病情平稳,血小板长期维持稳定,未观察到不良事件发生,提示贝利尤单抗对SLE并发血液系统损害的治疗效果良好。一项SLE血液系统受累的相关分析指出,SLE的病程长,蛋白尿、血尿、脱发、光过敏、关节症状为继发血液系统损害的高危因素,应及早发现,早期干预,以减少血液系统受累的发生率及病死率[17]。贝利尤单抗联合环孢素的维持治疗方案为我们治疗SLE提供了新的思路,其确切疗效需要更多的临床试验研究证实。
