玉米小斑病抗病QTL的鉴定与效应分析
2022-08-06李志敏杜文杰李政李雪迎赵萧笛贾琳
李志敏,杜文杰,李政,李雪迎,赵萧笛,贾琳
(河南农业大学 农学院,河南 郑州 450046)
玉米小斑病是由长蠕孢菌(Cochliobolusheterostrophus)侵染、主要为害玉米叶片的一种真菌性病害,在玉米整个生育期均可发生,在抽雄和灌浆期发病比较严重,是中国玉米产区重要病害之一。受耕作传统、品种和气候的影响,在我国玉米主产区的黄淮海地区,玉米小斑病的发生逐年加重。据统计,在发病严重的区域,一般年份减产15%~20%,严重的达50%以上[1]。选育和推广抗病品种是防治玉米小斑病最经济有效的手段,而开展抗病遗传规律研究,鉴定主效抗病QTL,可以为玉米小斑病的解析与育种提供理论依据。
已有研究表明,玉米小斑病的抗性是一个复杂的数量性状,由多个微效基因或数量性状位点共同控制,不同基因或位点之间多表现为加性效应、显性效应和上位性效应[2-4]。其中,在玉米第6染色体短臂上存在一个隐性抗病位点rhm,与标记UMC85和p144相连锁[5-7]。随后,Zhao等利用近等基因系(H95rhm和H95)组配的分离群体,对rhm进行了精细定位,将抗病基因限定在8.56Kb的区间内,并鉴定到一个编码赖氨酸组氨酸转运子的基因LHT1(lysine histidine transporter 1),可以作为rhm的候选基因。推测其抗病分子机制,可能与LHT1外显子中354bp片段的插入而导致蛋白合成提前终止有关[8]。然而,由于rhm仅在玉米散粉前表现出抗病的特性,散粉后抗性迅速下降,极大地限制了其在玉米生产上的应用[9]。Balint-Kurti等发现玉米成株期和苗期小斑病抗性位点存在一定的差异,利用Mo17(抗)×B73(感)组配的RIL群体,鉴定到3个成株期主效抗病位点,分别位于玉米第1染色体(1.10区)、第3染色体(3.04区)和第8染色体(8.02/03区)上[10-11];利用相同的作图群体,又对苗期抗性进行了分析,共鉴定到6个抗病位点,分别位于第1、2、3、6、7和8染色体上,其中在第1和第3染色体上鉴定到的抗病位点,与成株期抗病位点的位置比较接近[12]。此外,Balint-Kurti等还利用热带抗病材料NC300与感病自交系B104组配的RIL群体,在玉米第3染色体(3.03/04区)和第9染色体(9.03/04区)检测到主效的小斑病抗病位点[13-14]。通过不同亲本组建的不同群体的抗病遗传机制报道可以看出,玉米小斑病抗病位点几乎遍布整个玉米基因组,同时存在抗病热点区域[15-17],这些抗病热点区域分别位于玉米第3染色体(3.03/04区)、第6染色体(6.00/01区)和第9染色体(9.02/03区)上。
为进一步研究玉米小斑病的抗病遗传机制,为抗小斑病育种提供更好的理论支撑,本研究选用1份来自CIMMYT的含有热带血缘的优良抗病自交系CIMBL29和感病自交系GEMS41组配了连锁群体,并利用高密度SNP标记构建的连锁图谱,鉴定抗病基因位点,对其抗病的遗传效应进行分析,为分子标记辅助选择育种奠定基础。
1 材料与方法
1.1 供试材料
供试材料包括来自含有热带血缘的抗病亲本CIMBL29、感病亲本GEMS41、以及以GEMS41为轮回亲本,发展的包含179个家系的BC2F4群体。
1.2 田间试验设计
2017年在河南长葛、2018年在河南西平分别种植试验群体,包括亲本和179个BC2F4群体家系。田间试验采用随机区组设计,单行区,行长4米,行距0.66米,株距0.25米,2次重复。田间管理与常规生产管理相同。
1.3 抗病性鉴定
在玉米13~14片叶时(播种后45天左右),采用人工喷雾接种的方法,接种玉米小斑病病原菌,病原菌由河南农业科学院植保所郝俊杰研究员提供,接种浓度为5×105孢子/毫升。在人工接种后4周对家系的小斑病发病情况进行调查,并采用1~9级的抗、感分级标准进行抗性级别划分,其中,1级只在少数叶片有分散的小斑病病斑,发病面积占总叶片面积比例小于5%;3级只有植株下部叶片轻度发病,面积不超10%;5级植株下部叶片发病严重,叶片上病斑较多,中部叶片发病中等,上部叶片基本不发病,发病叶片面积占比31%~50%;7级植株中、下部叶片严重发病,上部叶片也少量发病,发病叶面积占比在51%~70%;9级植株叶片都严重发病,植株叶片大于70%有病斑,枯死或整株枯死。
1.4 遗传连锁图谱构建和QTL作图
在玉米出苗后8~10片叶时期,采集亲本和群体内新鲜的家系叶片提取总DNA[18]。采用中玉金(北京)公司开发的9.4K SNP芯片对亲本和群体家系的基因型进行检测。获得SNP标记的基因型信息后,筛选在亲本CIMBL29和GEMS41间有多态性的SNP 标记,删除缺失率高(>10%)、杂合度高(>10%)的标记。采用中国农科院王建康研究员课题组开发的完备区间作图IciMapping软件[19]构建遗传连锁图谱。具体的操作步骤如下:抗病亲本CIMBL29的带型用“0”表示;感病亲本GEMS41的带型用“2”表示;杂合带型用“1”表示;缺失带型用“-1”表示。采用“group”命令(LOD=2.5)对每一个标记进行分组,标记分组后,采用“ripple”命令确定标记在玉米10条染色体上排列顺序。采用完备区间作图软件IciMapping中的ICIM-ADD模型(加性效应模型),评估群体遗传效应并判定其显著性[20]。
1.5 数据统计分析
对调查群体家系和亲本的表型数据,使用SPSS 2.0软件计算病害表型数据的平均值和标准差;进行方差分析时,按变异来源,病害表型的总变异可分为家系变异和环境变异。广义遗传力计算公式:
H2=σ2g/(σ2g + σ2ge/n +σ2e/nr)
其中,σ2g为基因型方差,σ2ge为基因型与环境之间的互作方差,σ2e为误差项方差,重复数为r,环境个数为n。
2 结果与分析
2.1 遗传连锁图谱的构建
使用9.4K SNP芯片对群体家系和抗病亲本CIMBL29及感病亲本GEMS41的基因型进行检测,共筛选出1044个在亲本CIMBL29和GEMS41间表现出有多态性的SNP标记。采用完备区间作图IciMapping软件,利用这些亲本间有多态性标记构建了包含179个家系的群体遗传连锁图谱。采用LOD>2.5标准,将1044个标记分成10个连锁群分别对应玉米基因组的10条染色体,遗传连锁图谱总长2235.55 cm,SNP标记间平均距离为2.14 cm(表1),其中,在玉米第1染色体上的标记数目最多,有168个;第10染色体包括的标记数目最少,只有61个。构建的高密度遗传连锁图谱为继续开展抗病基因鉴定和QTL作图奠定了良好的基础。
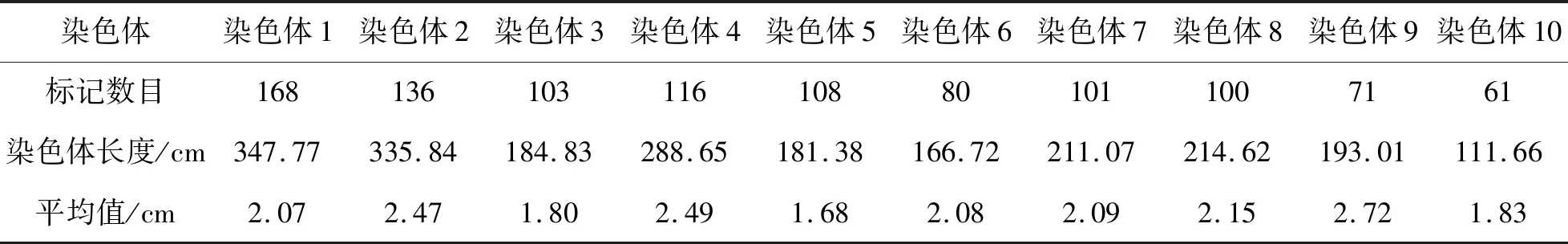
表1 SNP标记在玉米10条染色体上分布
2.2 玉米亲本和作图群体的小斑病抗性表型分析
在2017年和2018年,亲本CIMBL29、GEMS41和作图群体的179个家系在玉米小斑病抗性上呈现广泛的变异(表2)。其中,亲本CIMBL29表现为高抗玉米小斑病,2017和2018年两个环境条件下的抗性级别分别为1.5和1.3级;而亲本GEMS41则表现为高感玉米小斑病,2017和2018年两个环境条件下的抗性级别分别是7.6和7.4级。对作图群体在两个环境的抗性表型的方差分析可知,基因型对BC2F4群体小斑病抗性的影响均达到极显著水平,而环境间,以及基因型x环境互作不显著,说明小斑病抗性变异主要受基因型控制;进一步分析表明,2017年和2018年小斑病抗性均表现出较高的遗传力,遗传力分别是0.85和0.84,两个环境条件下的遗传力为0.82,群体家系较高的遗传力,说明遗传变异主要由基因型决定。
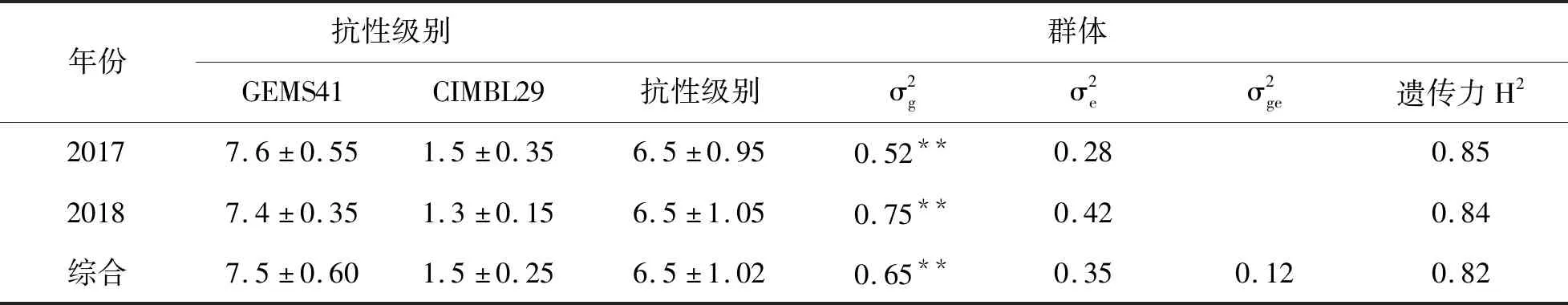
表2 玉米小斑病作图群体和亲本的抗性级别和遗传力
2.3 玉米小斑病抗性QTL定位及基因效应分析
对2017年和2018年的小斑病表型分别做QTL分析。由表3可知,两个环境条件下共检测到4个抗玉米小斑病QTL,分布在第1、5、6和8染色体上,单个QTL表型贡献率为5.8%~10.9%,加性效应值为0.26~0.53。其中,在玉米第1和6染色体上检测到两个环境条件下一致的QTL(qSLB1和qSLB6)。qSLB1在2017年和2018年的加性效应值分别为0.53和0.50,分别可以解释9.3%和10.9%的表型遗传变异。qSLB6在2017年和2018年的加性效应值分别为0.32和0.26, 分别可以解释6.6%和6.3%的表型遗传变异。这2个共同检测到的QTL可以认为是稳定的小斑病抗性QTL。此外,还在单个环境条件下检测到2个QTL,分别位于第5和第8染色体上。
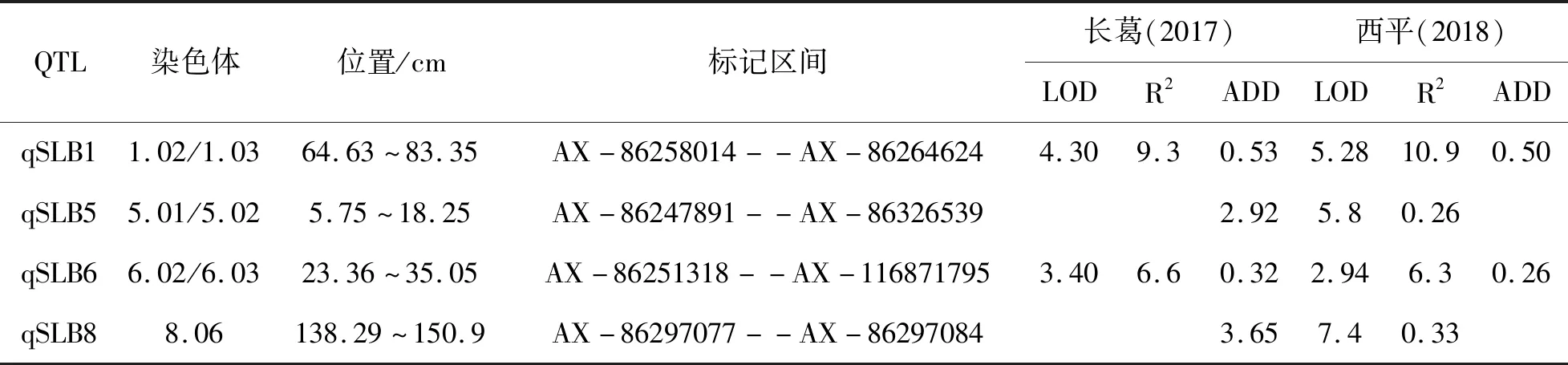
表3 作图群体玉米小斑病抗性QTL
3 结论与讨论
本研究在构建高密度SNP分子标记遗传连锁图谱的基础上,采用QTL作图,对由抗病自交系CIMBL29和感病自交系GEMS41组建的BC2F4群体的小斑病抗性进行了QTL定位。在玉米基因组中共检测到了4个抗病QTL,可以解释5.8%~10.9%的表型遗传变异;2个环境都在第1和第6染色体检测到抗病QTL (qSLB1和qSLB6),这2个共同检测到的QTL可以认为是比较稳定的小斑病抗性QTL。
利用B73参考基因组数据库( http://www.maizegdb.org) 对这两个QTL 区间内的基因进行了初步分析,结果发现在qSLB6区域,已经分离了抗小斑病rhm的候选基因LHT1[8]。第1染色体的qSLB1区域存在一个抗玉米大斑病的热点区域qNLB1.02,该区域有一个编码植物抗病相关蛋白基因(ZmREM6.3)[21]。本研究在第8染色体bin8.06区检测到qSLB8,在此区间存在一个抗大斑病基因Htn1[22],此外,该区间还存在另两个抗大斑病基因Ht2和Htn1。通过比较已经报道的抗病基因与本研究的抗小斑病位点,初步认为,抗小斑病位点位于抗病基因的热点区域。此外,在单个环境下,第5染色体上检测到qSLB5,这个抗病位点与前人报道的抗病热点区域不同,可能是新的抗小斑病位点,有待进一步验证和研究。
玉米病害抗性通常是复杂的数量性状,选择适合的作图群体是进行QTL作图的前提。本研究在作图群体选择上,与常用的遗传作图群体(如重组自交系群体)相比较,本研究利用的作图群体是选用感病亲本GEMS41作为轮回亲本,抗病亲本CIMBL29为供体亲本,通过1 次杂交、2 次回交和3次自交发展的BC2F4群体。该群体的一个突出的优点是群体家系的开花期变异小,相对比较一致的开花期有利于病原菌接种和表型鉴定,保证了抗性表型数据采集的一致性和可靠性,奠定了QTL定位的良好基础。
