基于生物基质碳点构建荧光探针用于腌腊肉制品中亚硝酸盐的检测
2022-08-03高田毅朱宏星韩婷婷王道营徐为民
黄 杨,高田毅,朱宏星,孙 冲, ,韩婷婷,王道营,徐为民,
(1.南京师范大学食品与制药工程学院,江苏南京 210023;2.江苏省农业科学院农产品加工研究所,江苏南京 210014;3.苏州工业园区生物产业发展有限公司,江苏苏州 215123)
亚硝酸盐(NO2-)是一种常见的食品添加剂,在腌肉制品、果酱、乳制品、肉脯等食品加工中具有广泛的应用[1]。亚硝酸盐作为肉制品护色剂,可与肉品中的肌红蛋白反应生成亚硝基肌红蛋白,从而赋予肉制品良好的色泽,同时增进肉的风味,还可抑制肉毒芽孢杆菌生长[2]。然而,长期过量摄入亚硝酸盐会对人体健康造成损害,增加患高铁血红蛋白症、胃癌、食管癌等疾病的风险[3]。目前,对于NO2-检测分析的常见方法有离子色谱法[4]、高效液相色谱法[5]、毛细管电泳法[6]和分光光度法[7]等,但这些方法存在前处理复杂、设备昂贵、检测时间长、需要专业的技术人员操作、不适用大量现场分析的问题。因此,开发绿色环保、成本低廉、操作简单且灵敏度高的新方法,对实际产业中检测亚硝酸盐具有重要意义。
近年来,纳米材料因其拥有稳定的物理化学性能、优良的尺寸效应和制备方法多样性等优点[8],在生物学、食品、医学和环境检测[9-11]等诸多领域展现出良好的应用前景。碳量子点(Carbon quantum dots,CQDs)是一种尺寸小于10 nm 的新型纳米材料,具有粒径小、水溶性良好、光学性质稳定和生物相容性优良等特点,因此CQDs 被认为是荧光探针的潜在替代材料[12-14]。生物基质作为一种低成本、绿色无污染、可再生的自然资源,在CQDs 制备中已得到广泛研究和应用。
荧光分析法是一种新兴的检测方法。与传统的检测方法相比,荧光探针具有简单方便,成本低,特异性好,灵敏度高等特点[15-16]。Li 等[17]基于柠檬酸/乙二胺碳纳米点开发荧光猝灭毛细管分析方法,实现了对食品和自然水中的亚硝酸盐的检测。Wang 等[18]通过沉淀法制备1-氨基芘纳米颗粒,基于纳米颗粒与亚硝酸盐的重氮化反应构建荧光探针,并将其应用水样中亚硝酸盐的分析,表现出良好的选择性和稳定性。尽管目前已报道多种荧光检测亚硝酸盐的分析方法,但大多来源于有机染料及化学原料,且合成过程较为繁琐,因此开发绿色经济、简单高效的荧光探针仍然是一个巨大的挑战。
针对这种不足,本文以肉鸡加工废弃物鸡爪外皮作为生物基质碳源,采用一步水热法制备了具有蓝色荧光特性的CQDs,从而建立了一种绿色、安全、快速检测亚硝酸盐的新技术,同时为畜禽加工废旧生物资源利用提供新的途径。
1 材料与方法
1.1 材料与仪器
实验所用鸡爪外皮 收集于江苏南京市孝陵卫农贸市场;腌肉制品(腊肠、腊肉及腊排) 购买于南京市孝陵卫苏果超市;亚硝酸钠(NaNO2)、硝酸钠(NaNO3)、磷酸钠(Na3PO4)、硫酸钠(Na2SO4)、碳酸氢钠(NaHCO3)、乙酸钠(CH3COONa)、草酸钠(Na2C2O4)、磷酸氢二钠(Na2HPO4)、硫代硫酸钠(Na2S2O3)、四硼酸钠(Na2B4O7) 均为分析纯,西陇化工股份有限公司;焦磷酸钠(Na4P2O7)、钨酸钠(Na2WO4)、碳酸钠(Na2CO3)、氯化铁(FeCl3·6H2O)、氯化钠(NaCl)、氯化钾(KCl)、氯化铵(NH4Cl)、氯化铜(CuCl2·2H2O)、氯化钡(BaCl2·2H2O)、氯化铝(AlCl3·6H2O)、氯化镁(MgCl2·6H2O)、氯化铁(FeCl2·4H2O)、氯化锂(LiCl)、氯化钙(CaCl2·2H2O)、氯化锶(SrCl2·6H2O)、氯化钴(CoCl2)均为分析纯 国药集团试剂有限公司;实验用水 为超纯水,电阻率18.5 MΩ·cm-1。
JEM-2100F 场发射透射电子显微镜 日本电子株式会社;Cary 5000 紫外可见吸收光谱仪 美国Varian 公司;Nicolet iS50 傅里叶变换红外光谱仪美国Thermo 公司;ESCALAB 250Xi X 射线光电子能谱仪、ICS1100 离子色谱仪 美国赛默飞世尔科技公司;LS 55 荧光分光光度计 珀金埃尔默股份有限公司。
1.2 实验方法
1.2.1 CQDs 的制备 参照Wang 等[19]的方法制备CQDs,略作修改。以鸡爪外皮为碳源,采用一步水热合成碳量子点荧光材料。具体步骤如下:鸡爪外皮经洗净烘干后,用食品粉碎机打磨成粉末。称取2.0 g鸡爪外皮粉置于200 mL 的聚四氟乙烯反应釜中,加入100 mL 超纯水,混匀后于200 ℃下水热反应10 h。待反应釜冷却至室温,将反应后得到的混合溶液转移至离心管,在10000 r/min 下离心10 min,吸取上清液,经0.22 μm 滤膜过滤后置于1000 Da 的透析袋内,室温透析24 h。收集透析袋内溶液冻干,将冻干后的絮状物研磨得到的CQDs 粉末放置于干燥皿中保存。
1.2.2 CQDs 的表征
1.2.2.1 微观结构观察 通过透射电子显微镜(Transmission electron microscopy,TEM)和高分辨率透射电子显微镜(High resolution transmission electron microscopy,HR-TEM)观察CQDs 形貌。将制备的CQDs 粉末超声溶解,使纳米颗粒均匀分散到超纯水中,取稀释好的样品液滴至超薄碳膜网上,室温下干燥后于场发射透射电子显微镜上观察其形貌及晶格结构。
1.2.2.2 紫外可见吸收光谱分析 称取CQDs 粉末100 mg,用蒸馏水溶解定容至100 mL,获得1 mg/mL的CQDs 水溶液作为样品溶液。采用紫外可见吸收光谱仪(Ultraviolet-visible absorption spectroscopy,UV-vis)对CQDs 溶液进行扫描。以去离子水作为空白对照,扫描波长范围为200~700 nm,扫描速度为600 nm/min。
1.2.2.3 傅里叶变换红外光谱分析 采用傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析CQDs 表面基团。使用KBr 压片法制备样品,扫描范围为500~4000 cm-1,分辨率为4.00 cm-1。
1.2.2.4 X-射线光电子能谱分析 采用X-射线光电子能谱(X-ray photoelectron spectroscopy,XPS)确定CQDs 表面元素组成、含量和化学键状态。将CQDs 粉末固定到样品台上,使用单色X 射线源Al Kα 作为激发源,激发电压为1487 eV,以测得结合能284 eV 的C 1s 进行校准。
1.2.2.5 荧光光谱分析 采用荧光光谱仪(Fluorescence Spectrometer)对CQDs 的荧光性质进行分析。以1 mg/mL CQDs 水溶液作为样品溶液,设定激发和发射狭缝宽度均为5 nm。固定激发波长370 nm,发射波长范围380~600 nm 得到CQDs 的荧光发射光谱;固定发射波长450 nm,激发波长范围280~430 nm 得到CQDs 的荧光激发光谱。
1.2.3 CQDs 荧光量子产率测定 荧光量子产量根据参比法[20]测定。以硫酸奎宁(荧光量子产率为0.54)作为参比标准物质,测定CQDs 与硫酸奎宁在同一激发波长下的荧光发射峰面积及同一波长处的吸光度。代入下式:

式中:下标1 和2 分别代表待测样品和标准物质;Q 表示荧光量子产率(%);S 表示荧光发射积分面积;A 为吸光度;η 为溶剂的折射率(蒸馏水为1.33)。
1.2.4 CQDs-Fe2+荧光探针检测NO2-配制浓度为1、5、10、50、100、200、300、400、500、600、700、800、900、1000 μmol/L 的NO2-溶液,取400 μL 不同浓度的NO2-溶液和相同体积的1 mmol/L Fe2+溶液加入到1 mL 的1 mg/mL CQDs 溶液中,加入1.5 mL PBS(0.1 mol/L,pH3.0),100 W 超声30 min 使其混合均匀,记录荧光发射光谱。每个浓度梯度设置5次平行实验。参数设置为:固定激发波长为370 nm,发射波长范围为380~600 nm,激发和发射狭缝宽度均为5 nm。通过分析体系荧光猝灭值△F 与NO2-浓度之间的变化关系,得出线性方程和相关系数。
1.2.5 实际样品分析 参照GB 5009.33-2016 对购买的腌腊肉制品进行前处理[21]。具体步骤如下:将腌腊肉制品用食品粉粹机制成匀浆,称取试样匀浆1 g,置于100 mL 离心管中,加入40 mL 水,超声提取30 min,每隔5 min 振摇一次。于75 ℃水浴中放置5 min 后取出,冷却至室温后转移至50 mL 容量瓶中定容。溶液经滤纸过滤后,于1000 r/min 下离心15 min,将上清液经0.22 μm 滤膜过滤后作为样品原液。每组样品制备三组平行试样,分别采用离子色谱法和CQDs-Fe2+荧光探针进行检测,结果取平均值。向腌腊肉制品样品原液中添加100 μmol/L 的NO2-,计算实际样本中NO2-的加标回收率。
1.3 数据处理
每组实验重复3~5次取平均值,采用IBM SPSS Statistics 25 进行单因素方差分析,结果采用 X±SD 表示。使用Origin8.5 软件(OriginLab 公司)对数据进行图谱绘制。
2 结果与分析
2.1 CQDs 的表征
采用场发射透射电子显微镜对CQDs 形貌进行观察,如图1所示,CQDs 为球形纳米颗粒,尺寸均一,且具有良好的分散性。插图HR-TEM 图像显示,CQDs 的面间距为0.22 nm,这属于石墨的(100)衍射面,表明CQDs 对应于sp2型石墨碳纳米晶芯[22]。图2 为紫外可见吸收光谱及荧光光谱图。由图2 中可知,在263 nm 处CQDs 有明显紫外吸收峰,这是芳香(C-C) sp2杂化轨道典型的π→π*跃迁产生的[23]。CQDs 的荧光激发峰与发射峰呈现狭窄对称的特征,说明CQDs粒径尺寸均匀且分散性良好[24]。插图表明合成的CQDs 水溶液在自然光下呈现淡黄色或接近无色(左),在365 nm 紫外灯照射下发射出强烈的蓝色荧光(右)。以硫酸奎宁作为标准物测得CQDs荧光量子产率为8.23%,说明其具有良好的荧光性能。

图1 CQDs 的透射电子显微镜图Fig.1 TEM image of CQDs

图2 CQDs 的紫外可见吸收光谱及荧光光谱图Fig.2 UV-vis absorption and fluorescence spectra of the CQDs
采用傅里叶变换红外光谱表征CQDs,结果如图3所示,3285 cm-1处吸收峰归因于O-H 和N-H基团的伸缩振动,2921 和2868 cm-1处是C-H 对称伸缩振动[25]。1627、1519、1451、1242 和1087 cm-1附近的峰对应着C=O、C=C、C-N-C、C-OH 和C-OC[26-28]。这些官能团使得CQDs 具有良好的水溶性,有望进一步扩展其应用领域。

图3 CQDs 的傅里叶变换红外光谱图Fig.3 FTIR spectrum of the CQDs
通过XPS 表征CQDs 的元素组成、化合状态和分子结构。图4A 为CQDs 的XPS 全扫描谱图,图中分布284、398 和531 eV 三个主要峰,对应C、N和O 三个元素。根据峰面积计算CQDs 中C、N 和O 三个元素的相对含量,分别为63.82%、16.06%、20.12%。通过XPSPEAK 软件进一步分析CQDs 表面基团信息。图4B 表示CQDs 的C 1s 谱图,284.3 eV处的峰归属于石墨碳[29],284.8 eV 处的峰表示CN/C-O 键,285.8 eV 处的峰对应C=N 或者C=O 键,287.6 eV 处的峰则对应于HO-C=O 键[30]。N 1s 谱图(图4C)存在398.9 和399.8 eV 两个峰,分别对应C-N-C 键和N-H 官能团中的氮原子[31]。O 1s 谱图如图4D所示,图中530.9、531.7、532.6 eV 三个特征峰对应C=O、C-O-C、C-OH 键[32]。XPS 分析结果证明CQDs 中存在羟基、羧基和烷基等多种基团,与傅里叶变换红外光谱结果一致。
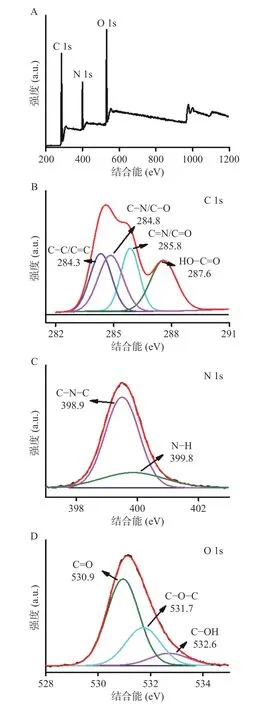
图4 CQDs 的X-射线光电子能谱Fig.4 XPS spectra of the CQDs
2.2 CQDs-Fe2+探针检测NO2-机理研究
本实验研究了CQDs 荧光探针对Fe3+、Na+、Cu2+、K+、NH4+、Ba2+、Al3+、Mg2+、Fe2+、Li+、Ca2+、Sr2+和Co2+13 种常见金属阳离子的特异选择性。根据相对荧光强度值F/F0(F 为添加1 mmol/L 不同金属离子后荧光值,F0为未添加其他离子的荧光值)评价荧光探针选择性。测试三次取平均值,由SPSS 软件进行数据处理分析。由图5可知,与其他金属离子相比,添加Fe3+后的相对荧光强度为25.69%,而其他离子相对荧光强度在85.55%~101.66%范围间。与空白组相比,仅有Fe3+与其具有显著性差异(P<0.05),说明Fe3+对CQDs 具有明显的荧光猝灭作用。

图5 CQDs 对常见金属离子的选择性Fig.5 Selectivity of CQDs toward common metal ions
如图6所示,当仅存在NO2-或Fe2+时,CQDs 的荧光基本无变化。在NO2-和Fe2+同时存在时,Fe2+因NO2-的氧化作用转化为Fe3+,Fe3+与CQDs 表面的羟基、羧基等形成铁-羟基或铁-羧基复合物从而导致CQDs 荧光猝灭[33]。检测机制如图7所示,CQDs与Fe2+混合后在370 nm 激发波长下仍然发出强烈的蓝色荧光,加入NO2-后,Fe2+转化为Fe3+使得CQDs荧光强度值降低,由此可构建CQDs-Fe2+探针实现对NO2-的间接检测。

图6 CQDs 与Fe2+、NO2-、Fe2+/NO2-的荧光发射光谱Fig.6 Fluorescence spectra of CQDs with Fe2+, NO2- and Fe2+/NO2-

图7 CQDs-Fe2+检测NO2-的机制Fig.7 Mechanism of NO2- detection by CQDs-Fe2+
2.3 CQDs-Fe2+探针参数优化
为了更好地优化CQDs-Fe2+探针对NO2-的检测性能,对CQDs 的激发波长、缓冲液pH、反应时间进行研究。图8A 为CQDs 溶液在不同激发波长下的荧光发射光谱,由图中可知,最大激发波长位于370 nm 左右。随着激发波长的增加,最大发射峰荧光强度逐渐增强,当激发波长超过370 nm 后,荧光强度开始下降。图8B 为荧光强度归一化后的荧光发射光谱,由图中可以看出,在300~450 nm 的激发波长范围内,CQDs 的荧光发射光谱表现出明显的红移现象。这种现象是由CQDs 的费米能级附近不同表面缺陷态的光学选择引起的[34]。在不同的激发波长下,CQDs 表面相应的发色基团将占据主导地位,产生依赖于激发波长的荧光[35]。说明该CQDs 具有激发波长的依赖性。当激发波长为370 nm CQDs荧光强度最强,最大发射波长在450 nm 处。故后续实验所选激发波长为370 nm。

图8 不同激发波长下CQDs 的荧光发射光谱(A)和归一化发射光谱(B)Fig.8 Fluorescence emission spectra (A) and emission normalized spectra of CQDs (B) in different excitation wavelengths
图9A 显示了在不同pH 的缓冲液中NO2-添加前后CQDs-Fe2+体系的荧光强度。结果表明,当缓冲液pH 在1~7 范围内变化时,随着pH 逐渐增加,CQDs-Fe2+与CQDs-Fe2+/NO2-两者荧光强度逐渐增高,当pH 在4~7 变化时,体系荧光基本保持稳定,这是因为过酸环境会导致CQDs 的表面基团发生质子化从而引起体系荧光强度减弱。通过分析NO2-添加前后CQDs-Fe2+体系荧光猝灭程度(图9B),可以发现,当pH 为2 和3 时,体系荧光猝灭程度最大,考虑到CQDs-Fe2+在pH 为3 时荧光强度远大于pH 为2 时,因此选择pH3 作为体系反应的最佳缓冲条件。

图9 pH 对体系荧光强度(A)和猝灭程度(B)的影响Fig.9 Influence of pH on the fluorescence intensity (A) and the quenching rates (B)
图10是CQDs-Fe2+与NO2-反应时间(0~75 min)的优化。从图中可以看出,随着反应时间的增加,体系荧光强度值逐渐降低并趋于稳定,结合时间在40 min 后,荧光强度保持恒定,表明NO2-和Fe2+之间的氧化还原反应以及产生的Fe3+对荧光的猝灭作用在40 min 内达到动态平衡。因此在后续实验中选择40 min 作为NO2-加入CQDs-Fe2+体系的反应时间。

图10 反应时间对CQDs-Fe2+/NO2-体系荧光强度的影响Fig.10 Influence of r eactiontime onthefluorescence intensity ofCQDs-Fe2+/NO2-
2.4 CQDs-Fe2+探针线性检测NO2-
由图11 的荧光光谱图可以看出,在CQDs-Fe2+中加入NO2-后,体系荧光强度随着NO2-浓度增加逐渐降低。以NO2-浓度为横坐标,450 nm 处CQDs 荧光猝灭值(△F=F0–F,F0为空白对照组荧光值,F 为待测组荧光值)为纵坐标,在1~500 μmol/L 范围内,两者呈现良好的线性关系,回归方程为△F=0.60c+1.01(R2=0.9979),检出限为0.61 μmol/L。与表1 中已报道的NO2-检测方法相比,本方法建立的荧光探针具有较宽的线性范围和较低的检测限。

图11 不同浓度NO2-的CQDs-Fe2+/NO2-荧光光谱图Fig.11 Fluorescence spectra of CQDs-Fe2+ with different concentrations ofNO2-

表1 不同方法检测NO2-的比较Table 1 Comparison of methods for the NO2- detection
2.5 CQDs-Fe2+探针抗干扰分析
为考察CQDs 荧光探针在检测NO2-时的抗干扰性,在相同实验条件下,选择500 μmol/L 的NO2-、HPO42-、H2PO4-、PO43-、HCO3-、C2O42-、CH3COO-、CO32-、SO42-、S2O32-、NO3-、WO42-、P2O74-等阴离子对CQDs-Fe2+荧光探针的抗干扰性能进行测试。如图12所示,与空白组相比,NO2-对CQDs-Fe2+体系的荧光猝灭效果明显,而其他相同浓度的阴离子则对CQDs 的荧光猝灭效应较小,证明其他阴离子在该荧光探针用于检测NO2-时的影响很小,即CQDs-Fe2+荧光探针在检测NO2-时具有良好的抗干扰能力。
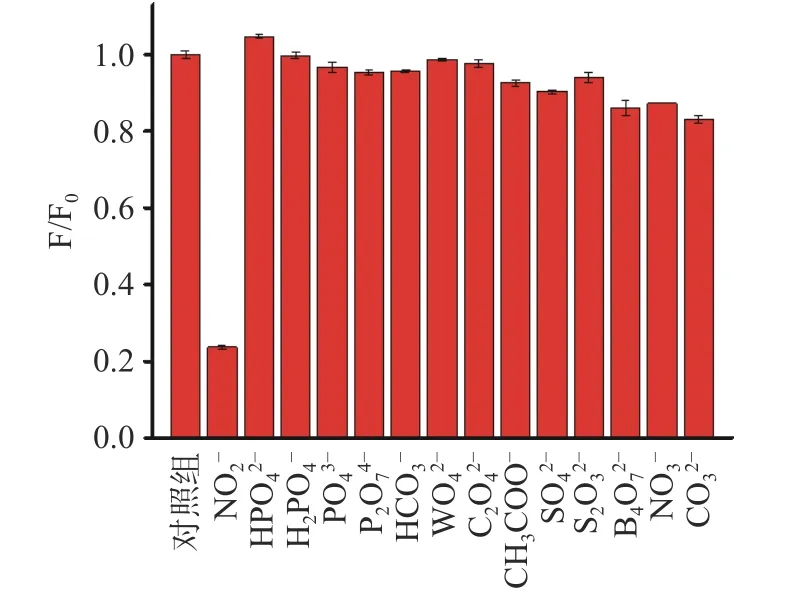
图12 CQDs-Fe2+检测NO2-的抗干扰性Fig.12 Anti-interference of CQDs-Fe2+ in detection of NO2-
2.6 实际样品检测
为评估所制备的 CQDs-Fe2+荧光探针用于NO2-检测的实际应用价值,以市售三种腌腊肉制品,腊肠、腊肉、腊排为样品,对其中 NO2-含量进行加标回收试验。测定结果如表 2所示。该荧光探针测得样品中 NO2-的回收率为 98.61%~100.95%,RSD 均小于 5%,且与离子色谱得到的结果基本一致,表明本研究所制备的 CQDs 荧光探针可用于实际样品中NO2-的检测。

表2 实际样品中NO2-的测定结果Table 2 Detection of NO2- in actual samples
3 结论
本文以生物基质鸡爪外皮为碳源,采用一步水热法合成具有良好荧光特性的CQDs。基于Fe3+对CQDs 的荧光猝灭能力和NO2-可将Fe2+转化为Fe3+的氧化能力,进而构建了CQDs-Fe2+荧光探针用于NO2-的检测。在1~500 μmol/L 范围内,NO2-浓度与探针荧光猝灭值呈现良好的线性关系,检测限为0.61 μmol/L。将其应用于腌腊肉制品中亚硝酸盐的检测,结果表明,与离子色谱法相比,本方法具有更低的检测限,适用于实际样品中亚硝酸盐的微量分析。
综上,本方法构建的荧光探针在实现禽肉加工废弃物再利用的同时,开发了一种绿色安全、快速、高效检测亚硝酸盐的技术,具有良好的检测性能与实际应用价值。此外,由于基于荧光物质建立的预测模型会因模型选择、人员操作及计量方法的不同存在精度上的差异,因此寻求精度高、稳定性好、适用范围广的亚硝酸盐检测方法有待更深一步的研究。
