基于体外消化模型研究板栗壳和囊衣原花青素类物质消化前后的组成差异
2022-08-03李浩楠黄小敏方一荷肖雯馨张子琴
李浩楠,黄小敏,方一荷,肖雯馨,张子琴,杨 芳,2,3,*
(1.武汉工程大学环境生态与生物工程学院,湖北武汉 430205;2.武汉工程大学绿色化工过程教育部重点实验室,湖北武汉 430205;3.磷资源开发利用教育部工程研究中心,湖北武汉 430073)
板栗(Castanea mollissimaB)属壳斗科植物,是重要的农作物之一,分布于世界各地。目前,我国是板栗的主要生产国,板栗年产量高达1.0×106t[1]。板栗仁作为可食用的部分,其中含有大量的蛋白质、功能性多糖及矿物质等[2],深受广大消费者喜爱。除此以外,板栗加工的副产物,如板栗树及树皮被用于工业生产单宁[1],板栗叶在民间医学中被用于治疗百日咳和漆中毒[3-4]。然而,作为主要副产物的板栗壳和囊衣仍以燃烧和自然腐败等方式处理。据资料显示,板栗壳和囊衣中含有色素、多酚和多糖等化学成分[5]。多酚作为植物的次级代谢产物,分布于植物的外皮、叶及茎中,其抗氧化机理主要包括清除自由基,氢供体,猝灭单线态氧及螯合金属离子[6-9]。王菲儿等[10]从板栗壳和囊衣分离并鉴定出了10 个多酚类化合物,分别为间苯二酚、2-羟基-3',4-二羟基苯乙酮、邻苯二酚、原儿茶醛、没食子酸甲酯、2,5-二羟基苯乙酮、B-羟丙基香草酮、原儿荼酸甲酯、对香豆酸和阿魏酸。Caccio 等[11]从板栗壳水提物中分离鉴定出了没食子酸、原儿茶酸、绿原酸等多种多酚类化合物。Barreira 等[12]提取了板栗不同部位的多酚类物质,发现总酚含量最高的是板栗壳,其含量高于树叶、皮、花、果实,并发现抗氧化活性与总酚含量线性相关。因此,板栗壳可以成为一种廉价和容易获得的天然抗氧化剂来源。
近年来,多酚类物质已经成为研究热点,大部分研究者聚焦于研究多酚提取工艺优化、抗氧化活性(包括清除自由基,作为氢供体,猝灭单线态氧及螯合金属离子等)以及抑菌活性等方面,原花青素类物质的抗氧化活性是维生素C 的20 倍,是维生素E 的50 倍[13]。但陈梦雨等[14]通过研究葡萄籽中的原花青素,阐明它具有抗氧化、抗心肌缺血再灌注损伤、抗动脉粥样硬化、保护血管内皮细胞、抗癌、降血压、降血脂、降血糖等药理活性。研究表明,酚类化合物在化学溶剂中的抗氧化活性,抑菌活性与其经过胃肠消化后表现出很大的差异。由于多酚的高代谢率和较低的生物利用度,能够进入到血液循环和靶器官发挥生物活性的物质可能是其代谢物。所以,溶剂提取表现出来的抗氧化性并不能代表其在体内的作用。但关于板栗壳和囊衣原花青素类物质在消化前后的组成变化鲜有研究。因此,本实验以板栗壳和囊衣多酚提取物中的原花青素类为研究对象,采用广泛靶向代谢组学结合超高效液相色谱串联质谱技术(ultra high performance liquid chromatography tandem mass spectrometry,UPLC-MS/MS),研究板栗壳和囊衣原花青素类物质在体外消化过程中的代谢物种类和含量变化,为进一步开发利用板栗壳和囊衣生物资源提供参考依据。
1 材料与方法
1.1 材料与仪器
野生板栗 采自山东省祁蒙山;甲醇、乙腈、乙酸均色谱级 Sigma;无水乙醇(分析纯)、胃蛋白酶(≥2500 units/mg)、胰蛋白酶(≥2500 units/mg)、胆汁提取物 国药集团化学试剂有限公司。
THZ-100 恒温培养摇床 上海一恒科学仪器有限公司;DK-S24 型电热恒温水浴锅 上海精宏实验设备有限公司;FW100 型高速万能粉碎机 天津市泰斯特仪器有限公司;ML-204/02 型精密电子天平
梅特勒-托利多仪器(上海)有限公司;超高效Shim-pack UFLC SHIMADZU CBM30A 液相色谱(ultra performance liquid chromatography,UPLC)
岛津公司;Applied Biosystems 6500 Q TRAP 串联质谱(tandem mass spectrometry,MS/MS) 赛默飞公司;GZX-9030 型数显鼓风干燥箱 上海博迅实业有限公司医疗设备厂;Alpha14LDplus 冻干机 德国Christ 公司。
1.2 实验方法
1.2.1 板栗壳和板栗囊衣提取物的制备 采用苏云霞等[15]研究优化得到的最佳提取工艺提取板栗壳及囊衣中多酚,将板栗壳和囊衣分别从板栗果上剥离开,将板栗壳碎后过60 目筛,按照1:15 g/mL 的料液比,采用70%乙醇(V/V)在65 ℃条件下提取90 min后得板栗壳原花青素粗提取液,对其进行真空抽滤,并在40 ℃下真空浓缩,得到粗提液,再经冷冻干燥得到红棕色的板栗壳提取物(chestnut shell extract,CSE)。按照同样的方法可以制备板栗囊衣提取物(chestnut pellicle extract,CPE),低温保存备用。
1.2.2 体外模拟胃肠消化模型 取CSE 和CPE 溶于蒸馏水10 mL 中,加入胃消化液8 mL(3.2 mg/mL胃蛋白酶,7 mL/L HCl 以及2 g/L NaCl,pH2~3);于恒温摇床中250 r/min,37 ℃下孵育2 h,再加入1 mol/L NaOH 调节pH 为7,终止胃液消化反应。向胃消化后的样品中加入肠消化液8 mL(1.5 mg/mL胰液素,1.5 mg/mL 胆汁提取物,pH7~7.4);于恒温摇床中250 r/min,37 ℃下孵育2 h[16]。将肠消化后的样品于冷冻离心机中,在8000 r/min,4 ℃条件下离心10 min,取上清液于-20 ℃下保存待分析[17]。把胃肠消化后的板栗壳代谢物记作DCSE(digested chestnut shell extract),胃肠消化后的囊衣代谢物粗提物记作DCPE(digested chestnut shell extract)。
1.2.3 代谢物定性定量分析
1.2.3.1 样品前处理 参考苏云霞等[15]的方法,并稍作修改,取CSE、CPE、DCSE、DCPE 分别进行真空冷冻干燥,在研磨仪中研磨1.5 min,各称取100 mg上述样品粉末,加入1.0 mL 的70%甲醇(V/V),放入4 ℃冰箱中过夜,其间辅以涡旋3次,辅助样品溶解。在10000 r/min 下离心10 min,取上清液1 mL,过0.22 μm 滤膜,保存在-20 ℃,供UPLC-MS/MS分析。
1.2.3.2 高效液相色谱条件 采用超高效液相色谱进行检测,色谱柱:Waters ACQUITY UPLC HSS T3 C18(2.1 mm×100 mm, 1.8 μm);柱温:40 ℃;流速:0.4 mL/min;流动相:A 相为超纯水(含0.04%的乙酸)、B 相为乙腈(含0.04%的乙酸);进样量:2 μL;洗脱梯度:0~11.0 min,流动相A 由95%变化为5%;11.0~12.0 min,5%(A);12.0~12.1 min,流动相A 由5%变化为95%;12.1~15.0 min,95%(A);流速:0.40 mL/min,具体洗脱程序如表1所示。

表1 色谱梯度洗脱程序Table 1 Chromatographic gradient elution procedure
1.2.3.3 质谱条件 质谱条件参考陈金泉[18]的方法,MS 条件:电喷雾电离(electrosprey ionization,ESI)离子源,正负离子扫描模式,电喷雾离子源温度500 ℃;离子喷雾电压5500 V;离子源气体1,55 psi;离子源气体2,60 psi;帘气(curtain gas,CUR)25 psi。
1.2.3.4 代谢物定性定量原理 根据Zhu 等[19]的方法对代谢物进行定性和定量分析。基于自建数据库MWDB(metware database)和公共数据库Mass Bank(http://www.massbank.jp/),KNAPSAcK(http://kanaya.naist.jp/KNApSAcK/),HMDB(http://www.hmdb.ca/) , MoTo DB( http://www. ab.wur.nl/moto/) 和METLIN(http://metlin.scripps.edu/index.php),对样品的代谢物进行定性和定量分析。在鉴定过程中,去除了K、Na、NH4 和其他较大分子量物质的碎片离子的重复信号。代谢物的定量基于三重四级杆质谱的多反应监测模式(multiple reaction monitoring,MRM)。具体来说,首先是筛选前体离子(Q1)去除与其他分子量物质相对应的离子以消除干扰,前体离子冲破碰撞室并诱导电离形成大量碎片离子。再者,为了消除非目标离子干扰,碎片离子通过三重四极杆过滤以选择特征碎片离子(Q3),使定量结果更加准确和可重复。使用Multia Quant(3.0.2),对色谱峰进行整合和校正,并根据色谱峰的峰面积计算相应物质的相对含量。为了进一步确定各代谢物的相对含量,根据代谢物保留时间和峰型对质谱峰进行了校正。
1.3 数据处理
通过UPLC-MS/MS 分析得到的数据由R 软件进行层次聚类分析(HCA)、主成分分析(PCA)和正交偏最小二乘法判别分析(OPLS-DA)、使用变量权重值(Variable Importance for the projection,VIP)和P 值来筛选胃肠消化后代谢物差异。将比较组得到的显著性差异代谢物进行 KEGG 代谢通路富集分析,每组样品进行 3次生物学重复实验。
2 结果与分析
2.1 原花青素类化合物定性定量分析
研究表明,多酚在中性或稍碱性pH 下不稳定,会发生化学转化,如形成不稳定的醌中间体和其他氧化化合物[20]。此外,多酚在碱性条件下往往通过疏水作用、氢键和共价键与蛋白质结合。基于广泛靶向代谢分析方法,利用UPLC-ESI-MS/MS 对CSE、CPE、DCSE 和DCPE 中化合物进行定性定量分析。以正负离子模式检测代谢物,共鉴定出33 种原花青素类代谢物,包括14 种黄酮、19 种鞣质。采用聚类热图对33 种原花青素代谢物进行分析,结果见图1。

图1 CSE、CPE、DCSE 和DCPE 不同原花青素组分的层次聚类分析热图Fig.1 Hierarchical cluster analysis heat map of different proanthocyanidins components of CSE, CPE, DCSE and DCPE
从图1 中可以看出,CSE 和CPE 之间原花青素代谢物含量无显著差异,而CSE vs DCSE 及CPE vs DCPE 比较组中,体外消化对原花青素代谢物含量影响较大。CSE 和CPE 原花青素类含量明显高于DCSE和DCPE。CPE 和CSE 及其在体外胃肠消化过程中的代谢物中含量在前五位原花青素如表2所示。
由表2所示,其中CSE、 CPE、DCSE 和DCPE中含量最高的前五种原花青素类化合物中都含有表儿茶素、原花青素C2、原花青素A1。比较表儿茶素、原花青素C2 和原花青素A1 的含量变化,结果显示体外消化后其含量显著(P<0.05)下降。据覃国新等[21]研究报道,表儿茶素在胃消化过程中含量并无明显变化,在模拟小肠消化过程中含量显著下降。原花青素C2、原花青素A1 为原花青素二聚体[22],在模拟胃消化过程中,二聚体原花青素的分解为二分子原花青素单体,故导致原花青素二聚体类含量下降[23]。此外,据报道[24],板栗壳中还含有没食子酸。Filomena等[25]通过HPLC 测定了板栗不同部位的多酚类化合物,结果显示CSE 和CPE 中均含有没食子酸。Jung等[26]通过HPLC 测定了CSE 乙醇提取物中没食子酸的含量,其含量为4.66 mg/g。而本文发现,板栗壳和囊衣中的没食子酸与儿茶素结合,主要以没食子儿茶素的形式大量存在。
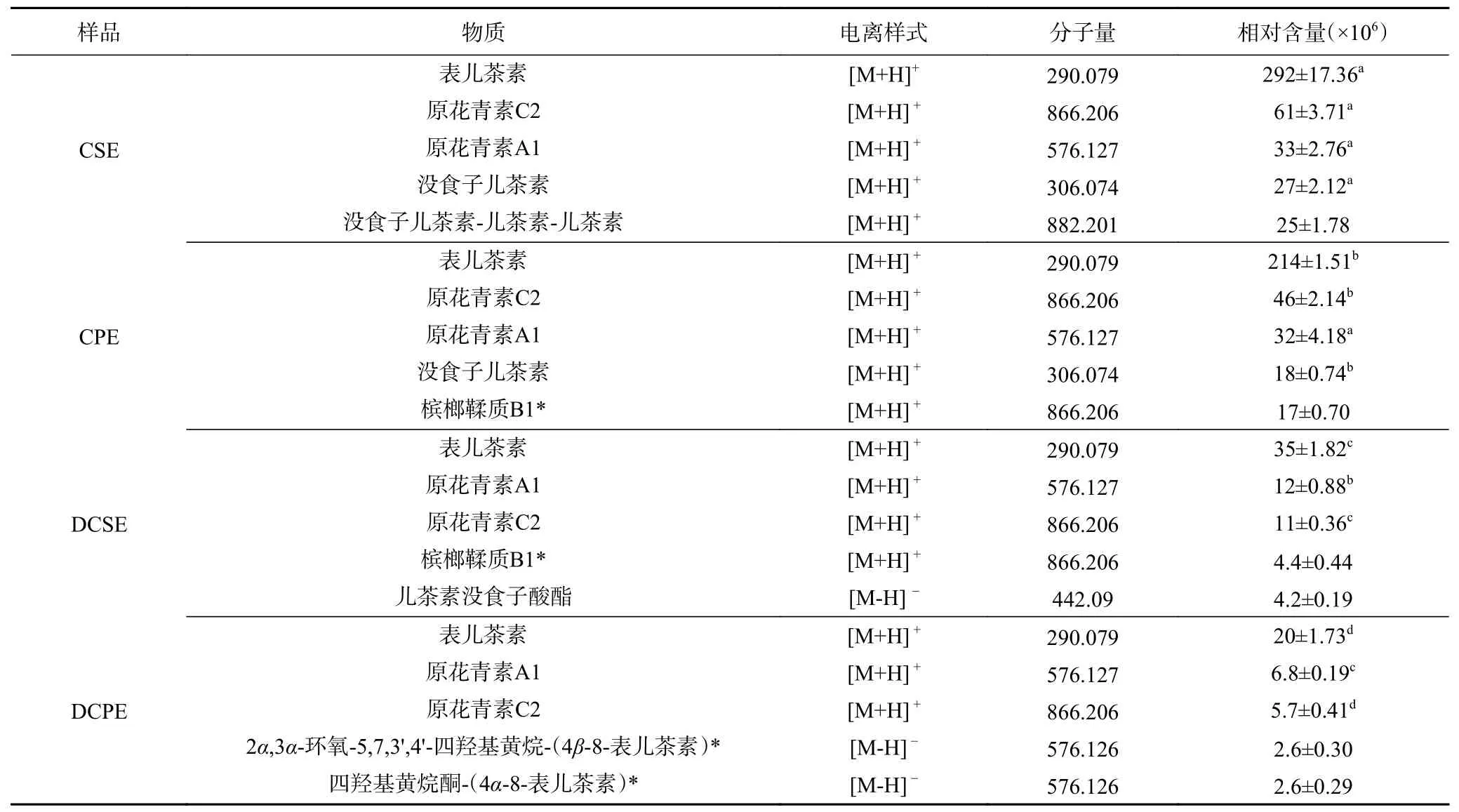
表2 CPE 和CSE 体外胃肠消化过程中前五位原花青素类的相对含量Table 2 Relative contents of the top five proanthocyanidins in gastrointestinal digestion in vitro of CPE and CSE
2.2 代谢分析
2.2.1 主成分分析(PCA) 为了揭示CSE 和CPE之间的差异以及体外模拟消化对原花青素类成分的总体影响,对样品组和质量样本(mix)进行了主成分分析。质控样本由样本提取物混合制备而成,用于分析样本在相同的处理方法下的重复性。在主成分分析得分图(图2)中,观察到CPE vs DCPE、CSE vs DCSE 比较组之间被明显分离,两个主成分PC1 和PC2 的得分分别为82.19%和7.59%。结果表明,原花青素类物质在模拟胃肠道消化过程中变化明显。此外,研究发现图2 中CPE-3 与其他两个平行样品差距较大,可能由于实验测定时有一定的误差,又由于主成分分析舍弃了次要部分,故而导致CPE-3 在图中与其他两个平行样品有较大差距。结合图1的热图分析以及图3 的OPLS-DA 可以佐证以上猜想。
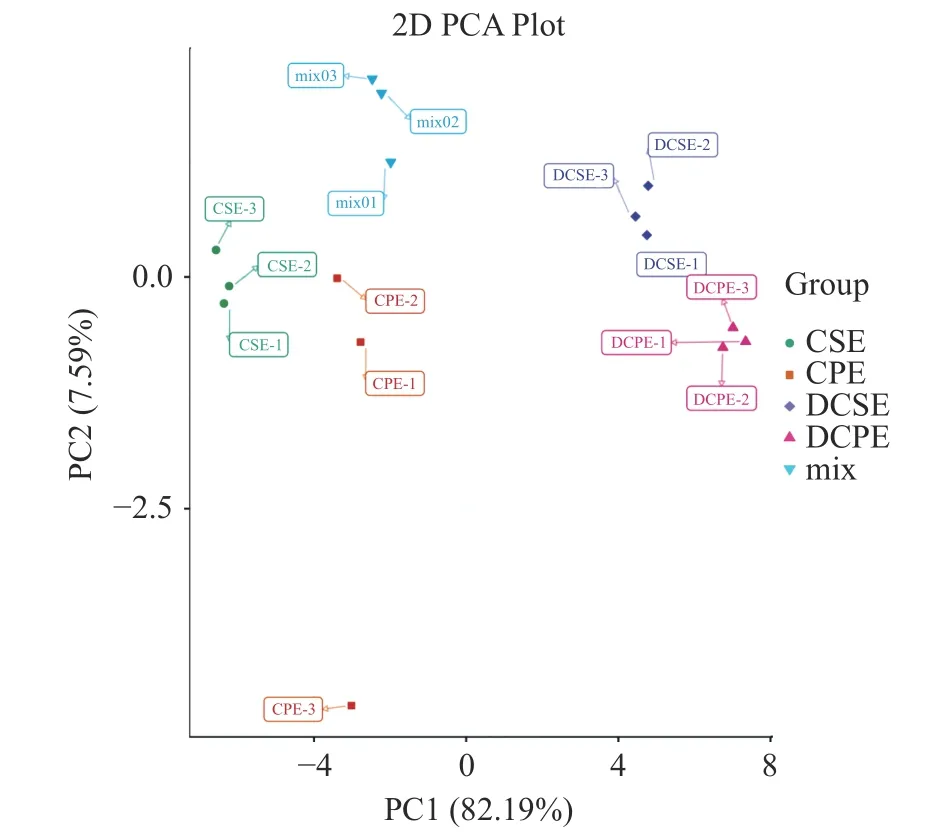
图2 主成分分析Fig.2 Principal component analysis
2.2.2 正交偏最小二乘法分析(OPLS-DA) 根据OPLS-DA 模型分析代谢组数据,绘制各分组的得分图,进一步展示各个分组之间的差异[27-28],通过去除不需要的差异,来筛选差异成分。评价模型的预测参数有和Q2,其中分别表示所建模型对X 和Y 矩阵的解释率,Q2表示模型的预测能力,这三个指标越接近于1 时表示模型越稳定可靠,Q2>0.5 时可认为是有效的模型,Q2>0.9 时为出色的模型。OPLD-DA 分析如图3所示。
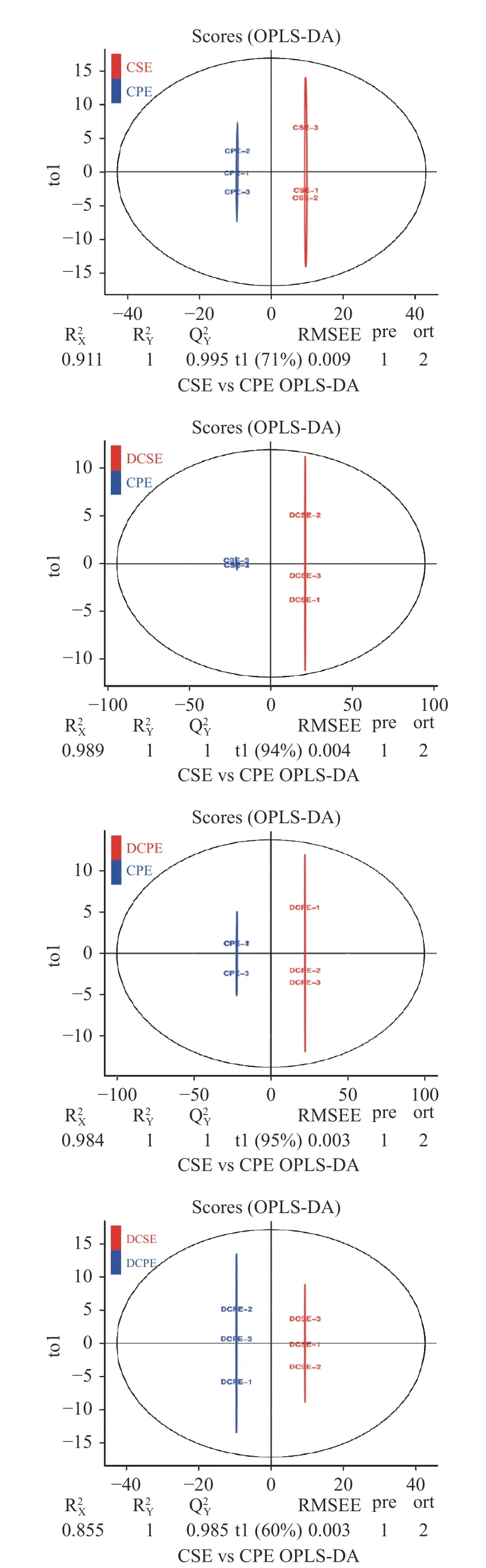
图3 OPLD-DA 分析Fig.3 OPLD-DA analysis



2.2.3 原花青素差异代谢物筛选 基于OPLS-DA分析结果,从获得的多变量分析OPLS-DA 模型的变量重要性投影(variable importance in project,VIP),可以初步筛选出比较组间差异代谢物。VIP 值表示对应代谢物的组间差异在模型中各组样本分类判别中的影响强度,VIP≥1 的代谢物则为差异显著,见表3~表6。VIP 值越大,说明该差异代谢物对样品组间的分类判别的影响强度和解释能力越强[29]。CSE vs CPE 比较组存在的差异代谢物共有16 种(下调15 种,上调1 种),DCSE vs DCPE 比较组存在的差异代谢物共有12 种(下调12 种,上调0 种),CSE 和DCSE 比较组存在的差异代谢物共有16 种(下调16 种,上调0 种),CPE 和DCPE 之间存在的差异代谢物共有17 种(下调17 种,上调0 种)。CSE vs DCSE、CPE vs DCPE 比较组中显著差异代谢物只有下调化合物,这表明在消化过程中,原花青素类化合物降解为其他化合物。在此基础上,考虑到有些代谢物的含量较小,存在偶然误差的可能性较大,故本文仅取含量排名前20 种的代谢物进行差异代谢物分析。

表3 CSE 和CPE 的显著差异代谢物Table 3 Significantly different metabolites between CSE and CPE

表6 CPE 和DCPE 的显著差异物Table 6 Significant difference between CPE and DCPE
从表4 和表5 可以看出,对于初始样品和消化样品(CSE 和DCSE、CPE 和DCPE),它表明代谢物中原花青素类的结构在消化过程中显著改变,如板栗壳和囊衣中的没食子儿茶素-儿茶素-儿茶素的VIP值分别为5.82 和5.55,说明其在消化体系中,降低程度较高,分别达到了98.23%和97.86%。与OPLSDA 结果相互验证。因此,在模拟体外消化过程中,原花青素类物质含量普遍下降,转化为其他种类的物质。在CSE 和CPE 中检测出的原花青素类物质中,原花青素C1、表儿茶素、儿茶素等有较多学者研究,但四羟基黄烷酮-(4α-8-表儿茶素)*、2α,3α-环氧-5,7,3',4'-四羟基黄烷-(4β-8-表儿茶素)*、赤芍素等物质少有学者研究,甚至未深入了解其结构和功能特性。

表4 DCSE 和DCPE 的显著差异物Table 4 Significant difference between DCSE and DCPE

表5 CSE 和DCSE 的显著差异物Table 5 Significant difference between CSE and DCSE
2.2.4 原花青素差异代谢物富集分析 利用差异代谢物KEGG ID 对显著差异的原花青素化合物进行通路富集分析[30],代谢通路富集分析结果以气泡图的形式展示,见图4。图4A 中每一个纵坐标代表一条代谢通路,共有5 个,即在KEGG 中查询到了5 个代谢通路,分别为新陈代谢途径、类黄酮生物合成、次级代谢产物的生物合成、苯丙烷类生物合成、AMPK 信号通路。图4B 中,也有5 个代谢途径,与图4A 一致。在图4A 中,苯丙烷类生物合成气泡颜色较深,说明这些代谢途径在模拟消化过程中,变化较大。在图4B 中,气泡颜色普遍较深,但苯丙烷类生物合成最深,说明它在模拟消化过程中,变化最大。
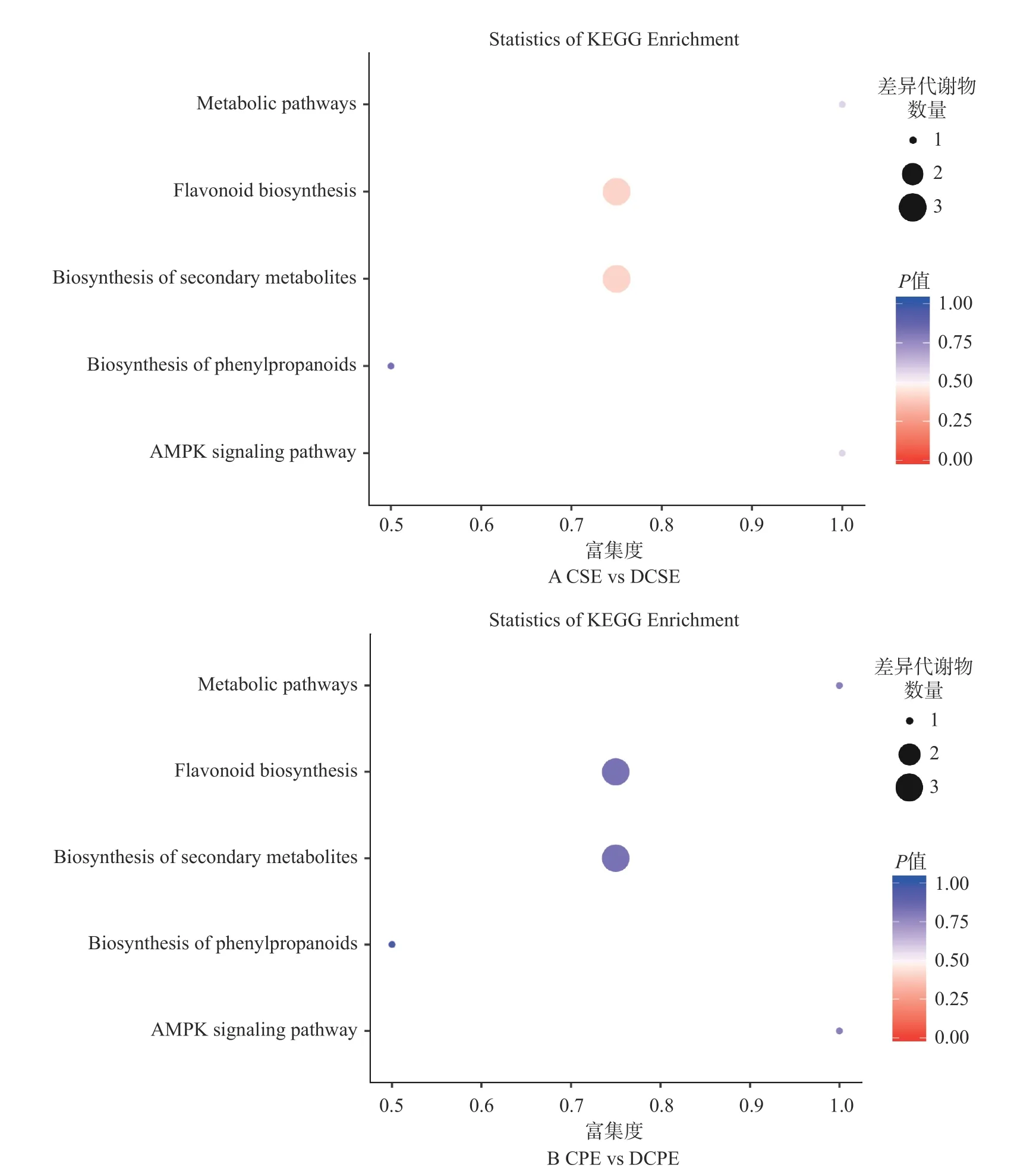
图4 板栗壳和囊衣组间和消化前后显著性差异原花青素类物质的KEGG 富集图Fig.4 KEGG enrichment of procyanidins between chestnut shell and capsule coating groups and before and after digestion
由表7 知,在模拟胃肠消化过程中,板栗壳和囊衣中原花青素类物质的差异代谢物有表儿茶素(C09727)、表没食子酸儿茶素(C12136)、没食子儿茶素(C12127)、表没食子儿茶素没食子酸酯*(C09731)。其中,表儿茶素是一种黄酮类化合物,属于黄烷醇类化合物它不仅对心脑血管有防治作用[31],而且在预防肿瘤和抗氧化性方面作用显效[32]。
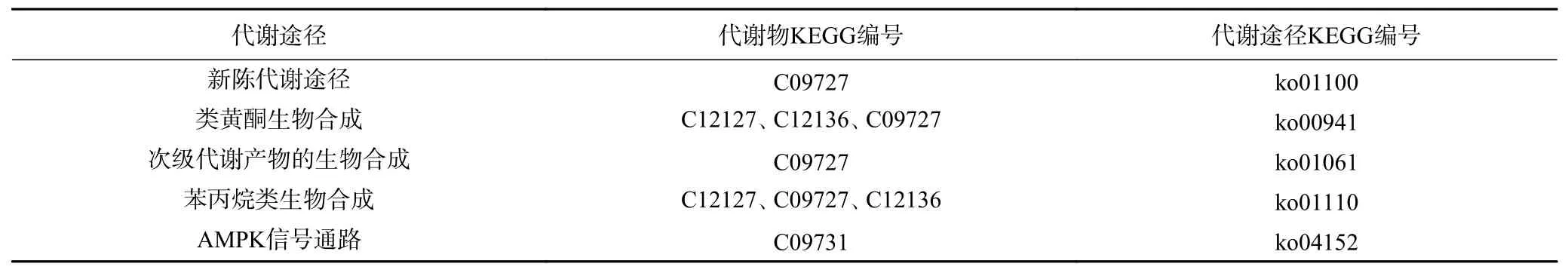
表7 CSE vs DCSE 以及CPE vs DCPE 差异组分参与的代谢途径Table 7 Metabolic pathways involved in different components of CSE vs DCSE and CPE vs DCPE
本实验通过KEGG 富集差异组分得到的5 条代谢通路,其中板栗壳和囊衣中的原花青素在模拟胃肠消化过程中,主要通过苯丙烷类生物合成的方式发生了降解,导致其含量降低。这些变化是导致原花青素类物质生物利用率低的主要原因。对多酚的影响,然后总结肠消化环境影响了苯丙烷类生物合成,导致单体化合物含量降低。
3 结论
本实验以板栗壳和囊衣提取物中的原花青素类为研究对象,采用基于UPLC-MS/MS 的广泛靶向代谢组学技术,研究板栗壳和囊衣原花青素类物质在体外消化过程中的代谢物种类和含量变化。在板栗壳和囊衣的组分分析中,我们发现了四羟基黄烷酮-(4α-8-表儿茶素)*、2α,3α-环氧-5,7,3',4'-四羟基黄烷-(4β-8-表儿茶素)*、赤芍素等几类物质少有学者研究,后续研究可对这些原花青素类物质的结构和功能特性做进一步研究。从含量上分析,CSE 和CPE中的原花青素类物质在消化后均显著降低。其中,没食子儿茶素-儿茶素-儿茶素降低程度最高,在板栗壳和囊衣两类样品中分别达到了98.23、97.86%。CSE vs DCSE 分析结果显示,板栗壳原花青素类物质中表儿茶素、原花青素C2、原花青素A1、没食子儿茶素、没食子儿茶素-儿茶素-儿茶素等16 种原花青素类化合物均呈显著下调,CPE vs DCPE 分析结果显示,板栗囊衣原花青素类物质中没食子儿茶素-儿茶素-儿茶素、没食子儿茶素、没食子酸儿茶素没食子酸酯、表没食子儿茶素没食子酸酯*等17 种原花青素类化合物均呈显著下调。在未来研究中,可以考虑设计靶向释放载体对原花青素类物质进行包埋,以提高其生物利用率。
