不同提取工艺下牛骨胶原蛋白的结构特性
2022-08-03任戈一马雪莲齐海雯冰玛拉措张书尧颜海燕
任戈一,马雪莲,潘 丽,齐海雯,冰玛拉措,张书尧,颜海燕
(石河子大学食品学院,新疆石河子 832000)
我国是畜禽肉类生产和消费大国,2019 年我国畜禽肉总产量为7758.78 万t[1],其中牛肉产量为667万t。然而,在牛肉的生产消费过程中,牛骨作为主要副产物,约占牛总体重的20%~30%。胶原蛋白为牛骨中主要蛋白质,含量高达90%以上[2],胶原蛋白具有乳化、凝胶、起泡等功能特性,同时还具有促进新陈代谢,延缓衰老等生理功能。此外,其中含有多种人体必需氨基酸,含量为39.6 mg/100 g[3],能够满足不同人群对氨基酸的需求,因此骨胶原蛋白的提取及应用已经成为科研工作者的关注热点。
目前,胶原蛋白提取的常用方法有:酸法、酶法、碱法、水热法。酸法提取反应迅速、提取时间较短,且原料提取较彻底,得到的胶原蛋白结构较为完整,但由于酸具腐蚀性,设备易老化,设备费用增加;酶法提取是加入特定的蛋白酶以增进胶原蛋白非螺旋区段肽键降解,通常不会引起胶原蛋白三股螺旋结构变化[4],且能够维持其特有的生物活性[5];碱法提取虽比较迅速,但碱性条件下会破坏胶原蛋白中的羟基和巯基并使得某些氨基酸消旋,蛋白质结构发生变化,最终影响其功能特性,产生“三致”毒害性[6],此方法逐渐被酸法或酶法所替代;热水提取的胶原蛋白由于长时间在较高的温度下浸提,破坏其部分结构,从而影响其功能特性。
现阶段,有关胶原蛋白的提取主要集中于提取方法及其条件优化的研究,但不同提取方法得到的胶原蛋白结构差异的研究少有报道。胶原蛋白结构决定胶原蛋白功能特性,研究不同提取方法下胶原蛋白结构的差异,可为其后续的功能特性的研究提供基础的理论依据。因此,本课题采用酸法及酶法提取工艺提取牛骨胶原蛋白,研究不同提取方法下胶原蛋白结构特性的差异并分析其中的原因,为有效利用牛骨资源和研究牛骨胶原蛋白的相关功能特性提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
西门塔尔牛股骨 石河子市友好超市;胃蛋白酶(3000U/mg) 上海麦克林生化科技有限公司;三羟甲基氨基甲烷、MD10 透析袋(8~14 kDa) 北京索莱宝科技有限公司;考马斯亮蓝R-250、溴酚蓝 德国Meker 公司;冰乙酸、柠檬酸、溴化钾等 均为国产分析纯。
PG-360 型强力碎骨机 廊坊市惠友机械有限公司;GNM-130AQ 型骨泥磨 廊坊市惠友机械有限公司;X7 型酶标仪 基因有限公司;T2A 型凝胶成像仪 美国Bio-Red 公司;FEI Quanta 200 型扫描电子显微镜 荷兰FEI 公司;TENSOR 27 型傅里叶变换红外光谱仪 瑞士Bruker 公司
1.2 实验方法
1.2.1 脱脂脱钙骨粉的制备
1.2.1.1 原料前处理 去除新鲜牛骨表面的碎肉、脂肪、软骨等杂质,将其处理成为约10 cm×10 cm 大小碎块,破骨机对牛骨块破碎后用纱布吸水分并晾干,碎骨物料于骨泥机研磨,重复上述吸水步骤,真空包装后于-20 ℃保存备用。
1.2.1.2 碱洗 根据公维洁等[7]的方法稍作改动。以料液比1:5 g/mL 加入并于4 ℃条件下震摇浸泡12 h,每隔6 h 更换一次溶液,目的是除去杂蛋白质,提高胶原蛋白纯度。
1.2.1.3 脱脂处理 根据秦娜娜[8]的方法稍作改动。将碱洗所得的原料反复冲洗至中性,沥干后以体积比1:5 加入并于4 ℃条件下震摇脱脂,每5 h 更换一次溶液,至溶液表面无明显脂肪液滴。
1.2.1.4 脱钙处理 采用南学敏[9]方法稍作改动。将脱脂所得原料反复冲洗至中性,沥干后,于4 ℃条件下脱脂物料以体积比1:10 混合,每隔6 h 更换一次溶液,外液中钙含量参照国标GB 5009.92-2016[10]的EDTA 滴定法测定,至溶液中无钙含量则表明脱钙完全。
1.2.2 胶原蛋白的提取
1.2.2.1 酸法提取 向骨样中分别加入0.5 mol/L 乙酸溶液、0.5 mol/L 柠檬酸溶液,料液比为1:5 g/mL,震摇浸提24 h,收集上清液,调节上清液中NaCl 终浓度至0.9 mol/L,加入三羟甲基氨基甲烷(Tris)(6 g/L),调节pH7.5,搅拌均匀静置过夜后,4 ℃、5000 r/min 离心15 min,沉淀物真空冷冻(-59.6 ℃,88~90 mT)干燥后得酸溶性胶原蛋白,分别记为ASC1、ASC2。
1.2.2.2 酶法提取 采用Shaik 等[11]方法稍作改动,向骨样中分别加入0.5 mol/L 的乙酸溶液和胃蛋白酶,0.5 mol/L 的柠檬酸溶液和胃蛋白酶,胃蛋白酶添加量均为20 U/mg,料液比为1:5 g/mL,震摇浸提24 h。收集上清调节pH>8 灭酶,并调节溶液NaCl终浓度至0.9 mol/L,并加入Tris(6 g/L),pH 调至7.5,搅拌均匀静置过夜后,4 ℃、5000 r/min 离心15 min,沉淀物真空冷冻(-59.6 ℃,88~90 mT)干燥后得酶溶性胶原蛋白,分别记为PSC1、PSC2。
1.2.2.3 胶原蛋白得率计算 对不同提取方法下得到的酸溶性胶原蛋白与酶溶性胶原蛋白的质量进行测定,并计算胶原蛋白得率。胶原蛋白得率计算公式如下:

1.2.3 胶原蛋白纯化 参考刘丽莉等[12]的方法稍作改动。对所得胶原蛋白粗品用0.5 mol/L 冰醋酸再次溶解后装入透析袋(8~14 kDa),先用0.1 mol/L 冰醋酸透析2 d,再用蒸馏水透析2 d,每隔12 h 换一次透析袋外液。透析结束后沉淀物冷冻(-59.6 ℃,88~90 mT)干燥即得相对较纯的骨胶原蛋白,凯氏定氮法测定蛋白质含量,-20 ℃贮存备用。
1.2.4 胶原蛋白结构测定
1.2.4.1 紫外光谱分析 参考李秋雨等[13]方法并稍作修改。2 mg/mL 的胶原蛋白溶液。室温条件下用紫外分光光度计于200~400 nm 波长范围内进行扫描,波长间隔为1 nm,以蒸馏水为空白对照。
1.2.4.2 扫描电子显微镜分析 参考贾伟[14]方法并稍作改动。使用手术刀将适量冻干后的牛骨胶原蛋白切成约3×3×2 mm 的薄片均匀粘贴在双面导电胶上,真空喷金后进行牛骨胶原蛋白微观结构扫描观察,放大倍数为500 倍,加速电压为1.0 kV。
1.2.4.3 SDS-PAGE 分析 将蛋白质样品溶液与2x 样品缓冲液按照1:1 比例混合后,沸水浴5 min,冷却后取上清液15 μL 上样。浓缩胶10%,分离胶5%。采用直压恒流电源,浓缩胶电压120 V,分离胶电压160 V,结束后,用考马斯亮蓝R-250 染色40 min,脱色至透明后,用凝胶成像仪观察分析[15]。
1.2.4.4 傅里叶红外色谱分析 参考蔡路昀等[16]的方法:取一定质量的牛骨胶原蛋白与等量的溴化钾混合研磨压片,置于多次衰减全反射附件上扫描,采用OMNIC 软件记录光谱图,扫描波长范围设置为4000~450 cm-1,分辨率为1 cm-1
1.2.4.5 蛋白质表面疏水性测定 1 mg/mL 蛋白样品溶液取1 mL 加入100 μL 1 mg/mL 的溴酚蓝(BPB),混合5 min 后,于4 ℃下,5000 r/min 离心15 min,取上清液在595 nm 下测定其吸光值,记作A。同时以磷酸盐缓冲液作空白对照,记作A0[17],计算如下:

1.3 数据处理
每个指标至少平行测定三次,利用Excel 对数据进行整理,结果用Mean±SD 来表示,并采用SPSS软件进行数据分析和差异显著性分析(ANOVA)检验(P<0.05)。使用Origin 2018 进行数据分析、图表绘制并进行结果分析。
2 结果与分析
2.1 胶原蛋白得率
不同提取方法下胶原蛋白得率如图1所示。由图1可知,ASC1,ASC2 胶原蛋白得率分别为2.23%、2.02%,PSC1,PSC2 胶原蛋白得率则可达到3.23%、3.01%。酶法提取胶原蛋白得率显著高于酸法(P<0.05),且乙酸的提取效率略高于柠檬酸。酶法(PSC1和PSC2)胶原蛋白得率高于酸法(ASC1 和ASC2)的原因可能是在最适反应条件下,酶促反应的高效性和专一性使得胶原蛋白得率更高。ASC1 与ASC2相比,ASC1 的得率高于ASC2 的原因可能是相同摩尔浓度下(0.5 mol/L),H+的解离程度不同,使得最终溶液的pH 不同,因此,相同浓度下,柠檬酸的pH 高于乙酸,影响胶原蛋白的提取效果,最终造成ASC1的得率高于ASC2。王晓军等[18]使用乙酸和胃蛋白酶提取牦牛骨胶原蛋白,其酸法和酶法提取胶原蛋白的得率分别为2.24%、3.32%。胡建平[19]采用胃蛋白酶在不同酸性环境下酶解鱼鳞得到胶原蛋白,实验结果表明乙酸的提取率高于柠檬酸和盐酸,本研究结果为酶法胶原蛋白得率高于酸法,与上述结论相符。

图1 不同提取方法下的胶原蛋白得率Fig.1 Collagen yield under different extraction methods
2.2 紫外光谱分析
由图2可知,不同方法提取得到的牛骨胶原蛋白的紫外光谱分别位于228、231、233、231 nm 处。四种胶原蛋白的紫外光谱基本一致,这是由于胶原蛋白不含有色氨酸,且苯丙氨酸和酪氨酸含量极低,使得紫外扫描下胶原蛋白在280 nm 处基本不出现吸收峰,而在230 nm 波长附近出现最大吸收峰,这可能由于胶原蛋白中的羰基、羧基和酰胺基团共同作用所致[20]。酸法和酶法提取得到的胶原蛋白紫外吸收峰不一致,可能是酶法提取过程中蛋白质的特定切割位点使最终得到的氨基酸组成和种类存在部分差异。ASC1 和ASC2 紫外最大吸收峰差异可能是由于提取胶原蛋白的酸种类及pH 不同影响其特定氨基酸的比例的大小,从而使得提取得到的胶原蛋白于230 nm 处发生向左或向右的偏移。何兰[21]利用酸法、酶法提取长骨中胶原蛋白在223、219 nm 处有最大紫外吸收值,Madhuri[22]报道的鱼皮胶原蛋白在230 nm 波长附近具有最大紫外吸收值,与本实验结果一致。

图2 不同提取方法下的胶原蛋白紫外光谱Fig.2 Ultraviolet spectra of collagen under different extraction methods
2.3 SDS-PAGE 凝胶电泳分析
对不同提取方法下得到的牛骨胶原蛋白进行聚丙烯酰胺凝胶电泳分析,如图3所示。由图3可知,不同提取方法制得的胶原蛋白均具有β(约250 kDa)、α1(约135 kDa)、α2(约130 kDa)三条显著条带。ASC1、ASC2 的β链条带细、颜色浅,而PSC1、PSC2 的β链条带较为明显,这可能是由于胃蛋白酶的存在促使胶原蛋白中γ链降解为β链而造成PSC1、PSC2 的β链条带较深。ASC1、ASC2 的α1、α2肽链含量略低于相应的PSC1、PSC2 的两条α肽链,这可能是胃蛋白酶的作用使部分胶原蛋白降解成小分子,使PSC1 和PSC2 的两条α肽链含量增多。β二聚体为两条α链形成的胶原分子,β链的存在是胶原蛋白高度交联的表现,由此可判断出所得到的胶原蛋白符合Ⅰ型胶原蛋白的特征;与上述紫外光谱结果一致。本研究结果与海蜇[23]、红鼓鱼鳞[24]、尼罗罗非鱼鳞[25]等其他来源的Ⅰ型胶原蛋白电泳图相似。此外,与酸溶性胶原蛋白相比,酶溶性胶原蛋白在100 kDa 附近存在浅细的条带,其原因可能是酶法提取过程中酶的作用使胶原蛋白酶解为其他小分子[26]。
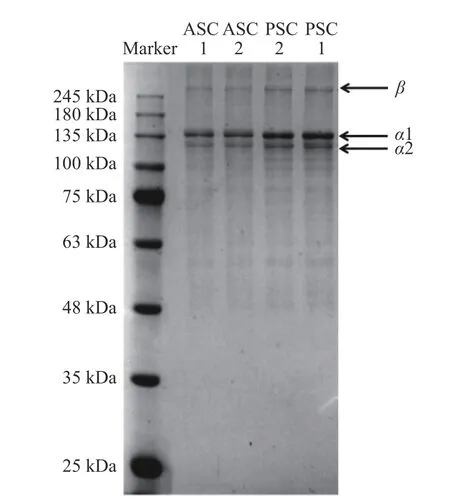
图3 不同提取方法下胶原蛋白的SDS-PAGEFig.3 SDS-PAGE of collagen under different extraction methods
2.4 表面疏水性分析
研究发现,蛋白质疏水性在其构象和溶解性、乳化性等功能特性方面发挥着关键作用,因此对疏水性进行测定可以评价蛋白质三级结构的改变。本研究通过测定并计算结合态溴酚蓝的量来表征胶原蛋白的疏水性[27]。对不同提取工艺下牛骨胶原蛋白的表面疏水性进行测定,结果如图4所示。由图4可知,PSC1 胶原蛋白的表面疏水性可达5.49 μg,ASC2 胶原蛋白的表面疏水性低至2.64 μg。且ASC2、PSC1、PSC2 表面疏水性差异显著(P<0.05),但ASC1 和PSC2 差异不显著。酶法提取的胶原蛋白疏水性较高可能是由于在提取过程中,胃蛋白酶切割牛骨蛋白的非螺旋区段,使所得胶原蛋白疏水性大幅增大;此外,胃蛋白酶特定的酶切位点使胶原蛋白的疏水性基团暴露,特别是疏水性氨基酸含量增多,表面疏水性增加。ASC1 显著(P<0.05)高于ASC2 的原因可能是乙酸的pH 较低,在此条件下提取的胶原蛋白的表面疏水基团(如色氨酸、苯丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丙氨酸、脯氨酸和蛋氨酸等疏水性氨基酸)暴露更多,因此ASC1 较ASC2 的表面疏水性大。

图4 不同提取方法下牛骨胶原蛋白的表面疏水性Fig.4 Surface hydrophobicity of bovine collagen under different extraction methods
王立宇等[28]采用酸酶法提取了室温下碱发的毛肚中胶原蛋白并利用溴酚蓝法测定其表面疏水性,其值达到72~75 μg。与上述研究结果对比,本实验测得胶原蛋白的表面疏水性较小,可能是由于胶原蛋白的来源、提取方法等因素的差异,使得疏水性氨基酸被包裹在内部,游离的疏水性氨基酸较少,造成牛骨胶原蛋白表面疏水性小。
2.5 红外光谱分析
图5为采用酸法(ASC1、ASC1)及酶法(PSC1和PSC2)提取工艺下牛骨胶原蛋白在波数4000~450 cm-1红外吸收谱图。如图5所示,从下而上的四种胶原蛋白的红外光谱特征吸收峰相似,酸溶性胶原蛋白与酶溶性胶原蛋白在3400 cm-1附近均出现明显的吸收峰,其为酰胺A 带,这是由于N-H 收缩振动引起,说明肽链之间存在氢键,且其为蛋白质的特殊吸收峰;图中四种胶原蛋白酰胺Ⅰ带吸收峰分别为1551.75、1605.75、1618.18、1581.54 cm-1,这是由于C-O 伸缩振动会引起酰胺Ⅰ带(1550~1660 cm-1)出现吸收峰,其与蛋白质的二级结构密切相关;四种胶原蛋白分别在1421.45、1558.39、1504.39、1492.82 cm-1处出现吸收峰,其值在酰胺Ⅱ带的特征吸收峰1400~1600 cm-1范围内,酰胺Ⅱ带与蛋白质的C-N 收缩振动和N-H 弯曲振动有关;此外,还与甘氨酸骨链及脯氨酸侧链的-CH2 摆动引起的振动有关[3],从而使得胶原蛋白在1400~1500 cm-1存在复杂的吸收峰;四种胶原蛋白分别在1317.30、1300.82、1213.12、1323.09cm-1出现酰胺Ⅲ带的特征吸收峰,可能是侧链基团会出现多种类型的变形振动造成的。因此,红外光谱表明四种胶原蛋白二级结构保留完整,间接说明了所提的胶原蛋白保留完整。本研究结果与Gao 等[29]对羊骨胶原蛋白结构,Maria等[30]对罗非鱼皮,Ali 等[31]对金鱼皮的研究结果一致,酶法和酸法提取均可以保留胶原蛋白的三股螺旋结构。牛骨胶原蛋白的吸收峰由酰胺A、B 和酰胺Ⅰ、Ⅱ、Ⅲ组成。

图5 不同提取方法下胶原蛋白的红外光谱Fig.5 Infrared Spectra of collagen under different extraction methods
2.6 扫描电镜分析
不同提取方法下得到牛骨胶原蛋白扫描电镜结果如图6。由图6可知,提取方法显著影响胶原蛋白的结构(P<0.05)。酸溶性胶原蛋白较为松散,呈现出纤维状缠绕状态。ASC1、ASC2 分布均匀,具有多孔的网络结构。胶原蛋白在提取过程中,通过氢键和疏水作用等形成纤维状[32],不同的作用力导致胶原蛋白之间孔径大小不同,外部特征等都存在一定的差异。酸法提取过程中胶原蛋白本身的空间结构没有被破坏,而PSC1、PSC2 的扫描电镜结果表明酶对胶原蛋白的结构有一定的影响,但其网状结构仍然得到保留,纤维化相较明显。王杉杉等[33]采用不同的提取方法提取牦牛皮胶原蛋白并进行电镜扫描发现,胶原蛋白的结构和形貌存在显著差异,Li 等[34]对中华绒鳖甲壳组织胶原蛋白电镜扫描后,结果表明酸法提取的胶原蛋白表现出更松散更多孔的网状结构,本研究结果与上述研究一致。通过对ASC1、ASC2 和PSC1、PSC2 的电镜扫描结果进行分析可知,胶原蛋白的提取方法不同,其形状结构也截然不同。综合紫外可见光谱、红外光谱、SDS-PAGE 和扫描电子显微镜结果表明,酸法和酶法所提取的蛋白质均保留了其特有的结构。

图6 不同提取方法下胶原蛋白的扫描电镜图Fig.6 Scanning electron microscope images of collagen under different extraction methods
3 结论
本研究以牛骨为研究对象,采用不同提取方法分别得到胶原蛋白ASC1、ASC1、PSC1 和PSC2,并对其性质进行比较分析,结果表明PSC1(乙酸和胃蛋白酶)得率可达3.23%,四种胶原蛋白均由β(约250 kDa)、α1(约135 kDa)、α2(约130 kDa)三种亚基构成,为典型的Ⅰ型胶原蛋白,空间结构也均保留完整;然而,酸法制备的胶原蛋白表现出更松散、更多孔的网状结构,而酶法提取的胶原蛋白的网状结构保留更完整,纤维化更明显。本研究为牛骨胶原蛋白的结构特性研究提供了一定的理论基础,为牛骨胶原蛋白的高值化利用提供了理论依据。但大规模、短时间提取和生产牛骨胶原蛋白的最佳工艺和过程控制条件仍需继续探讨,牛骨胶原蛋白的工业化制备及应用仍需深入探究。
