基于可培和免培法探究大曲生产环境空气微生物群落结构的时空性特征
2022-08-03刘英杰唐慧芳张宿义王小军吴重德周荣清
刘英杰,黄 钧,唐慧芳,张宿义,董 异,王 超,王小军,吴重德,金 垚,周荣清,2,
(1.四川大学轻工科学与工程学院,四川成都 610065;2.国家固态酿造工程技术研究中心,四川泸州 646699;3.泸州老窖股份有限公司,四川泸州 646699)
中国传统白酒生产过程中,大曲既是粗酶制剂和发酵剂[1],也是重要的酿酒原料之一。酿酒所需的功能微生物多数是源于大曲,而大曲中的微生物主要富集于生产环境及设施,环境群落结构和多样性及过程参数显著影响大曲的群落结构及代谢物[2-4]。
环境微生物是导致大曲功能菌群的时空性差异的关键因素。近十年间,环境的群落与大曲群落及代谢物的相关性被广泛关注。可培与免培方法揭示了浓、酱香型大曲的核心菌群构成各有特点[5-6],并分离到一些功能菌株。夏、秋两季酱香型大曲的真菌群落结构和演变规律存在较大差异[7],且与环境的温湿度密切相关[8],类似的结果也曾被相关的文献报道[9-10]。真菌群落的结构与小生境密切相关[4],大曲生产环境的空气及大曲细菌群落的变化同样具有相关性[11],清香型白酒发酵过程中耐酸乳杆菌(Lactobacillus. acetotolerans)主要源于空气和发酵罐[12],应用溯源技术也探究了小生境与白酒生产过程主要环节群落的关系[4,13-14]。然而,这些结果都难以解释大曲生产环境中微生物群落的时空性特征。鉴于现有常规技术的局限性,如可培方法仅能检出0.1%~1%的环境存在的微生物[15-16],而基于PCR 的高通量测序显著提高检出微生物种类的范围[17],但量化的结果有待完善,两种方法同时用于探讨小生境群落与大曲群落结构特点、二者间相互作用和变迁规律以及稳定性评估[18]等则是解决当前技术瓶颈的有效措施。
为揭示大曲生产环境空气微生物群落的时空性特征,本文以相同地域不同地点且使用周期差异明显的浓香型大曲生产地为对象,采用可培和免培技术研究了冬、春和夏三个季节环境空气中微生物群落的演变规律,解析了环境因子与环境空气群落结构的相关性,为探讨大曲与环境微生物的相互关系及溯源性研究奠定方法学基础,并为生产区域营造大曲生产的最佳环境微生物群落组成奠定基础。
1 材料与方法
1.1 材料与仪器
空气样品 采集于石堡湾的泸州老窖制曲生态园(简称老厂,LC,四川省,泸州市,龙马潭区,28°55'22''N、105°28'36''E)和黄舣的泸州老窖制曲中心(简称新厂,XC,四川省,泸州市,江阳区,28°51'46''N、105°34'14''E),前者始于上世纪90 年代,已使用25年,后者自2019 年建成仅使用2 年,两厂生产的大曲为同类型大曲,即浓香型大曲。采样地点和具体位置如图1 和表1所示,采样时间分别是2021 年1 月(冬)、3~5 月(春)和7 月(夏)等三个季节,缺少秋季数据是老厂因地方政府建设规划的要求,在夏季须整体拆除,同时春季环境温度、湿度波动较大,将春季细分为初春(3 月)、仲春(4 月)、暮春(5 月)三季;Fast DNA SPIN 基因提取试剂盒 美国MP Biomedicals公司;Q5 DNA 高保真聚合酶 美国New England Biolabs 公司;琼脂糖和琼脂糖凝胶电泳缓冲液TAE、PicoGreen dsDNA 检测试剂盒 美国Invitrogen 公司;Marker DL2000 日本Takara 公司;Agencourt AMPure Beads 美国Beckman Coulter 公司;孟加拉红琼脂培养基和PCA 琼脂培养基 北京奥博星生物技术有限责任公司;纳他霉素 上海麦克林生化科技有限公司。

表1 采样位置及环境因子Table 1 Sampling locations and environmental factors

图1 老厂(A)和新厂(B)的采样位置Fig.1 Sampling locations of old plant (A) and new plant (B)
PSW-6 型筛孔撞击式采样器、PSW-Y 型液体撞击式采样器 常州普森电子仪器厂;AR866 风速仪泰安市瑞科航岳机械有限公司;CX31 显微镜 日本Olympus 公司;GL-20G-Ⅱ立式高速冷冻离心机上海安亭科学仪器有限公司;Nanodrop ND-1000 紫外分光光度计 美国ThermoFisher 公司;2720 PCR 扩增仪 美国ABI 公司;Gel DocTM XR+凝胶成像系统 美国Bio Rad 公司。
1.2 实验方法
1.2.1 免培养方法 空气样品通过液体撞击式采样器收集于15 mL 无菌的0.1 mol/L PBS 缓冲液中,采样期间正值大曲生产,天气晴朗或多云,平均风速<2 m/s,采样流量控制为12.0 L/min,采样时间为15 min,然后装入50 mL 无菌离心管,4 ℃保存待处理,采集完后及时在超净工作台中使用溶剂过滤器通过0.22 μm 硝酸纤维素滤膜进行抽滤,并将滤膜放回50 mL 离心管中,保存至-80 ℃冰箱待DNA 的提取、扩增。
1.2.2 可培养方法 参考GB 4789.2-2016 和GB 4789.15-2016,采用筛孔撞击式采样器将环境中的细菌和真菌分别撞击在添加0.1%纳他霉素的PCA 琼脂培养基(抑制霉菌和酵母)和孟加拉红琼脂培养基得以收集,采样流量28.3 L/min,采样时间各10 min,采样高度固定在1.2 m。样品采集后及时送往实验室,分别于37 和28 ℃培养细菌和真菌48 h,并对各级平板计数。
1.2.3 环境因子的测定 采样过程中,AR866 型风速仪和TES1360A 型温湿度计测量采样点的风速、温度和湿度,记录风向,并从中国环境监测总站查询记录大气污染物(PM2.5、PM10、NO2、SO2、O3、CO)和空气质量指数(air quality index,AQI)[19],具体见表1。
1.2.4 微生物的计数与分离 按照以下公式计算各采样点的菌落数。

式中:P 为空气细菌或真菌数(CFU/m3);N 为六级平板的细菌或真菌数;T 为采样时间(min);Q 为采样流量(28.3 L/min)。根据菌落形态特征和镜检结果,分别对细菌和真菌进行分类并编号,采用平板划线法和稀释涂布平板法对所选微生物进行分离纯化,挑选出单菌落,斜面培养后4 ℃冰箱保存,待分子生物学鉴定。
1.2.5 分子生物学鉴定 使用TSINGKE 植物DNA提取试剂盒(通用型)提取纯化的分离株的总DNA,分别使用16S 通用引物(27F/1492R)和ITS 通用引物(ITS1/ITS4)分别进行扩增、测序,测序结果在NCBI 数据库检索,确定其分类水平。
1.2.6 DNA 的提取、扩增及高通量测序 按照He等[20]和Tang 等[21]所述方法进行总DNA 提取和PCR扩增。按照Fast DNA SPIN 提取试剂盒供应商提供的操作程序提取空气样品的总DNA 后,Nanodrop ND-1000 测定其浓度和评估纯度,再用0.8%琼脂糖凝胶电泳估算其分子量大小。分别使用通用引物338F/806R 和通用引物ITS5F/ITS1R 扩增细菌16S rRNA基因的V3~V4 区和真菌rRNA 基因的ITS1 区。PCR扩增产物用Agencourt AMPure Beads 纯化,使用PicoGreen dsDNA 检测试剂盒定量。PCR 纯化产物送至上海派森诺生物科技有限公司,使用MiSeq 基因测序试剂盒v3 进行2×300 bp 双端测序。
1.2.7 生物信息学分析 采用QIIME pipeline 处理原始序列,依据Caporaso 等[22]所述方法去除低质量序列,包括长度<150 bp,序列平均质量<20,单碱基重复数>8 bp 以及模糊的碱基。最后利用UCLUST 算法将高质量的序列以97%的序列相似度聚成不同的操作单元(operational taxonomic unit,OTU)[23]。随后在Greengenes(Release 13.8,http://greengenes.secondgenome.com/)和UNITE(Release 8.0,https://unite.ut.ee/)数据库中检索比对这些序列,最后生成OTU 表,记录每个样本中各OTU 的丰度和分类。
1.3 数据处理
原始数据采用IBM SPSS Statistics 26.0 进行单因素方差分析,P<0.05 表示有统计学意义,所有试验平行3次,数据以平均值±相对标准偏差(relative standard deviation,RSD)表示。序列数据分析主要使用QIIME(v1.8.0)进行,使用R 软件(v4.0.5)进行组间相关性分析、主坐标分析(principal coordinate analysis,PCoA)和冗余分析(redundancy analysis,RDA),并采用贝叶斯算法软件SourceTracker(v1.0)[24]分别对新老厂内外环境空气微生物进行溯源分析,其他统计分析使用Origin 2021。
2 结果与分析
2.1 同域不同点空气中可培微生物群落结构及与环境因子的相关性探讨
同季节,同域不同点可培细菌存在显著差异,可培真菌除夏季外差异显著(P<0.05),可培真菌数高于细菌数,初春和仲春老厂真菌数显著高于新厂(P<0.05),夏季老厂细菌数显著高于新厂(P<0.05)。冬季时,老厂总菌数多高于新厂类似位置的,而在暮春和夏季,新厂持续生产,老厂因待变迁,偶尔生产,制曲车间菌群数小于前者(图2)。春季,新厂各采样点的菌群数是渐增,老厂则存在波动,可能与老厂间歇生产有关(图3)。仲春和暮春的温度和湿度适合微生物生长繁殖,两个环境中菌落数在仲春和暮春时达到峰值或转折点(图3)。总体上,冬、春、夏三季的菌群数是增加后降低的,季节间差异显著,且真菌群数较细菌群变化显著。

图2 同季节不同位置的微生物计数结果Fig.2 Microbial counting results at different locations in the same season

图3 相同位置不同季节微生物计数平均结果Fig.3 Average results of microbial counts in different seasons at the same location
菌落总数、细菌和真菌数与环境因子的Spearman 相关性结果(表2)显示,菌落数与环境温度正相关,但与湿度、风速、风向呈负相关。细菌数与空气污染指数多呈正相关,尤其是与O3浓度正相关性显著。真菌菌落数与环境温度正相关性显著,与除O3外的空气污染指数呈负相关性。温度显著影响可培微生物的生长,空气污染程度可能是导致群落不稳定的关键因素。曾报道风速导致真菌孢子浓度差异显著[25],大气中的O3抑制微生物生长[19],与当前的结果略有差异,可能与检出的种属有关,其原因待进一步探讨。

表2 可培微生物计数与环境因子的Spearman 相关系数Table 2 Spearman correlation coefficient between cultivable microbial count and environmental factors
2.2 可培微生物群落的差异性
基于形态特征获得的分离株,细菌的16S 系统发育树如图4A 和图4B所示。其中,细菌包括101个种,51 属,且老厂和新厂分别包含27 个属57 个种和24 个属44 个种。类似曾报道的结果[26],除专性或严格厌氧的拟杆菌门Bacteroidetes 难培养外,已鉴定的37 个属主要是Actinobacteria(15)、Proteobacteria(11)、Firmicutes(10)、Deinococcus-Thermus(1),前三者丰度分别为40.54%、29.73%和27.0%。优势菌都是Bacillus、Staphylococcus、Pseudomonas、Kocuria、Streptomyces等,老厂的数量高于新厂的,Agrococcus等13 个属仅在前者中是次优菌,Stenotrophomonas等10 个属则在后者是次优属。此外,空气中可培优势细菌可能对大曲优势细菌有贡献,如Bacillus subtilis和Bacillus velezensis[20]等。
可培真菌包括50 个属69 个种,老厂和新厂分别是29 个属37 个种和21 个属32 个种。真菌的ITS系统发育树如图4C 和图4D所示,真菌Ascomycota(18)、Basidiomycota(9)和Mucoromycota(3)的比例分别是60%、30%和10%,优势真菌属包括Aspergillus、Penicillium、Gladaxporism等,老厂霉菌和酵母数高于新厂的,Aspergillussp.、Rhizopussp.、Lichtheimia ramosa等和Saccharomycopsis fibuligera亦同样是大曲中检出的优势霉菌和酵母[6,7]。

图4 可培微生物的系统发育树及新老厂分类Venn 图Fig.4 Phylogenetic tree of culturable microorganisms and Venn diagram of new and old plant classification
2.3 免培微生物α-多样性及与环境因子的相关性探讨
各样品16S rRNA 基因V3~V4 区和ITS 区分别共检出22289 和44964 个OTU,两个生产地点的α-多样性差异如图5所示。同季节,两厂细菌的α-多样性仅略有差异,季节间差异显著。细菌丰富度和多样性从冬、春、夏季间是增后又减,在仲春季时最高,与冬和夏两季的差异显著(P<0.05)。真菌的多样性也类似细菌的,暮春时,α-多样性达到最大,显著高于初春的(P<0.05)。此外,真菌的α-多样性显著小于细菌的,且不同于可培的结果,可能是部分菌不可培[27]。

图5 不同季节环境空气的α-多样性Fig.5 α-Diversity of ambient air in different seasons
α-多样性与环境因子的组间Spearman 相关性分析(表3)结果显示,与可培结果类似,但真菌的丰富度与温度和湿度分别是显著正相关和显著负相关,这两个参数与细菌α-多样性分别呈负相关和正相关。可能由于细菌最适温湿度、营养需求(自养和异养)及好氧/厌氧的差异具有不同的生态位[28],所以群落会因扰动和环境变化改变其结构、生理功能和相互作用关系,真菌群落多样性则相对稳定[29]。类似曾报道的结果[30],空气污染指数与真菌多样性呈弱相关性,但与其丰富度呈强负相关。
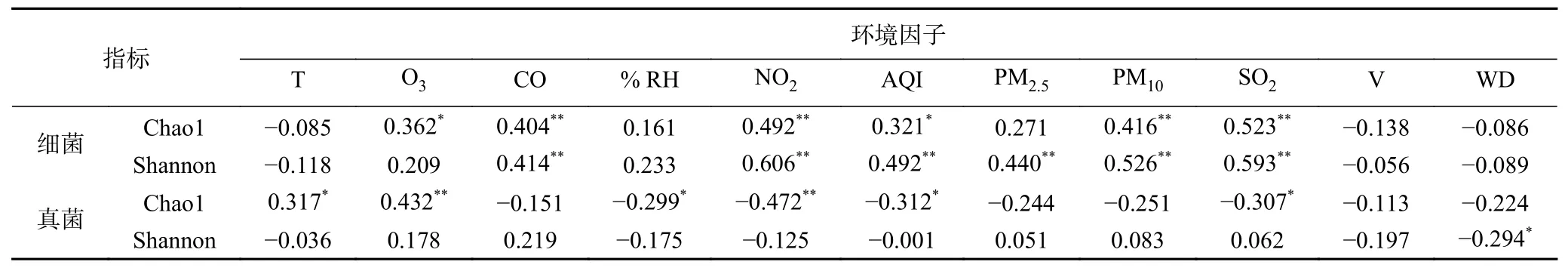
表3 α-多样性与环境因子的Spearman 相关系数Table 3 Spearman correlation coefficient between α-diversity and environmental factors
2.4 免培微生物群落的差异性
免培和可培菌群的组成在门水平上无显著性差异,属水平群落组成结构如图6所示,季节对同域不同小生境的群落影响显著,尤其是细菌菌群的结构和相对丰度。细菌菌群包括Proteobacteria、Acfinobacteria、Firmicutes、Bacteroidetes,其丰度分别在71.08%~99.54%、0.11%~24.22%、0.19%~5.73%、0.01%~1.07%,另外,Deinococcus-Thermus(0.04%~6.38%)也是优势细菌之一。优势细菌包括Pseudomonas、Acinetobacter、Rhodococcus、Staphylococcus及Bacillus等,其中Pseudomonas和Acinetobacter的丰度在冬、春、夏间分别是减后又增和增后又减。真菌菌群主要包括Ascomycota、Basidiomycota 和Mucoromycota,群落结构较类似且稳定,Ascomycota 中的Phialemoniopsis丰度较高。不同的细菌属,除Agrobacterium两种培养方法的结果是一致的,而Saccharomycopsis、Neurospora和Botrytis等3 个真菌属仅被可培方法确认。Pseudomonas、Staphylococcus、Bacillus、Weissella、Leuconostoc、Lactobacillus、Thermoactinomyces、Pantoea等细菌属和Aspergillus、Thermoascus、Pichia、Paecilomyces、Thermomyces、Rhizomucor、Rhizopus、Trichosporon等真菌属也是大曲的优势属[20],而Rhodococcus、Massilia、Stenotrophomonas、Cupriavidus等可能是浓香型大曲生产环境中独有的[31]。

图6 细菌(A)和真菌(B)的属水平群落组成Fig.6 Community composition at genus level of bacteria (A) and fungi (B)
2.5 免培微生物的β-多样性及与环境因子的相关性探讨
基于Bray-Curtis 距离的细菌和真菌的PCoA分析结果如图7所示。冬夏两季,老厂的细菌菌群组成差异显著,春季的与冬、夏两季的有很高的重叠率,新厂三季差异更显著,变异系数更大。两个生产环境的真菌群落结构非常类似,仅老厂的冬、春季节的少数样品的菌群组成略有差异,而新厂个别样品距离较远。由此可见,长期制曲小生境的菌群趋于稳定且丰富度更高。

图7 基于Bray-Curtis 距离的主坐标分析Fig.7 Principal coordinate analysis based on Bray-Curtis distance
小生境群落中优势属与环境因子的RDA 分析及网络互作关系如图8所示。环境因子与细菌属(至少在一个组内平均丰度大于5%,图8A)和真菌属(至少在一个组内平均丰度大于0.5%,图8B)的相关性分别是极显著和显著。Pseudomona与温度呈正相关而与湿度、大气污染指数等多呈负相关,Rhodococcus则是相反。Acinetobacter与Pseudomonas是负相关,具有明显竞争性(图8A 和图8C)。真菌受温度等影响较小,群落结构相对稳定。除Phialemoniopsis外,真菌与空气污染指数多呈负相关(图8B),Aspergillus与Phialemoniopsis是负相关性,而与多数的真菌正相关,真菌群节点联系(图8D)显著少于细菌的(图8C)。总之,细菌菌群结构更丰富,易受季节的影响,真菌的群落相对稳定。

图8 细菌(A,C)和真菌(B,D)的优势属与环境因子的相关性分析及优势属相关网络分析Fig.8 Correlation analysis between dominant genera of bacteria (A, C) and fungi (B, D) and environmental factors and correlation network analysis of dominant genera
基于贝叶斯算法软件SourceTracker(v1.0)的季节间不同位点,即楼内(sink)与楼外(source)的群落结构的溯源分析结果如图9所示,可见楼外空气群落对楼内环境的影响和贡献在不同季节存在差异,这为解释不同季节制曲环境不同和大曲微生物溯源提供了新的思路,但不同小生境内微生物存在的交换和驱动效应[32]对大曲群落结构的影响仍需待进一步探讨。

图9 楼内外空气真菌(A,C)和细菌(B,D)的溯源和弦图Fig.9 Tracing chord chart of air fungi (A, C) and bacteria (B,D) inside and outside building
3 结论
应用可培和免培方法探讨泸州老窖同域不同制曲小生境的空气微生物随季节的变化趋势的结果表明,可培微生物中细菌是优势,冬、春、夏三季的菌群数和α-多样性是先增后降的,且季节间差异显著,尤其对真菌群数和细菌群落结构影响显著,细菌的丰富度和多样性则是显著大于真菌的。环境空气中细菌和真菌分别由Acfinobacteria、Proteobacteria、Firmicutes、 Bacteroidetes 以 及 Deinococcus-Thermus 与Ascomycota、Basidiomycota 及Mucoromycota 等构成。同时,季节对同域不同小生境的群落影响显著,不同属的细菌菌群结构差异显著。空气中的Pseudomonas、Staphylococcus、Bacillus等8 个优势细菌和Saccharomycopsis、Lichtheimia等10 个优势真菌属可能是大曲中优势菌的来源。此外,环境温度和湿度也显著影响小生境群落结构,空气污染程度可能是导致群落波动的原因,长期的生产使用则使环境的物种数及多样性趋于丰富和稳定。研究结果表明制曲小生境的群落时空性特征显著,且为探讨大曲与环境微生物的相互关系及溯源性研究奠定了方法学基础。
