等离子体活化水-苯乳酸协同杀灭大肠杆菌O157:H7 作用及机制研究
2022-08-03赵电波王少丹郑凯茜相启森王博华张琪帆
赵电波,王少丹,郑凯茜,相启森,王博华,张琪帆
(1.郑州轻工业大学食品与生物工程学院,河南郑州 450001;2.河南省冷链食品质量与安全控制重点实验室,河南郑州 450001)
等离子体活化水(Plasma-activated water,PAW)又称为等离子体处理水(Plasma-treated water,PTW),主要通过低温等离子体放电装置在水表面或水下放电而产生,富含活性氧(Reactive oxygen species,ROS)、活性氮(Reactive nitrogen species,RNS)等物质。PAW 是一种新兴的非热杀菌技术,在食品保鲜领域具有广泛的应用前景[1]。但研究发现,蛋白质、脂质等食品组分会显著降低PAW 对微生物的杀灭效果,因此需要和温热、防腐剂、表面活性剂等协同使用以增强杀菌效果[2-7]。Choi 等[5]发现,经PAW和60 ℃温热协同处理后,腌制白菜中的菌落总数和接种的食源性致病菌数量均显著减少。此外,PAW与尼泊金丙酯等防腐剂联合使用时其杀菌效果也显著增强[6-7]。例如,PAW 和4 mmol/L 尼泊金丙酯联合处理10 min 后,大肠杆菌O157:H7 减少了6 lg CFU/mL,而PAW 和尼泊金丙酯单独处理组仅分别降低了1.54 和2.18 lg CFU/mL[6]。
苯乳酸(Phenyllactic acid,PLA)又名β-苯基乳酸或3-苯基乳酸,是一种具有广谱抑菌作用的生物防腐剂,对细菌和大部分真菌具有良好的抑制作用[8-9]。与传统化学防腐剂相比,PLA 具有安全性高、来源广泛、稳定性强、亲水性好等优点。已有报道证实PLA 可降低乳制品、焙烤类食品中的微生物数量,其在食品保鲜领域的应用受到广泛关注[10-11]。前期研究发现,PAW 与PLA 有良好的协同杀菌效果,但其作用机制尚不明确。因此,本研究以常见的大肠杆菌O157:H7 为研究对象,评价PAW 与PLA 的协同抗菌作用,并通过评价细胞形态、细胞膜完整性、细胞膜电位和胞内活性氧水平等指标揭示其协同杀菌作用机制。研究结果将为PAW 和PLA 在食品保鲜领域中的应用提供理论参考。
1 材料与方法
1.1 材料与仪器
大肠杆菌O157:H7 中国工业微生物菌种保藏中心;胰蛋白胨大豆琼脂培养基(Tryptone soy agar,TSA)、胰蛋白胨大豆肉汤培养基(Tryptone soy broth,TSB) 北京奥博星生物技术有限责任公司;L-苯乳酸和DiBAC4(3) 上海麦克林生化科技有限公司;乙酸异戊酯和磷酸二氢钾 天津市科密欧化学试剂有限公司;50%戊二醛 上海阿拉丁生化科技股份有限公司;2′,7′-二氯荧光素二乙酸酯(DCFH-DA)上海源叶生物科技有限公司。
TS-PL200 型等离子表面处理机 深圳东信高科自动化设备有限公司;MJ-54A 型高压灭菌锅 施都凯仪器设备(上海)有限公司;TGL-16M 型台式高速冷冻离心机 上海卢湘仪离心机仪器有限公司;SW-CJ-1FD 型超净工作台 苏净安泰设备有限公司;Tecan Spark 20 M 型多功能微孔板读数仪 瑞士Tecan 公司;JSM-7001F 型场发射扫描电子显微镜 日本JEOL 公司;Nano Drop 2000 型超微量分光光度计 美国Thermo 公司。
1.2 实验方法
1.2.1 菌悬液制备 从-80 ℃冰箱中取出甘油管保存的大肠杆菌O157:H7 菌种,挑取一环菌液在TSA培养基上活化培养后,挑取活力旺盛的单菌落接种于TSB 培养基中,于37 ℃、180 r/min 恒温振荡培养12 h。取7 mL 培养物于10 mL 离心管,于3500×g离心5 min,弃上清液,所得菌体用0.85%无菌生理盐水洗涤2次,离心同上。将所得菌体重悬于无菌生理盐水中并混匀,制成活菌数约为7~8 lg CFU/mL的菌悬液,备用。
1.2.2 PAW 的制备 参考Zhang 等[12]的方法,采用等离子表面处理机制备PAW,冷等离子体与液面的距离为0.35 cm,功率为750 W,工作气体为压缩空气(0.18 MPa)。将200 mL 无菌去离子水(Sterile distilled water,SDW)经APPJ 装置处理60 s 得到PAW,备用。
1.2.3 PLA 杀菌活性评价 将PLA 溶解于去离子水并经0.22 μm 微孔滤膜过滤除菌,并稀释到1.25、2.5、5 和10 mg/mL。然后将100 μL菌悬液、800 μL 0.85%无菌生理盐水和100 μL PLA溶液充分混匀,PLA 最终浓度分别为0.125、0.25、0.5 和1.0 mg/mL,于室温反应8 min。取100 μL 处理后的样品,用无菌生理盐水进行梯度稀释后,吸取100 μL 稀释液涂布于TSA 平板并于37 ℃培养24 h,进行菌落计数,结果表示为lg CFU/mL。
1.2.4 PAW 协同PLA 杀菌活性评价 研究PAW协同PLA 处理对大肠杆菌O157:H7 的影响。根据前期预实验结果,分组如下:
a. 对照组:将100 μL 菌悬液、100 μL SDW 与800 μL 无菌生理盐水混合均匀,于室温反应8 min;
b. PAW 单独处理:将100 μL 菌悬液、100 μL无菌生理盐水与800 μL PAW 混合均匀,于室温反应8 min;
c. PLA 单独处理:将100 μL 菌悬液、100 μL PLA溶液和800 μL 无菌生理盐水混合均匀,PLA 最终浓度分别为0.125、0.25、0.5 和1.0 mg/mL,于室温反应8 min;
d. PAW 协同PLA 处理:将100 μL 菌悬液、100 μL PLA 溶液和800 μL PAW 混合均匀,PLA 最终浓度分别为0.125、0.25、0.5 和1.0 mg/mL,于室温反应8 min。
1.2.5 场发射扫描电镜观察 参考刘骁等[13]的方法,采用场发射扫描电子显微镜(Field emission scanning electron microscope,FESEM)观察PAW 协同PLA 处理对大肠杆菌O157:H7 细胞形态的影响。菌悬液经PAW、PLA(1.0 mg/mL)或PAW 协同PLA(1.0 mg/mL)处理8 min 后,于12000×g 离心2 min,收集菌体,加入500 μL 预冷的2.5%戊二醛溶液并于4 ℃固定4 h;离心收集菌体,用浓度为0.1 mol/L 的无菌磷酸盐缓冲液(pH7.2)洗涤样品三次,离心同上;分别用30%、50%、70%、80%、90%和100%(v/v)乙醇溶液对样品逐级洗脱10 min,其中100%乙醇溶液洗脱2次;最后用乙酸异戊酯置换乙醇2次,每次10 min,离心条件同上,制备菌悬液,混匀之后滴加到载玻片上,自然晾干,采用HVBGB 型真空蒸镀仪喷金150 s,通过JSM-7001F 型场发射扫描电子显微镜观察并拍照。
1.2.6 细胞膜完整性评价 大肠杆菌O157:H7 菌悬液分别经PAW、PLA(终浓度分别为0.125、0.25、0.5 和1.0 mg/mL)或PAW 协同PLA(终浓度分别为 0.125、0.25、0.5 和 1.0 mg/mL)8 min 后,在12000×g 和4 ℃条件下离心2 min,采用Nano Drop 2000 型超微量分光光度计测定上清液在280 nm 处的吸光度[14]。
1.2.7 细胞膜电位测定 大肠杆菌O157:H7 细胞分别经PAW、PLA(1.0 mg/mL)或PAW 协同PLA(1.0 mg/mL)处理8 min 后,离心收集菌体。处理后所得菌体与100 μL(25 μg/mL)DiBAC4(3)溶液和900 μL EDTA 溶液(4 mmol/L)混合均匀,置于37 ℃暗处培养15 min,离心,弃上清液。菌体用PBS 洗涤2次并重悬,采用多功能微孔板读数仪测定荧光强度,激发波长为488 nm,发射光波长为525 nm,以未处理的样品为空白对照[15]。
1.2.8 胞内ROS 水平测定 采用DCFH-DA 荧光探针检测大肠杆菌O157:H7 细胞内ROS 水平[16]。菌悬液分别经PAW、PLA(终浓度分别为0.125、0.25、0.5 和1.0 mg/mL)或PAW 与PLA(终浓度分别为0.125、0.25、0.5 和1.0 mg/mL)协同处理8 min 后,于4 ℃,12000×g 离心2 min,弃上清,收集菌体并用SDW 洗涤两次,后重悬于无菌生理盐水,加入DCFHDA 储备液(终浓度为50 μmol/L)于37 ℃避光反应30 min;然后于12000×g 离心2 min,弃上清,收集菌体并用PBS 洗涤两次,重悬后采用多功能酶标仪测定荧光强度,激发波长为488 nm,发射波长为525 nm。
1.3 数据处理
每次试验均重复3次,试验结果表示为平均值±标准差。采用Prism 软件(Graphpad 7.0)绘图,采用SPSS 24.0 进行单因素方差分析(one-way ANOVA),各组间采用LSD 多重比较进行差异显著性(P<0.05)。
2 结果与分析
2.1 PLA 处理对大肠杆菌O157:H7 的影响
通过平板计数法评价不同浓度PLA 处理对大肠杆菌O157:H7 细胞活力的影响。如图1所示,大肠杆菌O157:H7 初始菌量为7.41 lg CFU/mL;经终浓度为0.125~1.0 mg/mL 的PLA 处理后,大肠杆菌O157:H7 活细胞数未发生显著变化(P>0.05)。与对照组相比,经终浓度为1.0 mg/mL 的PLA 处理后,大肠杆菌O157:H7 菌落数仅下降0.18 lg CFU/mL。上述结果与Ning 等[17]的发现一致。Ning 等[17]发现,经浓度为1.25 mg/mL 的PLA 处理2 h 后,大肠杆菌仅下降了约1 lg CFU/mL。以上结果表明,低浓度(0.125~1.0 mg/mL)的PLA 未对大肠杆菌O157:H7细胞活力造成显著影响(P>0.05)。

图1 PLA 对大肠杆菌O157:H7 的影响Fig.1 Influences of PLA on E. coli O157:H7 cells
2.2 PAW 协同PLA 处理对大肠杆菌O157:H7 的杀灭作用
PAW 协同PLA(终浓度为0.125~1.0 mg/mL)处理对大肠杆菌O157:H7 的杀灭作用见图2。如图2所示,大肠杆菌O157:H7 初始浓度为7.51 lg CFU/mL;经PAW 单独处理8 min 后,细胞数量仅下降了1.07 lg CFU/mL,表明PAW 对大肠杆菌O157:H7 的失活作用较弱。与PAW 或PLA 单独处理相比,PAW 与PLA 协同处理能够有效杀灭大肠杆菌O157:H7。经PAW 与终浓度分别为0.125、0.25、0.5 和1.0 mg/mL的PLA 协同处理8 min 后,大肠杆菌O157:H7 菌落数分别减少了1.17、1.76、1.92 和5.65 lg CFU/mL(P<0.05)。此外,Liu 等[18]发现,经0.5% PLA 或余氯含量为30 mg/L的微酸性电解水(slightly acid electrolyzed water,SAEW)单独处理5 min 后,产酸克雷伯氏菌(Klebsiella oxytoca)分别降低了5.8 和0.7 lg CFU/mL;而经0.5% PLA 与SAEW(余氯含量为30 mg/L)协同处理5 min 后,K. oxytoca由初始的8.0 lg CFU/mL降低至1.4 lg CFU/mL 以下。以上结果表明,PAW与PLA 协同处理能够有效杀灭大肠杆菌O157:H7,且其杀灭效能随PLA 浓度的升高而增强。
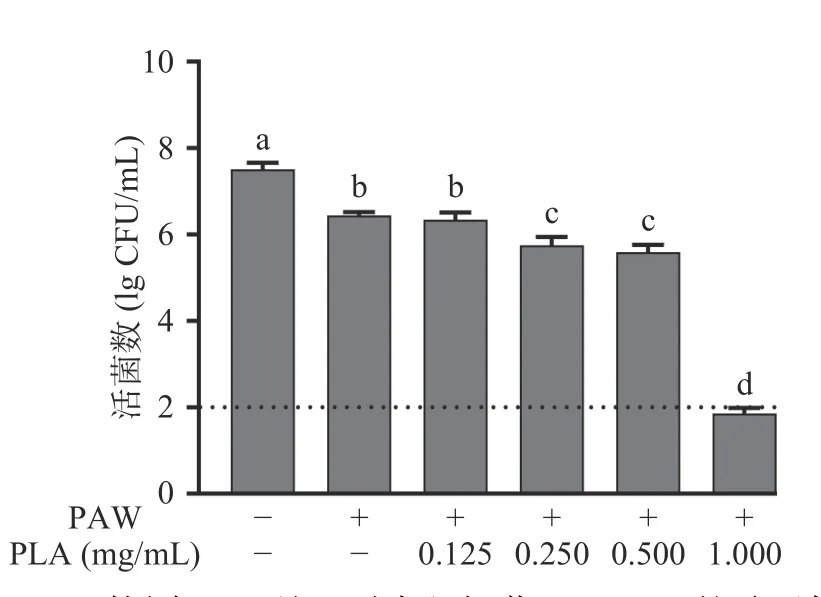
图2 PAW 协同PLA 处理对大肠杆菌O157:H7 的杀灭作用Fig.2 Inactivation of E. coli O157:H7 cells by PAW combined with PLA
2.3 PAW 协同PLA 处理对大肠杆菌O157:H7 的细胞形态的影响
采用场发射扫描电镜评价PAW 协同PLA 处理对大肠杆菌O157:H7 细胞形态的影响,结果见图3。从图3可知,对照组大肠杆菌呈现为规则的杆状,细胞大小较为均匀,表面完整光滑;经PAW 或PLA(1.0 mg/mL)单独处理后,大肠杆菌菌体均出现轻微的皱缩,表面变得粗糙。宁亚维等[19]也发现经PLA(1.25 mg/mL)处理1 h 后,大肠杆菌细胞发生凹陷等变化。经PAW 和PLA(1.0 mg/mL)协同处理后,大肠杆菌细胞表面出现明显的褶皱和塌陷。以上结果表明,PAW 和PLA 协同处理显著破坏了大肠杆菌的细胞形态,可能进一步影响其正常生理代谢,最终导致其失活。

图3 PAW 协同PLA 处理对大肠杆菌O157:H7细胞形态的影响Fig.3 Effect of PAW treatment combined with PLA on the morphology of E. coli O157:H7 cells
2.4 PAW 协同PLA 处理对大肠杆菌O157:H7 细胞膜完整性的影响
细胞膜可保护细菌免受周围环境的影响,并为细菌的生长和代谢输送必需的营养物质[20]。因此,细胞膜完整性对于维持细胞稳态和生长繁殖具有重要意义[21]。本研究通过测定胞内蛋白质的释放评价PAW 与PLA 协同处理对大肠杆菌O157:H7 细胞膜完整性的影响,结果见图4。

图4 PLA 单独(A)或PAW 协同PLA 处理(B)对大肠杆菌O157:H7 蛋白释放量的影响Fig.4 Effect PLA alone (A) or PAW treatment combined with PLA (B) on leakage of proteins from E. coli O157:H7 cells
如图4所示,与对照组相比,PAW 与PLA 单独处理组大肠杆菌胞外蛋白含量均显著升高(P<0.05)。如图4A 当浓度为0.125~1.0 mg/mL 时,PLA 单独处理组大肠杆菌胞外蛋白含量随着PLA 浓度的升高而显著升高(P<0.05)。上述结果与Sorrentino 等[22]的研究报道一致。Sorrentino 等[22]发现,经终浓度为11.3 mmol/L 的PLA 处理5 h 后,李斯特菌(Listeria innocua)胞内物质释放量与对照组相比显著升高(P<0.05)。与PAW 或PLA 单独处理相比,PAW 与PLA协同处理组大肠杆菌胞外蛋白质含量明显升高。经PAW 与PLA(1.0 mg/mL)协同处理后,上清液在280 nm 处吸光度升高至0.266,显著高于PAW 单独处理组(A280=0.041)或PLA 单独处理组(A280=0.107)。以上结果表明,PAW 协同PLA 处理破坏了大肠杆菌O157:H7 的细胞膜完整性并导致蛋白质、DNA等胞内组分的泄露,这可能是其杀灭大肠杆菌细胞的重要机制。
2.5 PAW 协同PLA 处理对大肠杆菌O157:H7 细胞膜电位的影响
细菌膜电位在调节pH 稳态、跨膜运输、鞭毛运动、细胞分裂和ATP 合成等多种生理功能中发挥着重要作用[23]。DiBAC4(3)是一种对膜电位敏感的亲脂性阴离子荧光染料,本身无荧光;当进入去极化细胞后与细胞内富含脂质成分结合而使细胞内的荧光强度增强[24],因此被广泛用于评价细胞膜电位的变化。PAW 协同不同浓度PLA 处理对大肠杆菌O157:H7 细胞膜电位的影响见图5。

图5 PAW 协同PLA 处理对大肠杆菌O157:H7细胞膜电位的影响Fig.5 Effect of PAW treatment combined with PLA on the membrane potential of E. coli O157:H7 cells
由图5可知,与对照组相比,经PAW 与PLA(1.0 mg/mL)协同处理8 min 后,大肠杆菌O157:H7细胞中DiBAC4(3)荧光强度均显著升高(P<0.05)。经PAW 和PLA(1.0 mg/mL)协同处理后,大肠杆菌O157:H7 中DiBAC4(3)荧光强度较对照组提高了74.9%,显著高于PAW 单独处理组(仅提高了16.1%)和PLA 单独处理组(提高了29.0%)(P<0.05)。此外,Liu 等[6]报道,经PAW 与尼泊金丙酯协同处理10 min 后,大肠杆菌O157:H7 细胞中DiBAC4(3)荧光强度比对照组提高了505.6%,显著高于PAW 单独处理组(提高了34.6%)和尼泊金丙酯单独处理组(提高了208.5%)。Wang 等[25]也有类似的发现,经PLA(1.25、2.5、5 和10 mg/mL)处理5 h 后,粪肠球菌(Enterococcus faecalis)细胞膜发生去极化,进而影响其ATP 的产生和物质的跨膜运输。上述结果表明,PAW 和PLA 协同处理导致大肠杆菌O157:H7细胞膜发生去极化,进而干扰各种新陈代谢途径,从而导致细胞死亡。综上所述,细胞膜可能是PAW和PLA 协同作用的主要靶点。
2.6 PAW 协同PLA 处理对大肠杆菌O157:H7 胞内ROS 水平的影响
采用DCFH-DA 探针检测PAW 与PLA 协同处理对大肠杆菌O157:H7 细胞内ROS 水平的影响,结果见图6。如图6所示,与对照组相比,经终浓度为1.0 mg/mL 的PLA 处理8 min 后,大肠杆菌O157:H7胞内ROS 水平仅升高了23.0%(P<0.05);经PAW 单独处理8 min 后,大肠杆菌O157:H7 胞内ROS 水平仅升高了4.59 倍(P<0.05)。经PAW 协同PLA 处理后,大肠杆菌O157:H7 细胞内ROS 水平随PLA 浓度的增加而逐渐升高。与对照组相比,经PAW 与终浓度为0.25、0.5 和1.0 mg/mL 的PLA 协同处理后,大肠杆菌O157:H7 胞内ROS 水平分别升高了7.38、7.91 和9.53 倍(P<0.05)。研究证实,PAW 中含有过氧化氢(H2O2)、臭氧(O3)、过氧亚硝基阴离子(ONOO-)、NO2-、NO3-等活性物质[26-27]。这些活性物质诱导细菌细胞膜中的脂质发生氧化反应,同时活性物质还可以渗透到细胞内,对细胞内的核酸、蛋白质等物质造成氧化损伤,诱导细胞发生氧化应激,进而破坏细胞的正常生理功能[28-30]。综上所述,经PAW与PLA 协同处理会导致ROS 的过度积累,可能会对大肠杆菌O157:H7 胞内脂质、蛋白质和DNA 等物质造成氧化损伤,导致细胞膜和生理功能被破坏,最终造成细胞死亡。
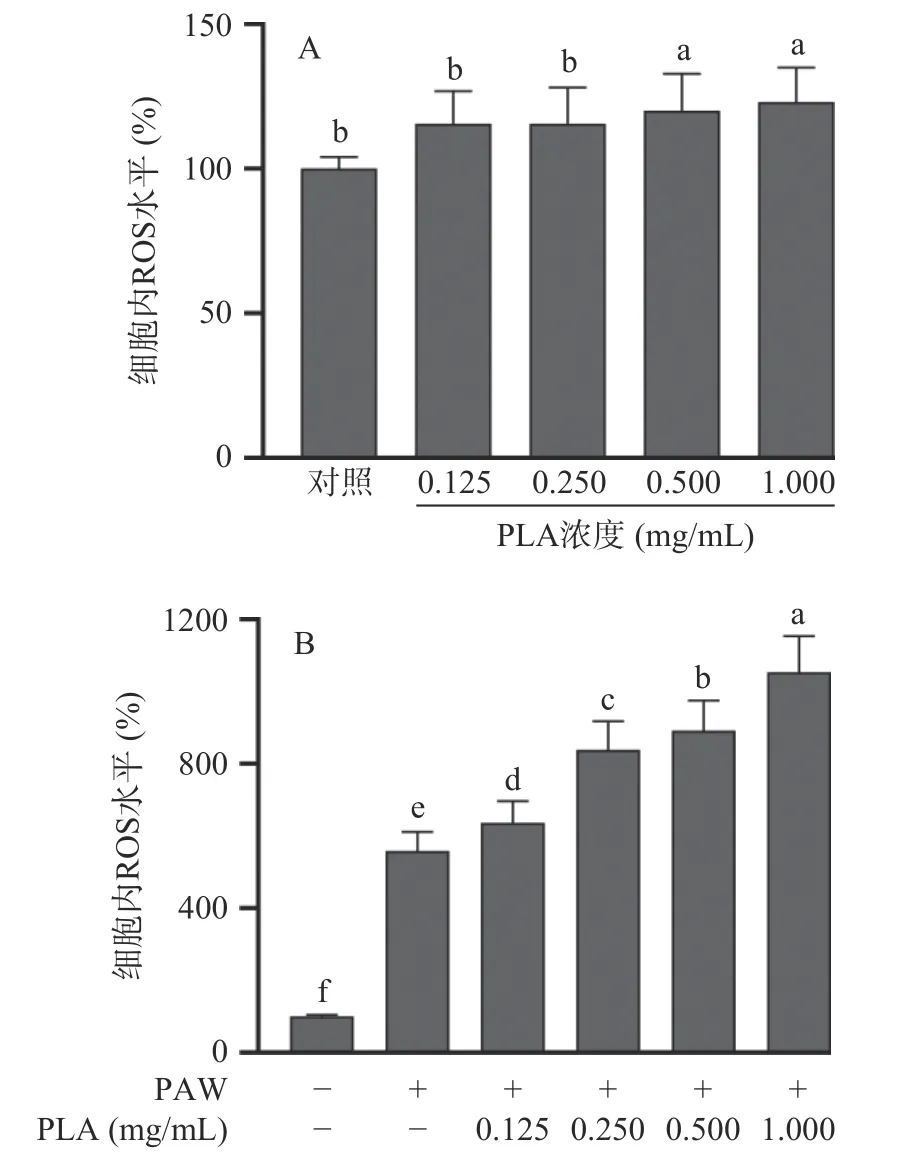
图6 PLA 单独(A)或PAW 协同PLA 处理(B)对大肠杆菌O157:H7 细胞内ROS 水平的影响Fig.6 Effect PLA alone (A) or PAW treatment combined with PLA (B) on intracellular ROS levels of E. coli O157:H7
3 结论
综上所述,PAW 与PLA 协同处理能够有效杀灭大肠杆菌O157:H7,且其杀菌效能随PLA 浓度的升高而增强。经PAW 与终浓度为1.0 mg/mL 的PLA 协同处理8 min 后,大肠杆菌O157:H7 减少了5.65 lg CFU/mL。PAW 与PLA 协同处理后,大肠杆菌O157:H7 细胞形态发生明显皱缩,细胞膜通透性增强、细胞膜发生去极化且胞内ROS 水平显著升高,推测PAW 与PLA 可能通过破坏细胞膜和诱导氧化应激等途径发挥协同抗菌作用。在今后的研究中应综合运用代谢组学、蛋白质组学、转录组学等方法系统阐明PAW 与PLA 协同处理失活微生物的分子机制;此外,还应系统评价PAW 与PLA 协同处理对食品表面微生物的杀灭效果及对食品营养、感官及货架期等指标的影响。
