低氧条件下HIF-1α 与VEGF 在宫颈癌Hela 细胞中的表达
2022-07-06苗丽娟武梅孙礼王剑毛宝宏武美丽姚婷婷王晓霞刘青
苗丽娟 武梅 孙礼 王剑 毛宝宏 武美丽 姚婷婷 王晓霞 刘青
1.甘肃中医药大学,甘肃 兰州 730000;2.甘肃省妇幼保健院,甘肃 兰州 730050
宫颈癌是最常见的妇科癌症之一,近年来,发病率和死亡率逐年上升,引起全球关注[1-2]。宫颈癌发病的因素较多,近年来一些研究表明,低氧微环境对癌症的发生发展有重要影响,低氧诱导因子-1α(hypoxia-inducible factor、HIF-1α)、血管内皮生长因子(vascular endothelial growth factor,VEGF)作为已被证明在癌症发生历程中有直接影响的重要转录因子,在宫颈癌形成阶段的作用是一个值得被研究的领域[3-5]。本研究通过三气培养箱模拟缺氧条件下对人宫颈癌Hela 细胞进行体外培养,探究低氧条件下HIF-1α 和VEGF 在宫颈癌细胞中的转录变化规律,探讨宫颈癌治疗和改善预后的新思路。
1 材料与方法
1.1 材料与试剂 人宫颈癌Hela 细胞(甘肃省动物细胞创新中心);HIF-1α 多克隆抗体;VEGF 多克隆抗体;Cy3-labeled Goat Anti-Rabbit IgG(H+L)(北京博奥森生物技术有限公司);DMEM 高糖细胞培养液(兰州百灵生物技术有限公司);新生牛血清NBS;聚乙二醇辛基苯基醚(Triton X-100);Normal Goat Serum(原液)(兰州民海生物工程有限公司);4%多聚甲醛;DAPI solution(ready-to-use)(北京索莱宝生物科技有限公司)。
1.2 细胞培养 复苏人宫颈癌Hela 细胞,在37℃、5%CO2、饱和湿度的普通培养箱中培养,待细胞单层融合率约为80%且形态正常、长势良好时传代,分为低氧培养组与常氧培养组两组。
1.3 细胞低氧及常氧培养环境的建立 常氧:普通培养箱设置条件为37℃,CO2浓度5%、O2浓度21%。低氧:低氧培养箱设置条件为37℃,CO2浓度5%、O2浓度5%。
1.4 细胞爬片 常氧和低氧两组细胞分别通过胰蛋白酶消化法消化、离心,制成细胞悬液,均匀铺于6 孔板中爬片,并分别在相应条件下继续培养48h,待细胞单层融合率约80%~90%时用4%多聚甲醛固定。
1.5 免疫荧光染色 固定完成的细胞爬片用PBS 溶液清洗后加入0.5%Triton X100 通透液,室温通透15~20min;待细胞膜通透完成后再次用PBS 浸洗3 次并吸干多余液体,加入提前用原液稀释的Normal GoatSerum,在室温条件下封闭30min;30min 后用滤纸吸去封闭液,分别加入稀释好的一抗HIF-1α 和VEGF(稀释比例1 ∶300),在4℃冰箱中孵育12h。一抗孵育完成后洗脱杂质,滴入适量荧光二抗,37℃孵育2h 后在避光环境下用DAPI 染液将细胞核复染,洗脱杂质后封片以备观察。利用荧光显微成像系统采集实验结果图片,控制曝光时间和激发光电压等参数条件相同。
1.6 数据分析 使用数据分析软件Image pro plus6.0对荧光强度进行测量,Graphpad Prism 8 对实验结果进行统计学分析,每组结果选取5 个随机视野进行测量。t 检验进行统计分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 VEGF 的表达情况 细胞核与细胞浆中均存在VEGF 阳性表达。见图1。使用图片处理软件对比分析发现:低氧培养条件下VEGF 在Hela 细胞中所展现的荧光强度值高于常氧培养组,差异具有统计学意义(P<0.001)。见图2、表1。

表1 VEGF 荧光强度检测结果
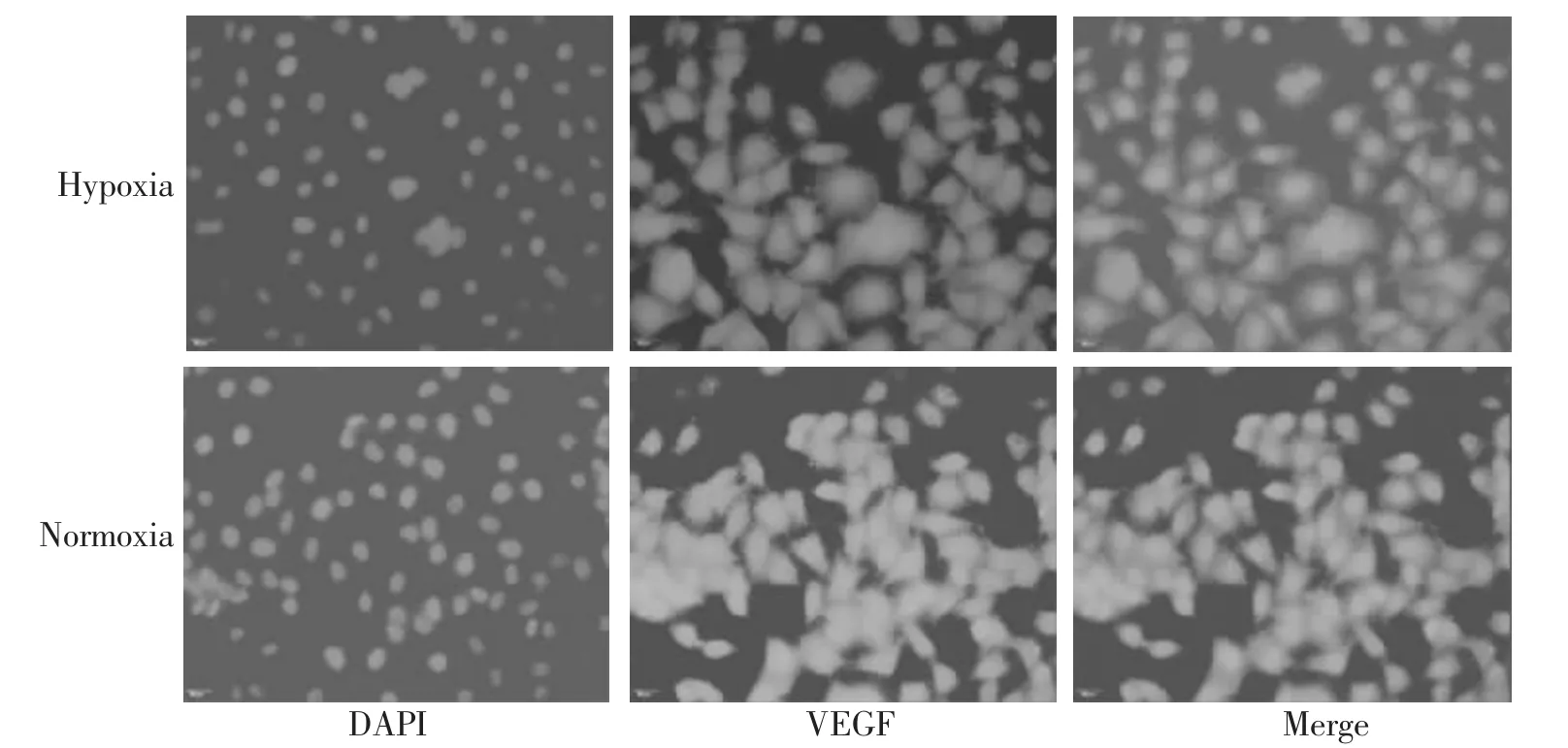
图1 VEGF 荧光染色结果
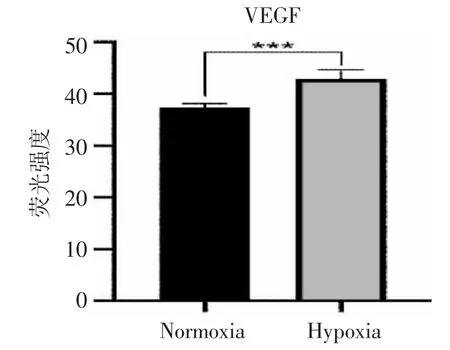
图2 VEGF 荧光强度检测结果
2.2 HIF-1α 的表达情况 细胞核中存在HIF-1α 大量阳性表达。见图3。使用图片处理软件对比分析发现:低氧培养条件下HIF-1α 在Hela 细胞中所展现的荧光强度值高于常氧培养组,低氧培养组的细胞中HIF-1α 荧光强度与常氧培养组中相比,差异有统计学意义(P<0.001)。见图4、表2。

表2 HIF-1α 荧光强度检测结果
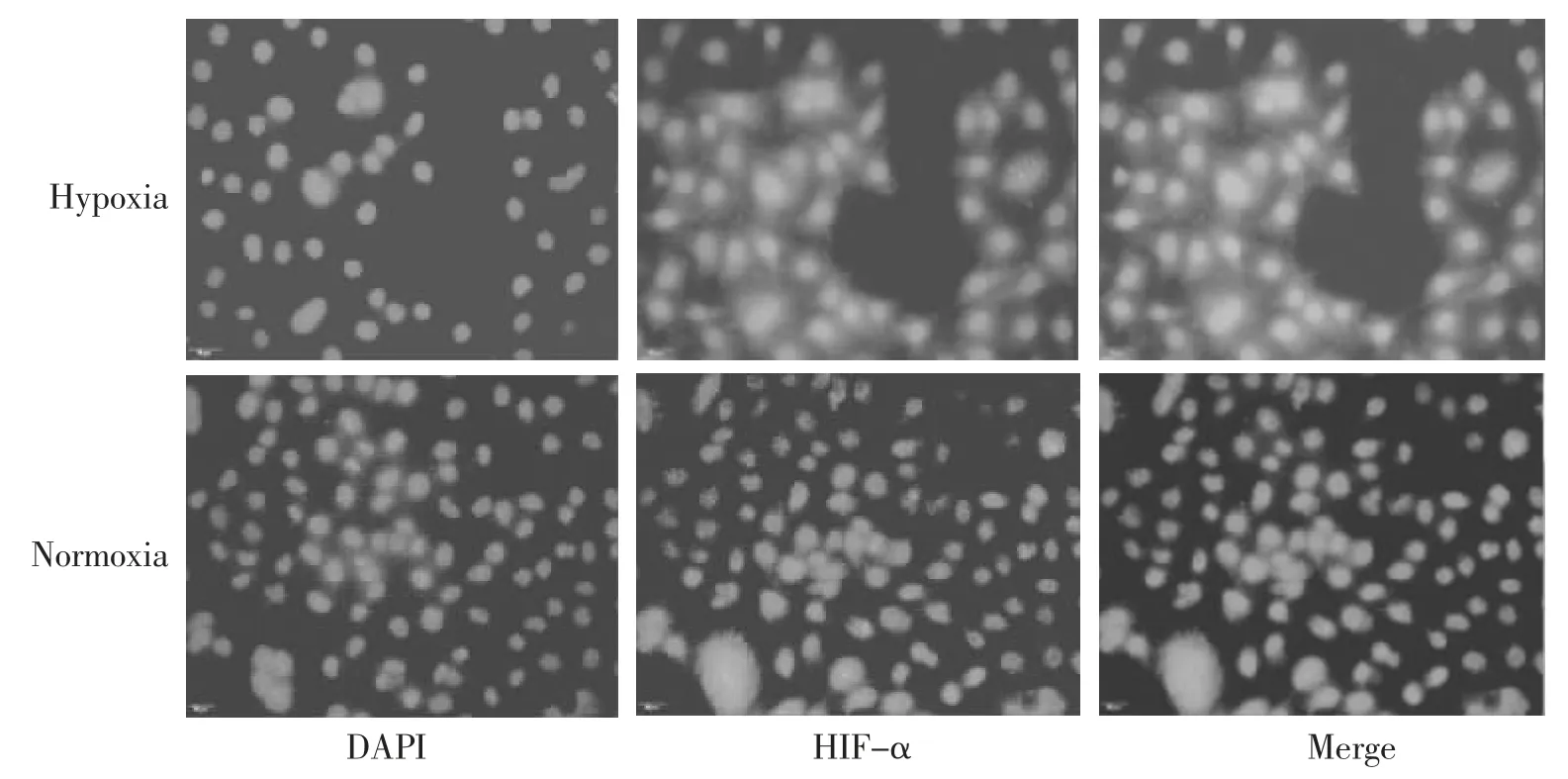
图3 HIF-1α 荧光染色结果
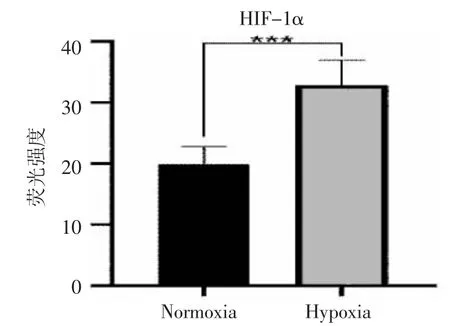
图4 HIF-1α 荧光强度检测结果
3 讨论
宫颈癌是一种严重危害妇女健康的恶性肿瘤,在国际癌症研究机构提供的全球2018 癌症发病率和死亡率统计中,宫颈癌的发病率和死亡率均排在第四位[6]。造成宫颈癌患者死亡的大多数原因是肿瘤的侵袭和转移。目前已经有大量研究证实HIF-1α 及VEGF 在宫颈癌Hela 细胞中高表达,研究[7]表明,在肿瘤细胞中HIF-1α 和VEGF 的高表达预示着更高的侵袭性和增殖性。
缺氧通常贯穿癌症病程的始终,诱导细胞代谢过程中适应性改变,包括从氧化磷酸化到糖酵解的转变,增加糖原合成,以及从葡萄糖到谷氨酰胺的开关作为脂肪酸合成的主要基材。这类广泛的代谢变化由HIF-1α的表达水平协调以平衡供氧和需求[8]。HIF-1α 是肿瘤细胞适应缺氧而产生的一种核转录因子。在缺氧微环境下能够激活其转录活性,使肿瘤的一些生物学特性改变,这些生物学特性包括肿瘤的侵袭、转移以及肿瘤血管的形成等[9]。HIF-1α 也伴随肿瘤的抑制剂(如VHL)功能和致癌因子增益损失,导致(PI3K / AKT /MTOR)活性在癌细胞内被激活,并介导癌症发展和抗治疗的代谢改变[4]。大量研究证实,VEGF 在多种人类肿瘤中均过度表达,是肿瘤血管生成的主要调控者。阻断HIF-1α 从而减少VEGF 的转录及表达,可以抑制肿瘤的生长。研究表明HIF-1α/VEGF-A 轴是癌症免疫的必需组成部分[10]。渗透肿瘤的毒性T 细胞在肿瘤内缺氧的微环境适应过程中调动HIF-1α。HIF-1α对于CD8+T 细胞的效应状态至关重要。CD8+T 细胞中HIF-1α 的丧失可以降低肿瘤的浸润能力和细胞杀伤,并减弱肿瘤的血管化。若CD8+T 细胞内缺失VEGFA,HIF 靶基因则促使肿瘤发生过程加速并同时促进血管化改变。有研究显示VEGF-A 表达和CD8+T 细胞侵袭能力之间的关系呈反比。
低氧状态能促使HIF-1α 和VEGF 在Hela 细胞中蛋白水平增高。本研究通过细胞免疫荧光染色Hela细胞,证实HIF-1α 及VEGF 在缺氧及常氧条件下的蛋白表达存在差异,在缺氧条件下,HIF-1α 及VEGF 均高表达,并且主要分布于细胞核中。提示HIF-1α 可能通过某种细胞信号通路影响VEGF 表达。有研究认为,HIF-1α 通过细胞内信号传导途径调节VEGF 表达,主要包括两方面调节作用:一是介导了VEGF mRNA 的稳定性增加;二是介导了VEGF 的转录活性增强[11]。也有学者推测,在肿瘤缺氧微环境中,表达增高的HIF-1α 经VEGF 基因转录起始点上游区域存在的缺氧反应元件诱导了下游VEGF 的高表达[12]。结合上述研究结论可推断出低氧状态在宫颈癌Hela 细胞的生长过程中具有重要作用,很可能通过影响HIF-1α 和VEGF 分子的表达从而介导肿瘤的发生、发展。
在宫颈癌Hela 细胞中,HIF-1α 和VEGF 的表达依赖氧浓度的调节,改善宫颈癌组织中缺氧微环境,可能有助于改善宫颈癌患者HIF-1α 和VEGF 的水平,从而改善患者治疗结局及远期预后。因此,低氧环境对癌症调控因子,如HIF-1α,VEGF 的影响可能为宫颈癌治疗提供新的理论基础和新的思路。
