甘肃省13种大宗药用植物内生细菌促生及拮抗特性
2022-07-04吕娇娇晋玲王艳张婷高国香
吕娇娇,晋玲,王艳,张婷,高国香
(甘肃中医药大学药学院,甘肃 兰州 730000)
甘肃是全国中药材大省,药用植物资源丰富,共有1 270多种,其中当归、党参、黄芪、大黄、甘草、黄芩、板蓝根、款冬花、枸杞、柴胡等为甘肃省传统道地、大宗药材,受到医药界的广泛关注[1].药用植物具有丰富的物种多样性,为内生细菌的筛选提供了广泛的资源。
当今我国对药用植物内生细菌的研究开发较少,世界上约有30万种药用植物,而我国仅对当归、半夏、苦参、金银花、人参、枸杞、沙冬青、长春花等几十种药用植物内生细菌进行过研究报道,巨大的内生细菌资源宝库尚未被开发利用[2-5]。
植物内生细菌的概念由 Kloepper于1992年首次提出,他指出植物内生细菌能存在于植物体内,与植物体长期共生,且不会给宿主本身带来实质性的伤害[6].研究报道,许多药用植物体内含有丰富的内生细菌资源,不同种类药用植物之间内生细菌的种类存在一定差异,不同部位内生菌的数量、分布、种群及组成也存在差异[7].药用植物内生细菌可以通过固氮、溶磷、分泌生长素等作用促进宿主植物的生长及药用成分的积累,并在植物抗逆境、抗病原菌等方面发挥着重要作用[8]。
目前,对药用植物内生细菌的研究与其他植物内生细菌的研究有许多相同之处,在农业研究方面,研究者都注重内生细菌有益的生物学作用,如病害防治、促生、土壤修复等,通过改良作物中内生细菌的种群结构,使它们稳定维持在最佳水平以提高作物生产力[9].本研究对甘肃省13种大宗药用植物内生细菌进行分离,以6种植物病原真菌为指示菌筛选拮抗菌株,并筛选具有固氮、溶磷、产IAA及拮抗能力的内生细菌资源,以期为开发甘肃省药用植物内生细菌资源奠定基础。
1 材料与方法
1.1 供试材料
1.1.1 植物材料 13种药用植物均采自于甘肃省陇西市首阳镇药用植物园,地理坐标为N 36°4′31″;E 104°27′4″;海拔1 912 m左右,年平均日照时数2 312 h,≥0 ℃年积温为2 581~2 721 ℃,无霜期146 d,年均降水量450 mm,年均气温7.7 ℃,地块平坦,肥力状况均匀,肥力中等,砂质壤土。13种药用植物分别为当归Angelicasinensis(Oliv.)Diels,蒙古黄芪Astragalusmembra-naceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao,党参Codonopsispilosula(Franch.)Nannf.,甘草GlycyrrhizauralensisFisch.,唐古特大黄RheumtanguticumMaxim.ex Balf.,板蓝根IsatisindigoticaFort.,宁夏枸杞LyciumbarbarumL.,柴胡Bupleurumchinensis DC.,款冬TussilagofarfaraL.,黄芩ScutellariabaicalensisGeorgi,苦参SophoraflavescensAit.,曼陀罗DaturastramoniumL.,羌活NotopterygiumincisumTing ex H.T.Chang。
1.1.2 供试菌株 供试6种病原真菌分别为尖孢镰刀菌FusariumoxysporumSchlecht,灰葡萄孢菌BotrytiscinereaPers.,腐皮镰孢菌Fusariumsolani(Mart.)Sacc.,木贼镰刀菌Fusariumeguiseti(Corda.)Sacc.,叶点霉菌PhyllostictasacrophulariaeSace,束状炭疽菌ColletotrichumdematiumGrove。
1.1.3 植株标号 当归(DG)、黄芪(HQ)、党参(DS)、甘草(GC)、大黄(DH)、板蓝根(BLG)、枸杞(GQ)、柴胡(CH)、款冬(KD)、曼陀罗(MTL)、羌活(QH)、苦参(KS)、黄芩(HQin);用大写字母 G、J、Y分别表示植株根、茎、叶。
1.2 供试方法
1.2.1 内生细菌的分离 对参考文献[10]分离方法进行改进,分别从根、茎和叶中分离内生细菌。消毒方法为:取植株根、茎、叶各1 g,第1步将根、茎、叶均用75%酒精浸泡3 min,无菌水冲洗5次;第2步将根、茎、叶分别用3%次氯酸钠浸泡7 min、5 min、3 min,无菌水冲洗5次,稀释至10-1倍组织液,吸取200 μL涂布于NA平板上,每处理3次重复,28 ℃培养72 h。以最后1次冲洗的无菌水涂布平板,作为空白对照。挑取不同形态的菌落,进行纯化,4 ℃低温保存备用。计算不同植物组织的菌群密度,计算公式为:
每克植株鲜质量所含的活菌数(cfu/g)=(菌落数×稀释倍数×分离用水量)/(涂板用水量×分离组织质量)[11]
1.2.2 药用植物内生细菌促生能力测定
1.2.2.1 内生固氮细菌的筛选及稳定性测定 采用阿须贝无氮培养法[12]测定固氮能力。将已活化好的菌株接种于NA液体培养基中,28 ℃、180 r/min培养24 h,菌悬液以1∶50的比例加到Ashby液体培养基中.28 ℃、180 r/min培养7 d。根据液体培养基浑浊程度初步判断内生细菌的固氮能力。即培养液变浑浊为阳性,具有固氮活性[13]。
对参考文献[13]筛选固氮菌的方法进行改进,将具有固氮活性的菌株在固体Ashby无氮培养基上连续转接3~8次,转接3次且生长较好,固氮能力级别为“+”,表示具有较强固氮能力;转接5次且生长较好,固氮能力级别为“++”,表示具有强固氮能力;转接8次且生长较好,固氮能力级别为“+++”,具有稳定固氮能力。
1.2.2.2 内生溶磷细菌的筛选及测定 采用溶磷圈法定性测定溶磷能力[14-15].将菌株活化后接种于PKO平板上,28 ℃恒温培养7 d,根据菌株形成的溶磷圈直径(D)/菌落直径(d)确定各菌株溶磷能力。将初筛的解磷菌在NA液体培养基中28 ℃,180 r/min培养24 h。用钼锑抗显色-紫外分光光度计法在波长530 nm下测定有效磷含量(mg/L)。
1.2.2.3 产IAA内生细菌的筛选及能力测定 以Salkowski法测定产吲哚乙酸的能力[16]。将菌株活化后,接种于King氏培养基,28 ℃、180 r/min培养7 d。通过观察溶液的颜色变化判断菌株是否产IAA。
将已筛选出的能产IAA的细菌在28 ℃、180 r/min条件下培养72 h,立即置于避光条件下,30 min之后测定其OD530值,计算培养液中的IAA含量(mg/L)[17]。
1.2.3 内生拮抗细菌抑菌能力的测定 采用平板对峙法筛选内生拮抗细菌[18-19].测量抑菌带宽度、病原菌直径,并计算其相应的抑菌率,抑制率(%)=(对照病原菌菌落直径-处理病原菌菌落直径)/(对照病原菌菌落直径-菌饼直径)×100%。
1.3 数据处理
数据统计与分析利用SPSS 22.0软件进行相关数据的整理与分析,采用 Duncan’s新复极差法对数据进行差异显著性检验。
2 结果与分析
2.1 13种药用植物根、茎、叶内生细菌的数量及分布特点
内生细菌数量如图1所示,13种药用植物的根、茎、叶中均有内生细菌共分离到439株,其中在甘草、当归中分离种类较多,分别为59株和50株,枸杞、大黄中分离较少,分别为17株和16株;内生细菌的分布依次为根(48.06%)>茎(29.38%)>叶(22.56%),且根、茎、叶中内生细菌数量差异显著(P<0.05).内生细菌菌群密度如图2所示,13种药用植物内生细菌的菌群密度差异显著(P<0.05),菌群密度为4.60×104~1.33×105cfu/g,且根、茎、叶内生细菌数量差异显著(P<0.05)。甘草根菌群密度最大为5.58×104cfu/g,大黄叶菌群密度最小为0.80×104cfu/g。不同组织中,根中菌群密度最大为2.18×104~5.58×104cfu/g;茎次之为1.58×104~4.38×104cfu/g,叶中最小为0.80×104~3.48×104cfu/g。
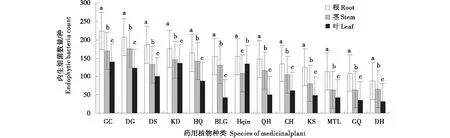
图1 13种药用植物根、茎、叶中内生细菌种类

图2 13种药用植物根、茎、叶中内生细菌菌群密度
2.2 药用植物内生细菌促生能力
2.2.1 固氮细菌的筛选及稳定性测定 从分离439株内生细菌中,初步筛选出184株固氮细菌,固氮内生细菌在植物组织的分离频率依次为:根(24.42%)>叶(12.8%)>茎(7.52%),根、茎分离的固氮菌株数量差异显著(P<0.05),叶分离的固氮菌株数量差异不显著(P>0.05)。13种药用植物中,8种药用植物内生固氮细菌在各植物组织的分离数量依次为根>茎>叶,其余5种植物固氮细菌在各植物组织的分离数量依次为根>叶>茎;其中,款冬分离的固氮菌株最多,为19株,大黄分离的固氮菌株最少,为9株(表1)。
根据初步筛选出的184株具固氮活性的菌株在Ashby无氮固体培养基上生长情况,对固氮能力进一步进行测定。筛选出具有强固氮能力的菌株50株,转接3次且生长较好;具有较强固氮能力的菌株49株,转接5次且生长较好;具有稳定固氮能力的菌株43株,转接8次且生长较好(表1)。
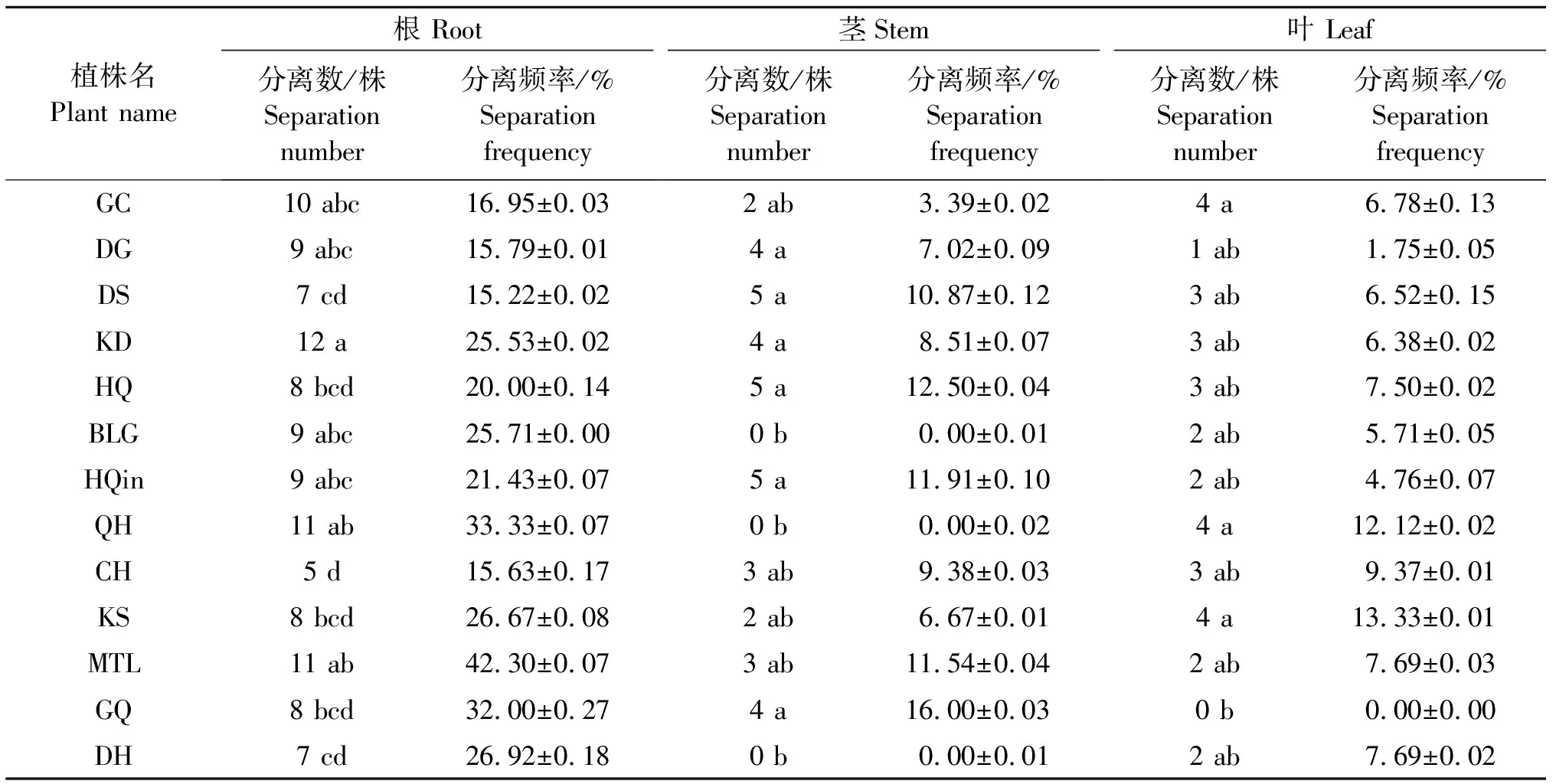
表1 13种药用植物固氮细菌的分离数及分离频率
2.2.2 溶磷细菌的筛选及测定 如图3所示,48株内生细菌能够在PKO培养基形成透明圈,对无机磷有良好的溶解效果,且差异显著(P<0.05)。48株磷细菌中,有81%分离于植株根部,18%分离于植株叶部,仅有1%分离于植株茎部;具有稳定溶磷能力的菌株有19株,强溶磷能力的菌株21株,具较强溶磷能力的菌株有8株;有23株溶磷细菌兼具固氮能力,D/d在2.5~3.5之间溶无机磷量在23.17~49.37 mg/L,D/d在1.5~2.5之间溶无机磷量在10.01~25.72 mg/L;D/d在1.0~1.5之间溶无机磷量在2.85~8.66 mg/L。各溶磷菌株间的溶磷量差异显著(P<0.05)。且溶磷圈比值和溶无机磷量相关性显著(P<0.05),即溶磷圈比值越大,溶无机磷量越多,溶磷能力越强(表2)。
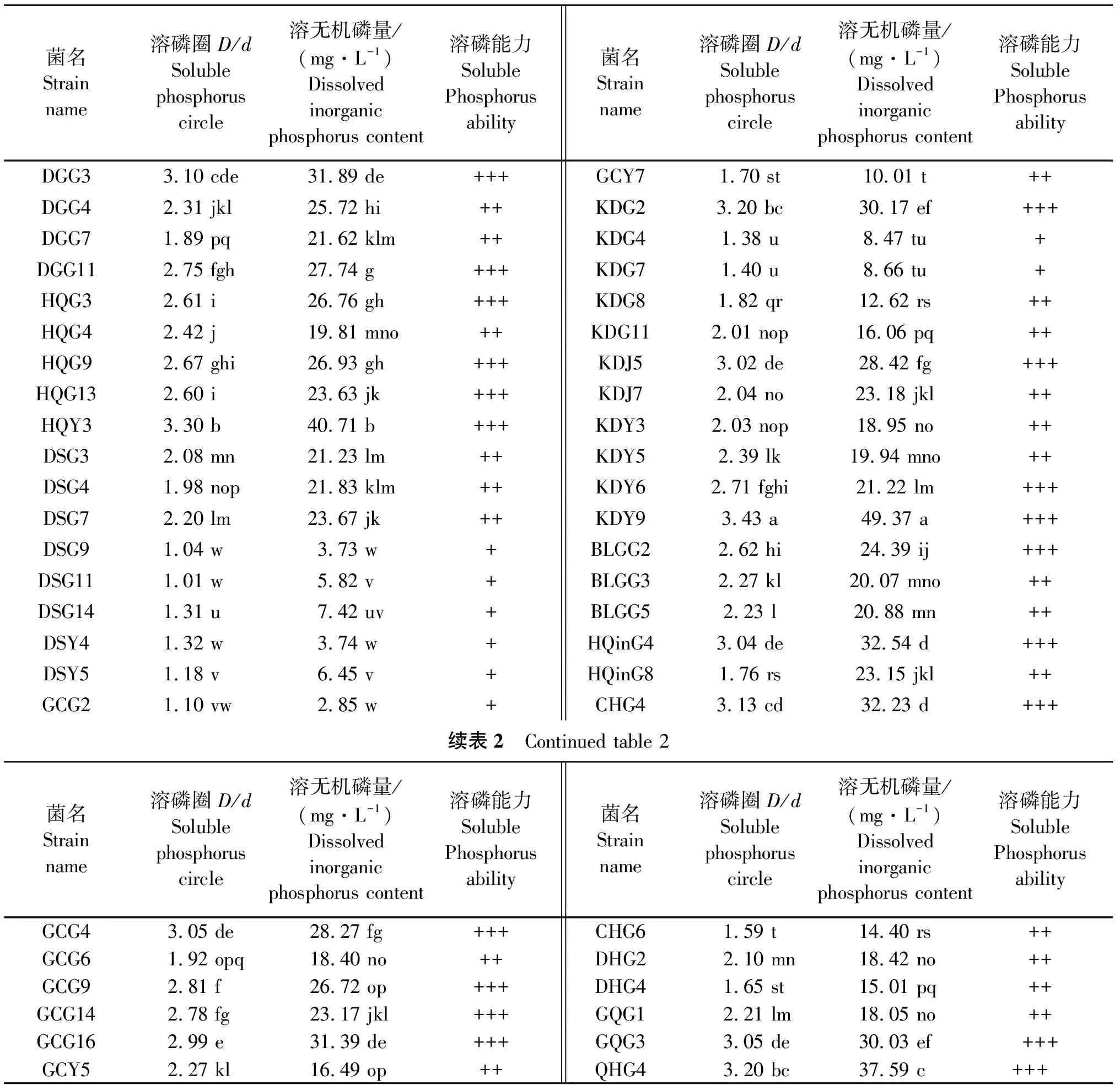
表2 具溶磷能力的菌株

图3 48株溶磷菌株在PKO无机磷培养基上的生长状况
287株内生细菌发酵上清液与salkowskis试剂混合后,颜色发生变化,占所用菌株的58.10%。但大部分内生菌发酵液与salkowskis混合显色后颜色较浅,分泌量较低。与对照10.0 mg/L,IAA显色后的粉红色相比,筛选出44株显色较深的内生细菌进一步用于定量测定,包括显色为粉红色。与10.0 mg/L显色相当的内生细菌有29株,显色反应为红色的10株;以及显色为紫红色的5株。各菌株用King培养基摇床培养12 d,各菌株产IAA的能力差异显著(P<0.05)。测试的44株菌株中,分泌量在5.49~56.38 mg/L。其中,分泌量在40 mg/L以上的菌株有5株,分别为DSG7、DSG3、DHG4、DGG4、BLGG7、DGG7;分泌量在20~40 mg/L之间的菌株有8株,分别为BLGY4、KSG4、HQG9、DHY7、KDY5、HQinG8、MTOG3;分泌量在20 mg/L以下菌株有31株(表3)。
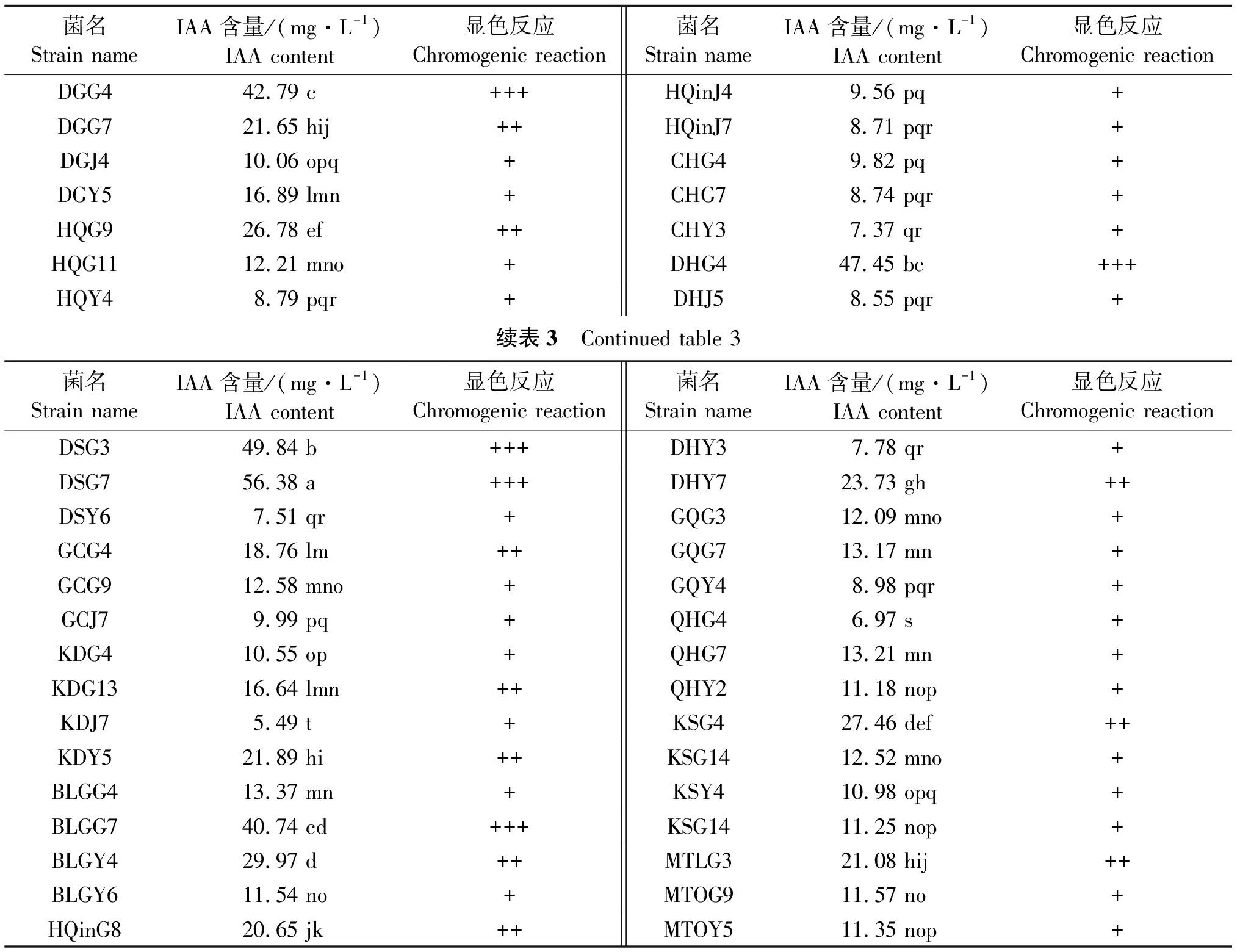
表3 分泌IAA较强的内生细菌
2.3 内生拮抗细菌抑菌能力的测定
共筛选出16株具有抑菌能力的菌株,占所用菌株的3.64%.内生细菌的抑菌活性在18.74%~53.01%(表4)。如图4所示,菌株DSG3、DSY6、KDG5对尖孢镰刀菌、腐皮镰刀菌、木贼镰刀菌3种病原真菌均有不同程度的抑菌作用,未筛选出对束状炭疽菌、灰葡萄孢菌和叶点霉菌有抑菌活性的菌株。KSG7对尖孢镰刀菌的抑菌能力最强,抑菌率为53.01%,DSY6对腐皮镰刀菌的抑菌能力最强,抑菌率为39.87%,QHG9对木贼镰刀菌的抑菌能力最强,抑菌率为45.28%.DSG3、CHG4、KDG5、KDG4这4株拮抗细菌兼具固氮、溶磷及产IAA的促生功能。
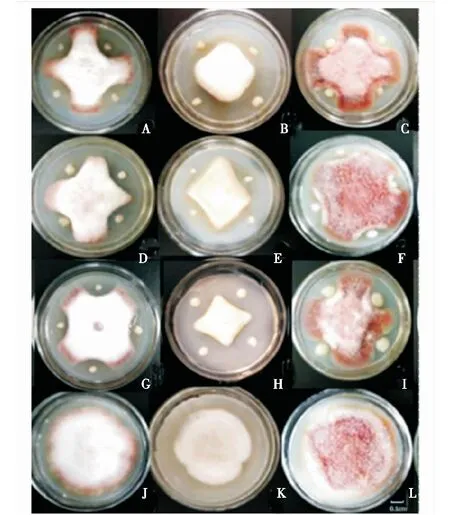
A,B,C分别为KDG5对尖孢镰刀菌、腐皮镰刀菌、木贼镰刀菌的抑制作用;D,E,F分别为DSG3对3种病原菌的抑制作用;G、H、I分别为DSY6对3种病原菌的抑制作用;J、K、L分别为3种病原菌的对照。
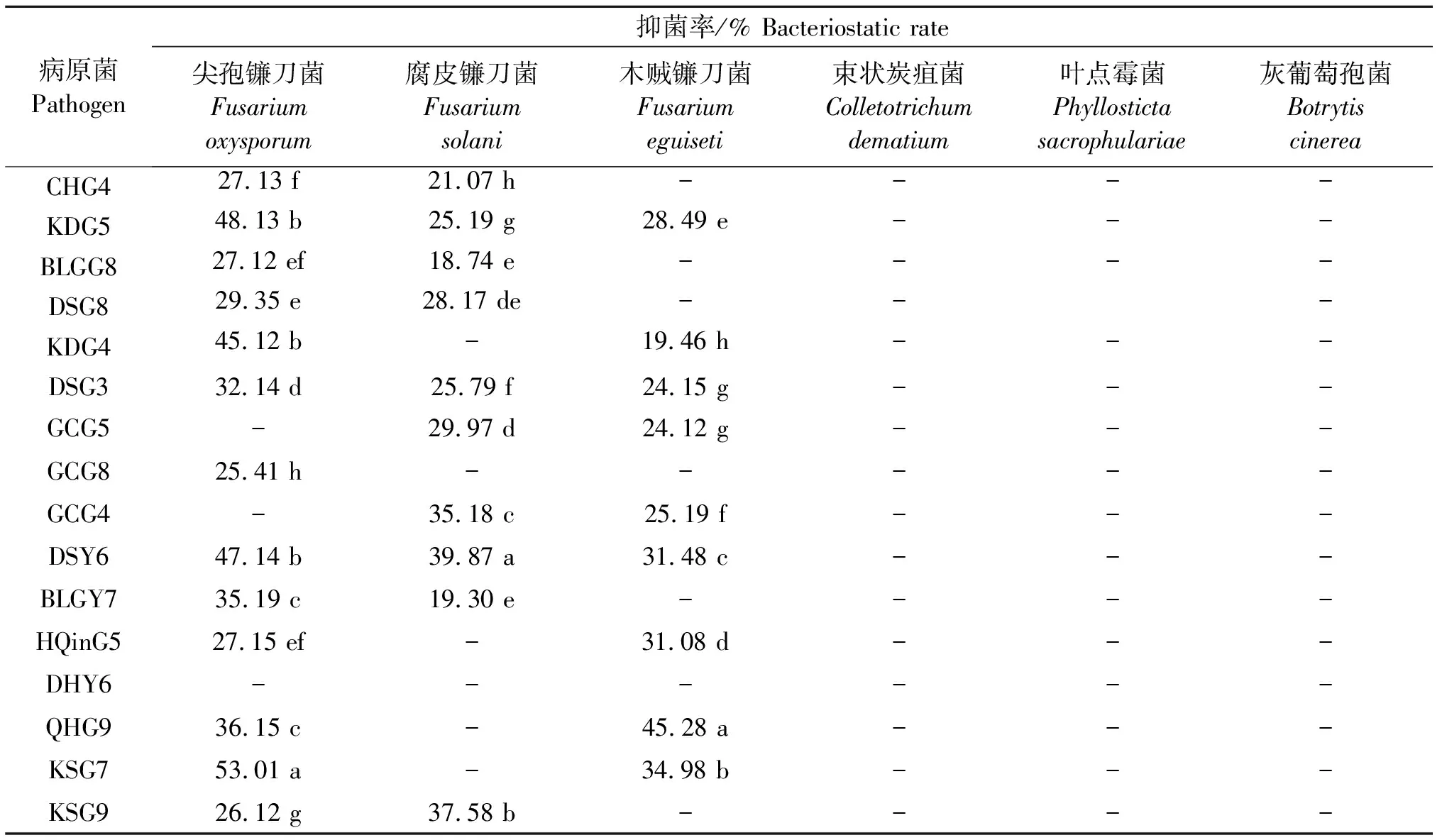
表4 拮抗内生细菌对植物病原真菌的抑制活性
供试6种病原真菌分别为尖孢镰刀菌FusariumoxysporumSchlecht.、灰葡萄孢菌BotrytiscinereaPers.、腐皮镰孢菌FusariumsolaniMart.、木贼镰刀菌Fusariumeguiseti(Corda)Sacc.、叶点霉菌PhyllostictasacrophulariaeSace.、束状炭疽菌ColletotrichumdematiumGrove。
3 讨论
本研究对甘肃省13种药用植物内生细菌的数量、分布特征、促生特性(固氮、溶磷、产IAA)及抑菌活性进行了测定与分析。发现13种药用植物中共有439株药内生细菌,其分布情况为根>茎>叶,该分布情况与多个研究结果一致。文献报道大多数植物内生细菌的数量分布规律总体为:地下组织远高于地上组织,以根中最多,是内生细菌最适宜定殖的部位;其次是茎和叶片,生殖器官花、果实、种子中最少[20]。如张立新[21]等从番茄中共分离出 59株内生细菌,其中,根部分离出41株,茎中分离出18株,叶中分离出11株。罗明报道[22],根中内生细菌的菌群密度约为8×103~9.9×106cfu/g;茎中为2×102~2.1×107cfu/g;叶片内为l×102~9.9×106cfu/g,本次从13种药用植物中分离得到的内生细菌里面,根中菌群密度最大,为2.18×104~5.58×104cfu/g;茎次之,为1.58×104~4.38×104cfu/g,叶中最小,为0.80×104~3.48×104cfu/g。在不同部位分布的内生细菌种类和数量有较大差异,可能是因为近根系营养物质丰富,有利于内生细菌的生长繁殖[23]。
药用植物内生细菌可通过自身的固氮、溶磷及产IAA直接促进植物生长.张洁等[24]从半夏中分离到的嗜麦芽寡养单胞菌通过固氮和溶磷作用向植物提供营养成分,从而促进植株的生长发育.Pan和 Vessey[25]报道指出,一些内生细菌能分泌生长素能促进植物生长的化学物质来促进植物生长.内生细菌也可以通过对不同植物病原菌的拮抗作用间接的促进植物生长.范晓静等[26]从银杏中分离到一株对植物病原真菌抑菌效果较好,且具有较广拮抗谱的解淀粉芽孢杆菌,检测表明该菌所产生的挥发性物质具有较强的抗菌效果,为我国新型生物源农药的研制提供了参考菌源。
本研究初筛得到较高比例的固氮菌184株,但只是对内生细菌有无固氮能力作了初步判断,没有进一步测定固氮酶活性,因此结果可靠性不强.固氮酶活性是衡量生物固氮效率的重要指标之一.除了体外固氮能力的测定,还应该将固氮菌回接到植物体内研究其促生效应,为进一步筛选高效固氮菌奠定基础.近年来,国内外研究者对各类植物中的固氮菌及其固氮能力进行了研究,发现许多植物中都存在较高比例的固氮菌。例如,从尼瓦拉野生稻中共分离到57株内生细菌,其中44株为内生固氮菌,固氮酶活性在5.79~899.72 nmol/(mL·h)之间[27]。
将439株内生细菌用溶磷圈法初步筛选溶磷菌株,48株内生细菌能够在PKO无机磷培养基形成透明圈,对无机磷有良好的溶解效果。溶磷圈大小可能与其生长时间有关,也与其分泌代谢物的种类、释放速度以及代谢物在平板上的蔓延速度等有关[28]。溶磷量在2.85~49.37 mg/L之间,说明药用植物内生细菌对无机磷的溶解能力较强。
另外,菌株的溶磷机理也非常复杂,如分泌质子、有机酸和其他物质的数量和种类,其次,与难溶性磷酸盐的结构和组成成分有关系,本研究各菌株的溶磷机理有待进一步研究[29].
很多植株内生细菌都具有分泌IAA能力,分泌量差异较大。Malik等[30]用比色法测定了巴基斯坦盐碱地小麦等植物的内生细菌分泌IAA能力,其在5.11~35.90 mg/L之间。本研究各菌株产IAA能力进行定性和定量测定结果基本一致,各菌株分泌量在5.49~56.38 mg/L,略高于Malik的测定结果。出现这种现象的原因可能与与菌株种类、生理和生态特性及培养条件等因素有关.筛选 IAA分泌内生细菌时,不应只把菌株分泌 IAA的量作为简单的衡量指标,而应与测定菌株对植物的实际促生效果等方法相结合,以便筛选到适合进一步开发利用的促生菌资源[31]。
4 结论
选用甘肃省8种常见的植物病原菌进行抑菌试验。从13种药用植物中共筛选出16株具有抑菌能力的菌株,占所用菌株的3.64%。具有抑菌活性菌株的抑菌率在18.74%~53.01%之间,这为药用植物病害的生物防治提供了一定的理论依据。内生菌细通过产生抗生素类、水解酶类、生物碱类以及与病原微生物竞争营养物质的方式来控制植物病害,本研究分离得到的抗性菌株究竟是哪类物质起作用及如何提高其抑菌活性还需进一步的研究[32]。综合以上研究结果,DSG3、CHG4、KDG5、KDG4这4株拮抗细菌兼具固氮、溶磷及产IAA功能,丰富了植物促生细菌资源,为进一步研发单一或复合微生物菌肥奠定了基础,具有良好的开发潜力和应用前景。
