稀盐盐生植物的耐盐机理研究进展
2022-07-04黄志磊汪军成姚立蓉孟亚雄尚勋武王化俊
黄志磊,汪军成,姚立蓉,孟亚雄,尚勋武,王化俊
(1.省部共建干旱生境作物学国家重点实验室,甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州 730070;2.甘肃农业大学农学院,甘肃 兰州 730070)
在中国,特别是在干旱、半干旱和盐水大量灌溉的地区,土壤盐渍化程度正在逐步增加[1]。预计到21世纪中叶,土壤盐碱化的加重将导致全球50%的可耕种土地流失[2]。土壤中盐分过高会触发植物一系列生理和分子反应,对植物生长发育,生化特性,活力和产量都有严重影响。盐胁迫被认为是影响许多作物农业生产力的最有害的环境问题之一,土壤盐渍化加剧严重威胁世界粮食安全。经过长期的适应与进化,许多植物开发了各种适应策略以抵抗盐胁迫,盐生植物即为一类抗旱耐盐的先锋植物。根据对盐度的生理适应,可将盐生植物分为3个生理类型:一是稀盐盐生植物,通过肉质化和快速生长以提高水分含量[3-6],或离子区隔化[7-9]以达到稀释盐分目的,如雾冰藜[Bassiadasyphylla(Fisch.et C.A.Mey.)Kuntze],盐生草[Halogetonglomeratus(Bieb.)C.A.Mey.],小叶碱蓬(SuaedamicrophyllaPall.),盐角草(SalicorniaeuropaeaL.)和盐爪爪[Kalidiumfoliatum(Pall.)Moq.]等多属藜科;二是泌盐盐生植物,通过盐腺或盐囊泡主动泌盐[7,10],常见于滨藜属(AtriplexL.)如疣苞滨藜与白滨藜、驼绒藜属[Ceratoides(Tourn.)Gagnebin]的驼绒藜;三是拒盐盐生植物,通过原生质膜选择性吸收或排斥离子[11-12]主要是禾本科(Gramineae),豆科(Leguminosae)等。
近年来,由于泌盐盐生植物的特殊生理结构和拒盐盐生植物主要是农作物而被广泛关注和研究,而稀盐盐生植物耐盐机理方面的研究和报道较少。根据稀盐盐生植物的物种、基因型、适应性和其他特征,不同稀盐盐生植物对盐分的反应不同。稀盐盐生植物对盐胁迫的耐受性涉及大量复杂过程,例如形态学特征、抗氧化防御系统、渗透调节、激素调节和离子稳态等。要了解这种错综复杂的机制,最重要的是要了解钠、钾离子在植物细胞内运行的关键途径。目前植物抗逆和生长适应的信息主要来自拟南芥等模式作物,尚未转移到大田作物上。为了能够提高农作物的耐盐性,需要了解更多稀盐盐生植物对盐胁迫的适应特性,挖掘耐盐基因,掌握耐盐机理和途径。培育更多的耐盐作物品种是提高盐碱化农田上作物抗逆性和产量的一项重要策略。
1 形态学特征
稀盐盐生植物多生活在荒漠及盐碱土地区,多为草本或半灌木,在长期的发展和进化过程中形成了与盐碱生境相适应的形态结构,其显著特征在于其轴器官中普遍存在异常结构,即附加维管柱结构式样和一些过渡类型。前人发现稀盐盐生植物异常结构中所具有的薄壁结合组织细胞极大提高了植物的耐盐能力[13]。另外,稀盐盐生植物有发育迅速的深根系,在保水贮水方面具有重要作用,如盐生草;叶片缩小甚至退化消失,体现出叶肉质化,组织液含大量盐分而具很高的渗透压和细胞的渗透势,如圆叶盐爪爪,叶呈肉质棒状;叶片角质膜都较厚,如心叶驼绒藜角质膜厚达5.1 μm;多数植物叶片上密被表皮毛,如驼绒藜表层的星状表皮毛,防止强光对植株的伤害的同时降低蒸腾作用[14-15]。稀盐盐生植物形态学特点在最大程度上减轻盐胁迫对自身的伤害,对于其适应盐碱、干旱等恶劣环境具有积极作用。
2 抗氧化防御系统
盐胁迫会扰乱稀盐盐生植物各种生理和生化过程,造成活性氧(ROS)的产生和膜渗漏等。ROS包括为H2O2,超氧化物阴离子(O2-)和羟自由基(OH-)等。植物中ROS作用取决于其数量,既起有益作用,也起有害作用。当ROS数量较少时,它们在细胞器中具有次级信使的功能;而在高浓度时,ROS造成坏蛋白质损伤,脂质过氧化,膜功能异常,破坏遗传物质和其他生物分子,导致程序性细胞死亡从而阻碍细胞的正常功能[16]。抗氧化系统由位于不同细胞区室的酶组成,可将盐胁迫产生的有毒自由基从细胞中消除。包括过氧化氢酶(CAT),超氧化物歧化酶(SOD),抗坏血酸过氧化物酶(APX),谷胱甘肽还原酶(GR),单脱氢抗坏血酸还原酶(MDHAR)和愈创木酚过氧化物酶(GPX)等。
有研究表明CAT是第一种在防御氧化应激中起作用的酶,其独特之处在于它不需要任何还原剂,而且广泛存在于叶绿体,线粒体和细胞质中。CAT主要减轻光呼吸过程中产生的ROS,对H2O2具有特异性,通过脂肪酸β氧化进行H2O2的清除,可以将其转换为H2O和O2[17-19]。同样广泛存在于这3种细胞器的还有SOD,根据金属辅基的不同,分为叶绿体中的Fe-SOD,线粒体中的Mn-SOD,细胞质中的Cu/Zn-SOD 3种同工酶[20]。APX功能与CAT相同,是抗坏血酸-谷胱甘肽(ASC-GSH)循环的组成部分,与CAT不同的是,APX使用抗坏血酸(AA)作为H2O2的催化或清除的还原剂。在高等植物的线粒体,类囊体,基质,胞质溶胶和过氧化物酶体中发现了5种不同类型的APX同工酶,其存在于各种细胞器中的特性及其对过氧化氢自由基的最高亲和力,使其能够有效清除植物中的H2O2。MDHAR在不同细胞器中的也具有各种同工酶形式,是仅使用有机自由基MDA作为底物并还原苯氧基的已知酶类[21-22]。它以NADPH作为电子供体从单脱氢抗坏血酸(MDHA)自由基再生抗坏血酸(AA)。谷胱甘肽还原酶(GR)主要存在于叶绿体中,是NAD(P)H依赖性酶,可将谷胱甘肽二硫化物(GSSG)还原为谷胱甘肽(GSH),并平衡细胞GSH/GSSG的比率。植物中GR活性的增加导致GSH的积累,GSH使用NADPH与羟基自由基和超氧化物自由基反应,从而防止了细胞的氧化损伤,最终赋予植物抗逆能力。GPX是一种应激酶,以愈创木酚和邻苯三酚作为电子供体进行催化,可以清除植物体内的大多数过氧化物[23]。盐碱生境对稀盐盐生植物造成了一定的伤害,但其可以通过相应的生理反应降低损伤的程度。有研究表明,许多稀盐盐生植物在盐胁迫条件下会增加以上几种抗氧化酶的活性,提高对盐分耐受性,克服由于过量生成ROS而引起的氧化损伤,如藜[24],盐生草[25]和盐角草[26]等。其后谷胱甘肽转移酶基因(GST)、抗坏血酸过氧化物酶基因、过氧化氢酶基因等与清除活性氧毒害相关的基因首先被克隆[27]。Northern杂交表明,在盐胁迫后,与清除活性氧自由基有关的关键酶基因的表达量大大增加,相应的酶活性都有显著提高,说明可清除氧自由基的抗氧化酶类的表达起到了缓解盐胁迫的作用。
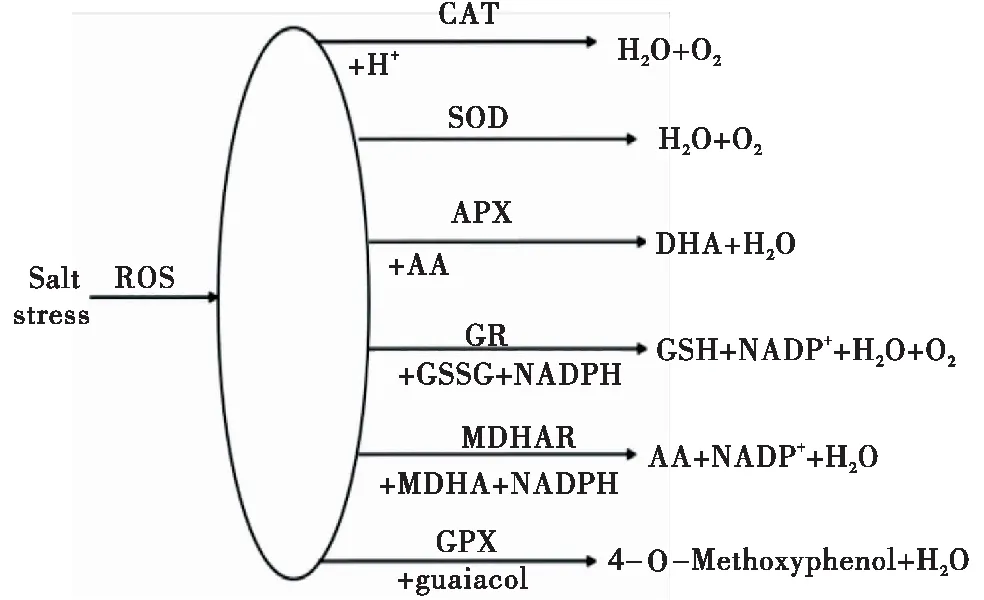
图1 植物耐盐抗氧化防御机制
3 渗透调节
渗透调节是植物在逆境下主动积累有机或无机物质来提高细胞液浓度,降低渗透势,提高细胞吸水或保水能力,从而适应胁迫环境的过程,主要有无机渗透调节和有机渗透调节两种方式。
应激条件下植物细胞胞质中离子浓度的平衡对于代谢酶的调节、膜电位维持和细胞体积调节非常重要[28]。植物有能力通过初级和次级运输从体内消除额外的盐离子以维持Na+和 K+离子的浓度平衡,以此在胞质溶胶中保持低浓度的 Na+离子[29]。无机渗透调节主要依靠Na+、K+、Ca2+、Cl-、SO42-、NO3-来进行。这些离子被转运蛋白(如质膜 H+-A TPase、液泡 H+-A TPase、H+-焦磷酸盐和 Ca2+A TPase)在细胞液泡中分隔开来。稀盐盐生植物质膜和液泡膜上的Na+/H+逆向转运蛋白负责转运上述无机离子,细胞膜和液泡膜上的H+-ATPases为Na+/H+逆向转运蛋白运输无机离子提供能量,从而保证细胞质中低 Na+和高K+/Na+水平,维持细胞内环境的稳态[30]。
稀盐盐生植物在盐胁迫下,一些具有较强亲水性大分子渗透调节物相继生成并积累,它们有助于稳定胶体性质,以防止酶或蛋白质变性,并保护细胞膜的完整性,如脯氨酸、甘氨酸甜菜碱等。脯氨酸是一种常见并极易溶于水的渗透质,通常会大量积累并溶解于细胞质中以响应植物的盐胁迫。它有助于渗透调节和稳定亚细胞结构,并可提高抗氧化酶活性和光合活性,以增强植物的耐盐性[31]。有研究发现在盐胁迫条件下,盐角草和翅碱蓬通过提高体内的脯氨酸含量来提高自身的抗胁迫能力[32-33]。除脯氨酸外,甜菜碱的合成和积累在逆境环境下也起了重要的调节作用[34-35]。甘氨酸甜菜碱是一种水溶性的两性季铵盐化合物,是通过渗透调节保护细胞的主要次生代谢物之一[36]。碱蓬胆碱单加氧酶基因(CMO)和甜菜碱醛脱氢酶(BADH)转入烟草后显著提升了其耐盐能力[37]。部分植物如水稻、马铃薯、番茄等基本不能合成甜菜碱,因此能否将甜菜碱合成的有关基因导入这些植物并表达以增强其耐盐能力已成为研究的重点。
4 激素调节
激素对植物耐盐性的调控在于对植物生长的抑制效应和对胞内代谢的调节作用,主要包括脱落酸(ABA)、乙烯(ETH)、赤霉素(GA)、细胞分裂素(CTK)和生长素。ABA与ETH等抑制类激素在植株受到盐胁迫信号后含量上升。ABA作为最重要的胁迫反应激素之一,在盐胁迫防御中发挥着不可替代的作用。ABA不只参与盐胁迫下气孔导度、离子和活性氧的调节,作为对盐胁迫的响应,ABA激活的SnRK2s还通过调节淀粉向糖和糖衍生的渗透调节物质的BAM1-和Amy 3-依赖性分解来调节渗透稳态[38]。有研究表明,盐胁迫不仅在转录水平激活了乙烯合成前体ACC合成酶ACS 7,而且通过MAPK级联的激活在蛋白质水平磷酸化和稳定了ACS2/6;进一步的转录组谱分析表明,盐胁迫直接调节乙烯信号传导的关键成分,诱导许多EIN3/EIL1依赖性防御相关基因的表达[39]。促生长类激素如GA、CTK和生长素感受胁迫信号后含量降低,使植物生长速率下降,由生长状态向胁迫适应状态转变。在盐胁迫下,GA处理极大促进了异子蓬与盐穗木种子的萌发,这主要由于DELLA蛋白(天冬氨酸-谷氨酸-亮氨酸-亮氨酸-丙氨酸)家族的浓度在植物处于盐胁迫条件下会增加,直接参与调节植株生长,开花的时间和植物激素信号传导途径[40-41]。CTK在植物盐适应中起负面作用,如发现异戊烯基转移酶(IPT)的敲除或ckx氧化酶/脱氢酶(ckx)的过表达导致内源CK水平的降低导致对盐胁迫和干旱胁迫的耐受性增强。轻度盐胁迫诱导少量ABA,激活生长素信号传导以形成侧根原基,而高盐浓度导致ABA过量积累,破坏生长素的分布和侧根的形成[42]。
激素调节是植物为了应对盐胁迫而进化的重要策略之一,各类激素协同作用提高了稀盐盐生植物耐盐性,提高其在逆境中的生存机率。目前各种激素的合成已经取得了较大进展,但是激素如何具体调控植物耐盐性还不够清楚。植物不同激素间具体如何进行功能划分或者协同作用应对胁迫等还有待进一步探索。深入研究盐胁迫下稀盐盐生植物激素调节相关机制对农业生产具有十分重要的意义。
5 离子稳态
维持并控制整个植物细胞中离子浓度恒定的过程称为离子稳态。在盐胁迫条件下控制细胞质中离子浓度对于调节代谢酶,维持膜电位和调节细胞体积极其重要[43]。稀盐盐生植物具有从细胞质中转运多余Na+和K+的能力,以维持Na+和K+在胞质中的平衡,从而保持Na+离子在细胞质中的浓度较低[44-45]。Na+通过非选择性阳离子通道(NSCCs)进入根表皮和皮层细胞,诱导质膜去极化激活K+向外整流通道,并通过向内整流K+通道减少净被动K+吸收[46-47]。Na+在植物体内的运输过程中,位于质膜上的盐超敏感蛋白(salt overly sensitive 1,SOS1)和高亲和性钾转运体(high-affinity K+transporter,HKT)及位于液泡膜的 Na+/H+反转运蛋白(Na+/H+antiporter,NHX)发挥着重要的作用。
HKT是一类Na+或K+转运体或Na+-K+共转运体,在植物遭受盐胁迫时于维持离子稳态中发挥关键作用[48]。从小麦中分离得到HKT家族的第1个成员TaHKT2;1,以H+与Na+电化学梯度作为能量来源,使H+与K+运输进细胞内,表现出显著的Na+-K+协同转运特性[49]。James等应用定量遗传分析的方法鉴定出了小麦中的2个基因座,即TmHKT1:4A2(NAX1)和TmHKT1:5-A(NAX2),它们通过叶片木质部排出Na+来减少叶片中Na+的积累[50]。NAX1增强了叶鞘中Na+的保留能力,从而限制了其向叶片的进一步运动;NAX2的作用仅限于根部,作为Na+选择性转运蛋白调节Na+从根木质部释放。因此,由于在木质部K+和Na+之间趋于平衡,导致从根到茎Na+转运减少。在小麦根中还发现了另一个基因座TaHKT1:5-D(KNA1),其功能与NAX2类似[51]。2种稀盐盐生植物(碱蓬、盐角草)和3种甜土植物(拟南芥、水稻和小麦)的HKT1氨基酸组成、亲/疏水性、N-糖基化位点差异不明显,但是信号肽、同源序列分析及多重序列比对分析存在明显的差异[52]。稀盐盐生植物小花碱茅(Puccinelliatenuiflora)、盐芥(Thellungiellasalsuginea(Pall.)O.E.Schulz)和赤桉(Eucalyptuscamaldulensis)的PutHKT2;1、TsHKT1;2和EcHKT1;1等蛋白可以在高钠低钾条件下优先选择吸收K+,保持K+吸收的同时从根部吸收较少的Na+,使根部组织及根部原生质体中具有较高的K+/Na+比值[53-57]。HKTs在木质部薄壁组织中表达,其中相应的蛋白质通过从木质部中回收Na+来限制叶片中的Na+积累[58]。另一种类似HKT1的蛋白质负责将木质部中的Na+转运至茎韧皮部,从而促进Na+从茎向根的逆转位并抑制Na+在茎中的积累[59]。在不同的农作物中也报告了HKT,包括水稻(OsHKT1:1,OsHKT1:2,OsHKT1:3,OsHKT1:4和OsHKT1:5)[60],小麦(TaHKT1:1/2,TaHKT1:5-D,TmHKT1:4-A2和TmHKT1:5-A),大麦(HvHKT1:1/2,HvHKT1:4和HvHKT1:5)[61,62]和玉米(ZmHKT1)[63]。此外,也已证实,来自盐芥的TsHKT1可以维持拟南芥中的K+吸收[64];AtHKT1与 ZmHKT1:5的异位表达增强了烟草的耐盐性[65-66];TaHKT1在小麦中过表达提高了其耐盐性[67]。
NHX通过Na+液泡区隔化调节细胞质Na+的浓度,使植物细胞水势降低防止水分流失[68-69]。拟南芥细胞内的NHX组成1个多基因家族(NHX1-NHX6),分为2个亚组:NHX1至NHX4分为1组,而NHX5和NHX6则属于第2组[70]。AtNHX1是最具特征的细胞内NHX,具有K+,Na+/H+反转运蛋白的作用,此外,在拟南芥和番茄中研究的NHX5和NHX6也可以维持离子稳态[71]。NHX1定位于液泡膜,其调节作用是由液泡内Ca2 +通过Ca2 +结合蛋白与位于液泡的NHX1的C末端结合而介导的[72]。高浓度盐胁迫会引起细胞内Ca2 +聚集,从而激活Ca2 +结合蛋白并上调Na+/H+反向转运蛋白以去除Na+[73]。NHX催化液泡中Na+的运动,以交换细胞内的H+;H+-ATP酶和液泡膜质子焦磷酸酶(V-H+-PPase)产生的H+梯度同样刺激液泡内Na+运动[74]。稀盐盐生植物北滨藜(Atriplexgmelini)通过盐胁迫在转录和蛋白质水平上观察到液泡膜上AgNHX1基因的诱导表达;转基因水稻中液泡型Na+/H+逆向转运蛋白的活性是野生型水稻的8倍,显著提高了其耐盐性[75-76]。从盐生植物海蓬子中分离出的SbNHX1同样诱导茴香[77],蓖麻[78]和麻风树[79]耐盐性的提升。有大量报道表明稀盐盐生植物Na+液泡区隔化能力更强的原因在于NHX在盐生植物中呈组成型表达,且与盐胁迫对其活性的刺激相关[80]。相反在甜土植物中NHX的表达必须受NaCl刺激的激活才能够起作用,且这种激活效应只有在比较耐盐的甜土植物中才会出现,对盐敏感的植物而言,NHX的表达水平极低,且不受NaCl胁迫诱导[81-82]。因此,通过超表达稀盐盐生植物NHX基因很有可能提高作物的耐盐性。目前已有研究表明,盐生植物NHX基因的超表达在一定程度上提高了拟南芥[83]、烟草[84]、苜蓿[85]、水稻[76]等植物的耐盐性,但目前并没有在大田作物上广泛推广种植。
植物中调控离子稳态和耐盐性的主要途径是盐过度敏感(SOS)胁迫信号传导途径[86]。该途径由3种蛋白质SOS1,SOS2和SOS3组成,并且是钙信号的传感器,可以开启Na+出口和K+/Na+识别的机制。细胞内Na+水平升高诱导钙信号激活一种位于质膜上的钙调神经磷酸酶Ca2+结合蛋白,即SOS3;SOS2是1种丝氨酸/苏氨酸蛋白激酶,随后被SOS3激活;SOS2最终诱导了SOS1的表达(图2)。SOS1是一种Na+/H+反向转运蛋白,在细胞水平上调节Na+的流出,并恢复细胞离子稳态,从而诱导植物对盐分的耐受性[87]。Shi等首次通过拟南芥的盐过度敏感(SOS)突变体鉴定和表征了SOS1,随后SOS1转运蛋白被证明在拟南芥根尖和木质部薄壁组织中表达,而且在Na+的远距离运输中起作用[88-90]。如果质膜H+ATPase的活性达到适当水平,SOS1的过表达可能会通过减少分生组织细胞对Na+的净吸收而使根在盐土中继续生长,并增强Na+从成熟根细胞向芽的转运以进行渗透调节。将稀盐盐生植物马齿苋中SpSOS1导入拟南芥,结果表明,表达SpSOS1的拟南芥在盐胁迫下比野生植株生长得更好,根中的钠离子和氢离子比野生型植物根流出得更快,SpSOS1赋予转基因植物更好的耐盐性[91]。许多研究表明,SOS途径基因(AtSOS1,AtSOS2和AtSOS3)在转基因拟南芥[92]和高羊茅[93]中的共表达显著提高了植物的耐盐性。但是,单个SOS基因的过表达对植株耐盐性提升程度有限[94]。此外,OsSOS1和SlSOS2的过表达分别加强了水稻[95]和番茄[96]细胞中Na+的外排。多项研究表明,异源表达的SOS基因可提高包括拟南芥[97-99]和烟草[100]在内的植物的耐盐性。Foster和Miklavcic利用生物物理模型对进行了研究,结果表明,成熟根区的表皮和中柱之间的SOS1转运功能明显不同[101]。在表皮中,SOS1限制钠离子进入根细胞,降低根细胞的胞质钠离子水平,而在中柱中,SOS1主动将钠离子加载到木质部中,增强钠离子向茎的流动[101]。所以,本文推断SOS基因家族各个成员功能并不唯一,在不同部位或者不同组合的情况下其调控的耐盐机制不同,SOS1表达的组织特异性变化可用于确定限制 Na+对芽的吸收与保持水分吸收之间的适当平衡,这可能会导致耐盐性增强。

图2 稀盐盐生植物Na+转运机制
6 展望
盐生植物在盐胁迫下具有极强的抗逆性,目前已有研究表明转化具有耐盐性候选基因的植物,可以增强其盐分耐受性。部分稀盐盐生植物的基因已被证明具有改善甜土植物盐分耐受性的作用。尽管近年来我们对盐生植物耐盐性机理的理解取得了重要的研究进展,但仍需要进行更详尽的研究以扩展有关稀盐盐生植物盐胁迫响应的知识。目前研究表明,抗氧化防御系统,渗透调节,激素调控,离子区隔化及耐盐基因的过表达在稀盐盐生植物耐盐性中起着至关重要的作用。进一步研究以确定外源性渗透保护剂和激素最有效的浓度、施用次数、最适植物种类及最敏感生长阶段,有望提高它们在胁迫环境下作物生产中的有效利用。同时,利用先进的分子生物学技术,精确阐释稀盐盐生植物独特的耐盐机制,挖掘耐盐基因也为以后作物耐盐育种提供基因资源。虽然尚不清楚是否可以将稀盐盐生植物耐受性机制转移到作物上而不会造成产量损失,但这是进一步探索的方向。
