原发性失眠患者脑磁共振波谱成像研究
2022-05-31苏晓艳赵莲萍谢宇平方燕燕张文文周丽雅惠培林王旭斌
苏晓艳,赵莲萍,谢宇平*,方燕燕,张文文,周丽雅,惠培林,王旭斌
作者单位:1.甘肃省人民医院睡眠医学中心,兰州 730000;2.甘肃省人民医院放射科,兰州 730000;3.甘肃省人民医院脑电图室,兰州 730000
原发性失眠(primary insomnia,PI)是指以失眠为几乎唯一的症状,睡眠时间少于6 h/天,上述睡眠障碍至少3晚/周并持续3个月以上[1]。大脑在睡眠中起重要作用,其中丘脑在清醒与睡眠的转换中起重要作用,研究已经证明丘脑神经元与睡眠纺锤波的产生以及睡眠和觉醒的转换调节有关[2]。海马与睡眠关系密切[3],且与记忆储存有关,PI 患者表现出记忆缺陷[4]。有研究发现PI 患者海马、丘脑、前额叶等区域[5]神经解剖发生改变,双侧海马体积明显减小[6]。但是,PI患者大脑代谢产物有无改变,与失眠的发生发展有无关联,目前这方面的研究较少。仅国内有研究发现PI 患者左、右两侧额叶氮-乙酰天门冬氨酸(N-acetylaspartate,NAA)/肌酸(creatine,Cr)水平均低于正常健康对照(healthy control,HC)组;右侧额叶胆碱复合物(choline-containing compounds,Cho)、Cho/Cr 水平均高于HC 组,从而认为双侧额叶NAA 和右侧额叶Cho 均可能与PI 的发病机制有关[7]。氢质子磁共振波谱成像(proton magnetic resonance spectroscopy,1H-MRS)能够无创伤测定活体特定组织区域神经生化物质的浓度。因此,为填补此空白,本研究采用多体素1H-MRS技术半定量研究未经药物治疗的PI患者双侧丘脑、海马和壳核区NAA、Cho和Cr浓度,用以探讨PI的发病机制,为PI的机制研究补充内容。
1 资料与方法
1.1 研究对象
连续性纳入2018 年6 月至2021 年6 月就诊于甘肃省睡眠医学中心的PI 患者和广告招募的PI 患者,并通过广告招募年龄、性别匹配的健康志愿者作为对照组,保证2组成员无血缘关系。所有受试者第一天22:00 由同一个专业睡眠技师进行多导睡眠监测(polysomnography,PSG),次日7:00 结束,第二天22:00行颅脑1H-MRS扫描。
PI组纳入标准:(1)符合《美国精神障碍诊断与统计手册》第5版的PI 诊断标准[1];(2)小学以上文化,汉族,右利手;(3)年龄18~65 岁。HC 组 纳 入 标 准:(1)睡眠质量良好,近2 周内无熬夜;(2)小学以上文化,汉族,右利手;(3)年龄18~65 岁。排除标准(两组均适用):(1)由于其他精神障碍以及酒精或药物、毒物等引起的继发性失眠;(2)伴有严重躯体疾病患者;(3)近期遭受重大心理刺激应激性失眠者;(4) PSG监测结果显示主观性失眠患者;(5) 呼吸暂停低氧指数(apnea hypopnea index,AHI)>15者;(6)头部外伤史者。
对所有受试者的睡眠质量及情绪障碍等进行以下量表评估:(1)匹兹堡睡眠质量指数量表(Pittsburgh Sleep Quality Index,PSQI);(2)失眠严重程度指数量表(Insomnia Severity Index,ISI);(3)状态-特质焦虑量表(State-Trait Anxiety Inventory,STAI);(4)贝克抑郁量表(Beck Depression Inventory,BDI)。
本研究为前瞻性研究,经由甘肃省人民医院院伦理委员会批准(批准文号:sy1120150043),且所有受试者均签署了知情同意书。
1.2 研究方法
PSG 监测、分图及各项数据计算方法:睡眠监测使用多导睡眠监测记录仪(Alice5 型,美国飞利浦公司),由接受过专业培训的睡眠技师连接导联并分图,睡眠分期按照美国睡眠医学会颁布的《睡眠及其相关事件判读手册(2.3 版)》[8]的标准执行。其中,总睡眠时间(total sleep time,TST)=卧床时间-总醒觉时间;睡眠潜伏时间(sleep latency,SL)=(入睡记录帧-熄灯记录帧)/2;睡眠效率(sleep efficiency,SE)=(总睡眠时间/卧床时间)×100;脑电觉醒反应指数(EEG Arousal Response Index,ArI)=脑电觉醒反应总数×60/总睡眠时间;各期睡眠百分比(N1、N2、N3、REM%)=(N1、N2、N3、REM 期睡眠时间/总睡眠时间)×100。
1H-MRS 数据采集:所有受试者安排睡眠监测次 日22:00 进 行1H-MRS 扫 描,采 用3.0 T 磁 共 振(MAGNETOMSkyra,Siemens Healthcare,Erlangen,Germany)进行多体素2D1H-MRS扫描。扫描时受试者静息闭眼但保持清醒。选择丘脑、海马、壳核为感兴趣区(图1)。所有操作采用双盲设计,操作医师/审核医师及志愿者均不清楚当前扫描志愿者所入的组别。所有扫描由同一名经验丰富的影像科主治医师操作,扫描后由同一名影像科副主任医师审核。成像参数:频率编码方向A/P;发射频率10;相位10;层厚10 mm;间隔10 mm;视野为24 cm×24 cm;TR/TE为1000 ms/144 ms;矩 阵18×18。扫 描 时 间5 min 28 s。
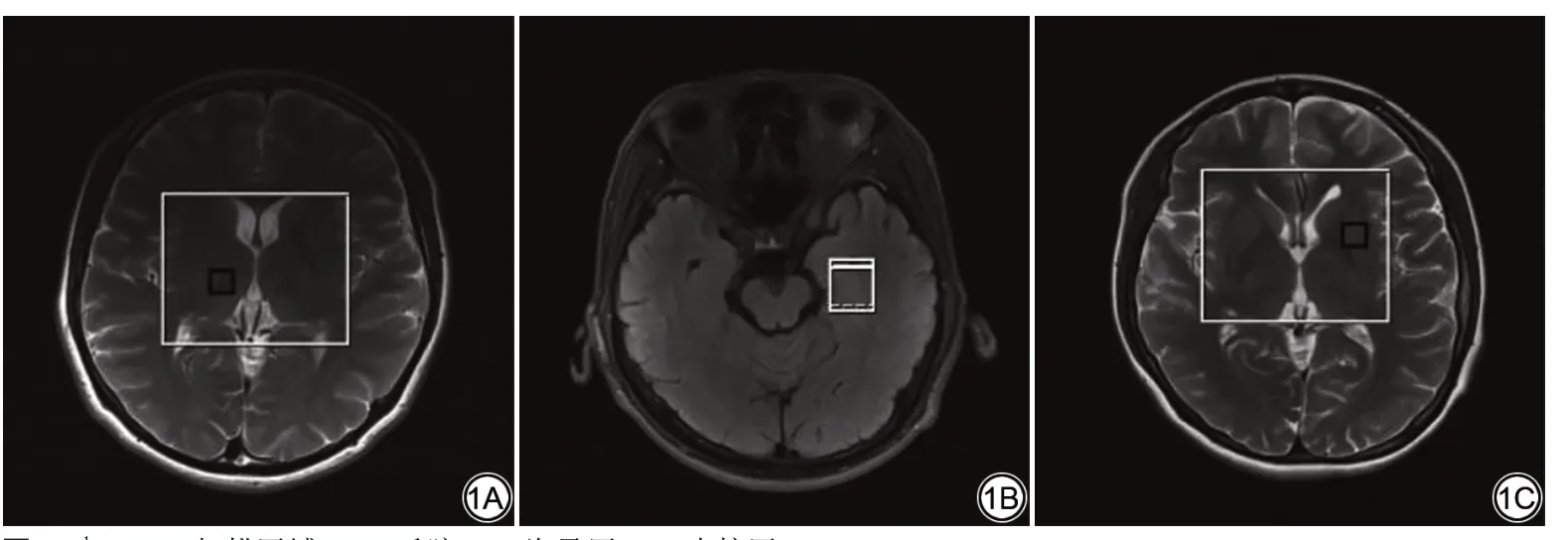
图1 1H-MRS扫描区域。1A:丘脑;1B:海马区;1C:壳核区。Fig.1 1H-MRS scanning area.1A:thalamus;1B:hippocampus area;1C:putamen area.
MRS 数据分析:使用美国通用公司ADW 4.5 工作站Functool 软件进行后处理,测定代谢物NAA、Cho和Cr的相对水平,并计算NAA/Cr和Cho/Cr比值。
1.3 统计分析
运用IBM SPSS 21.0 统计软件进行统计分析。P<0.05 为有统计学意义。将测量到的波谱数据(定量资料)进行正态性及方差齐性检验。对本研究中所有量表得分、PSG 数据和丘脑、海马、壳核区NAA、Cr、Cho、NAA/Cr、Cho/Cr 数据分析,若满足正态性及方差齐性,则PI 组和HC 组间比较采用独立样本t检验。若不满足正态性及方差齐性,则使用Wilcoxon 秩和检验进行数据分析。检验水准α=0.05,双侧检验。NAA、Cr、Cho、NAA/Cr、Cho/Cr 和PSQI、ISI、状态焦虑量表(State Anxiety Inventory,SAI)、特质焦虑量表(Trait Anxiety Inventory,TAI)、BDI 评分相关性,以及和PSG 数据的相关性采用Pearson 相关分析。相关系数r 绝对值越大,相关性越强,相关强度范围:0.8≤|r|<1.0 时极强相关,0.6≤|r|<0.8 时较强相关,0.4≤|r|<0.6时中等相关,0.2≤|r|<0.4时较弱相关,0≤|r|<0.2极弱相关或无相关。
2 结果
2.1 基线数据
数据处理时PI 组2 人、HC 组1 人因MRS 扫描时部分数据缺失而剔除,最终收集PI组38人,HC组39人,PI 组与HC 组年龄、性别、BMI 相比较,差异无统计学意义(P>0.05);ISI、PSQI、BDI、TAI、SAI 量表评分差异有统计学意义(P<0.05) (表1)。
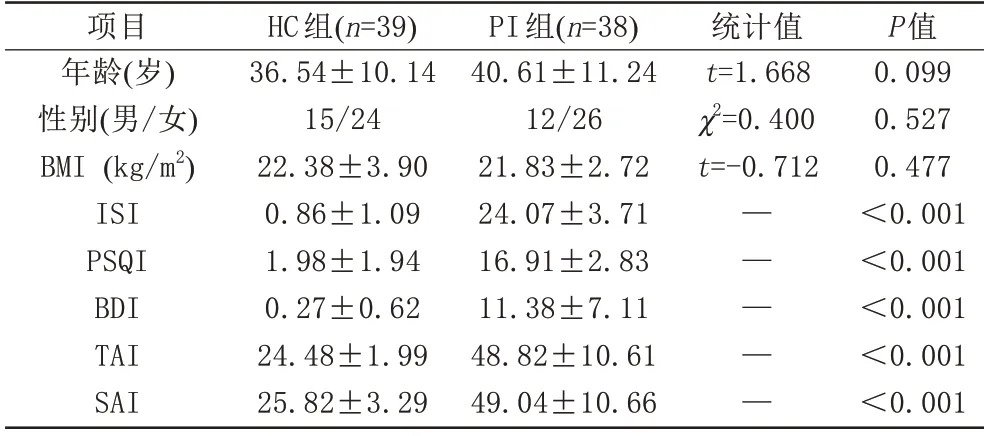
表1 PI组和HC组基线资料Tab.1 Baseline data of PI group and HC group
2.2 PI患者睡眠特点
PI患者存在入睡困难[SL=(92.87±45.82) min],总睡眠时间少[TST=(282.07±47.13) min],睡眠效率低 下(SE=52.24%±8.73%),夜 间 反 复 觉 醒[ArI=(13.91±5.84) 次/h]。
2.3 1H-MRS扫描结果
2.3.1 丘脑1H-MRS扫描结果
PI 组左侧丘脑Cr、Cho 值及右侧丘脑Cho 值高于HC组(P<0.05),均表现为浓度高于正常组;而双侧丘脑NAA、NAA/Cr、Cho/Cr 值以及右侧丘脑Cr 值差异无统计学意义(P>0.05) (表2)。
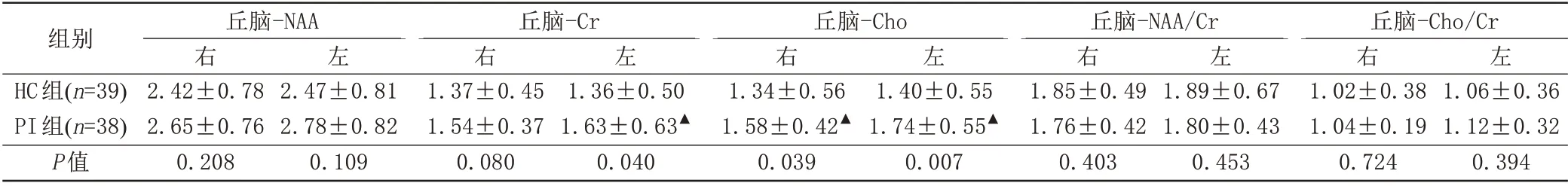
表2 丘脑1H-MRS扫描结果Tab.2 1H-MRS scan results of thalamus
2.3.2 海马区1H-MRS扫描结果
与HC 组相比,PI 组双侧海马NAA、Cr、Cho、NAA/Cr、Cho/Cr值差异无统计学意义(P>0.05) (表3)。
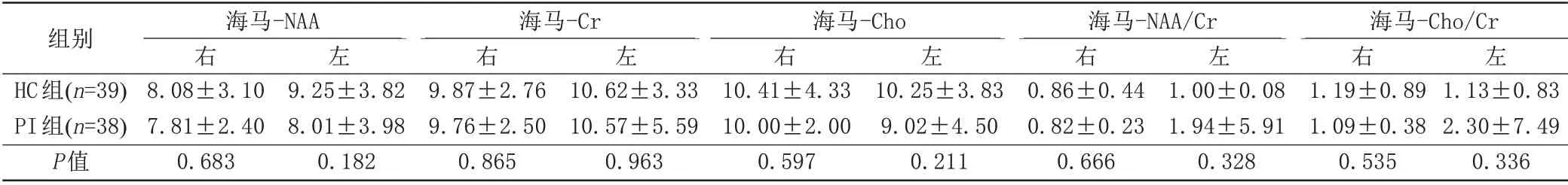
表3 海马区1H-MRS扫描结果Tab.3 Hippocampal 1 H-MRS scan results
2.3.3 壳核区1H-MRS扫描结果
与HC 组相比,PI 组双侧壳核NAA、Cr、Cho、NAA/Cr、Cho/Cr值差异无统计学意义(P>0.05) (表4)。
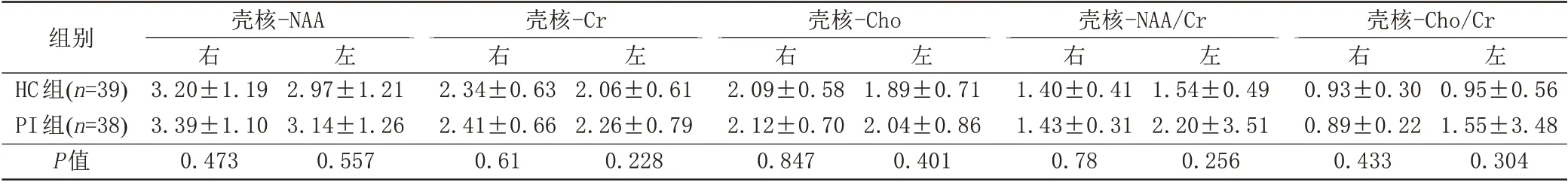
表4 壳核区1H-MRS扫描结果Tab.4 Putamen 1H-MRS scan results
2.4 大脑各区域与睡眠的相关性分析
(1)丘脑代谢与睡眠:失眠患者左侧丘脑NAA 值与TST、SE%负相关(r=-0.384,P=0.017),左侧丘脑NAA/Cr 值与REM%呈负相关(r=-0.387,P=0.016),右侧丘脑Cho/Cr 值与SL 呈正相关(r=0.380,P=0.019),丘脑NAA、Cr、Cho、NAA/Cr、Cho/Cr值与各量表评分未见明显相关。
(2)海马代谢与睡眠:失眠患者左侧海马Cho 值与ArI 呈正相关(r=0.348,P=0.044);右侧海马Cho 值(r=-0.334,P=0.047)、Cr 值(r=-0.445,P=0.007)与BDI评分呈负相关。
(3)壳核代谢与睡眠:失眠患者左侧壳核NAA 值与N3%呈正相关(r=0.340,P=0.037);左侧壳核Cr 值与TAI 呈正相关(r=0.447,P=0.005);左侧壳核NAA/Cr值与N1%(r=-0.344,P=0.047)、TAI评分(r=-0.521,P=0.001)、SAI 评分(r=-0.400,P=0.013)呈负相关;左侧壳核Cho/Cr 与TAI 评分(r=-0.527,P=0.001)、SAI评分(r=-0.434,P=0.007)呈负相关。
3 讨论
本研究使用1H-MRS 技术对38 名PI 患者和39 名HC 志愿者进行丘脑、海马区、壳核区扫描,结果显示:丘脑Cho 浓度PI 组左右两侧均高于HC 组;左侧丘脑Cr浓度PI组高于HC组。而海马及壳核NAA、Cr、Cho、NAA/Cr、Cho/Cr 未见明显差异。目前国内外无类似丘脑、海马及壳核的代谢研究。本研究进一步对PI患者丘脑、海马、壳核各脑区代谢物NAA、Cr、Cho 及NAA/Cr、Cho/Cr 与睡眠监测相关参数及各量表评分进行相关性分析。结果发现:PI 患者PSG 监测SE%低者丘脑NAA 浓度高,REM%低者左侧丘脑NAA/Cr 越高,N3%多者左侧壳核NAA 浓度高,N1%少者左侧壳核NAA/Cr 高,SE%高者右侧Cho/Cr 越高,PSG 监测显示睡眠质量较好者右侧丘脑NAA/Cr 越高,夜间ArI 高者左侧海马Cho 浓度高,BDI 低者右侧海马Cho、Cr 浓度越高,TAI高者左侧壳核Cr浓度高,SAI及TAI低者左侧壳核NAA/Cr、Cho/Cr 高。组间差异的参数与失眠各量表评分及PSG 睡眠参数未见明显的相关性。因此认为,丘脑和壳核区域代谢物水平与睡眠结构有相关性;壳核和海马区域代谢物水平与失眠患者情绪相关性更明显。
3.1 PI患者大脑代谢特点
由于PI 发病率很高,加上急性失眠能达到50%[9],失眠会导致社交活动减少[10],认知能力(如记忆力、注意力和定向力)出现缺陷[11-12],甚至引起重大安全事故,对全球经济造成巨大的损失,因此失眠得到国内外学者的重视。众多学者应用神经影像技术对PI 患者的皮质[13]等各脑区代谢物及功能连接[14-16]等进行研究,结果显示失眠患者某些脑区结构(尾状核、伏隔核、后壳核、海马、丘脑和杏仁核区域等[17])、功能、代谢等出现异常。其中大部分代谢物研究集中在额叶和枕叶的γ-氨基丁酸(Gamma-aminobutyric acid,GABA),而结果对于GABA 升高和降低并不统一[18-22]。国内学者采用GE 1.5 T Signa HD MR 对所有研究对象额叶及海马进行头颅磁共振波谱扫描,结果发现,PI患者左、右两侧额叶NAA/Cr水平均低于正常HC 组;右侧额叶Cho、Cho/Cr 水平均高于HC 组,从而认为双侧额叶NAA 和右侧额叶Cho 均可能与PI的发病机制有关[7]。本研究发现PI 患者睡眠分期及睡眠效率等与丘脑区域代谢物Cho 及Cr 相关性明显,提示PI患者丘脑Cho及Cr代谢紊乱。
3.2 PI患者情绪与大脑代谢的关系
临床中显见,长期失眠患者都伴随明显的情绪障碍。而情绪调节与丘脑、海马区密切相关,丘脑更是睡眠-觉醒障碍病理生理的主要区域[2],背侧纹状体由尾状核和壳核组成,其与丘脑紧密相连,是调节睡眠-觉醒的关键结构[23]。大鼠睡眠剥夺后海马神经元发生抑制[24]。PI 患者的海马灰质体积显著减少,也有研究发现两组脑区海马体积无差异[25]。睡眠障碍患者存在大脑代谢异常[26],大脑代谢与情绪以及认知之间存在相关性[27-28]。本研究发现:PI患者焦虑抑郁等情绪与海马和壳核区域的代谢有一定相关性。
因此本文得出结论:PI 患者丘脑Cho 及Cr 代谢紊乱,客观睡眠影响丘脑区域代谢,而患者情绪障碍主要影响到海马和壳核区域的代谢。
作者利益冲突声明:全部作者均申明无利益冲突。
