基于元认知理论的化学概念教学
2022-05-30徐小健
徐小健

摘要:以“化学键”第一课时教学为例,阐述基于元认知理论的化学概念教学。通过“感知化学键的存在与价值”“探讨离子键的形成过程”和“探讨离子键的存在与表征”环节,激发学生的元认知,加深对离子键的理解,解决疑难问题,取得较好的教学效果。
关键词:元认知;化学概念;概念教学;化学键;离子键
文章编号:1008-0546(2022)10-0071-05中图分类号:G632.41文献标识码:B
化学概念是将化学现象、化学事实经过比较、综合、分析、归纳、类比等方法抽象出来的理性知识,它是已经剥离了现象的一种更高级的思维形态,反映着化学现象及事实的本质,是化学学科知识体系的基础。[1]高中化学概念教学组织得好,对于学生建构化学学科观念,甚至对于其一生的概括、提炼和总结能力的提高,对学生的终生发展都有重要影响。[2]所以在教学时一定要重视化学概念的教学,目前指向核心素养的化学概念教学模式有论证式教学模式和基于 TPACK理论、基于元认知理论等化学概念教学模式,下面笔者就以人教版化学必修第一册第四章第三节“化学键”第一课时的教学为例,阐述基于元认知理论的化学概念教学。
一、基于元认知理论的化学概念教学
1.元认知理论
元认知概念最早由美国心理学家弗拉维尔(Flavell)提出,其定义为“任何以认知过程与结果为对象的知识,任何调节认知过程的认知活动”,本质是人对自己认知活动的自我观察、自我意识、自我监控、自我反思和自我调节。[3]元认知觉察是人类使用元认知反过来影响思维和行为的思维策略的水平,主要包括元认知控制、元认知知识、元认知体验和元认知监控四个要素,其中元认知知识是个体长时记忆中贮存的一些陈述性、程序性及条件性知识。
2.基于元认知理论的化学概念教学
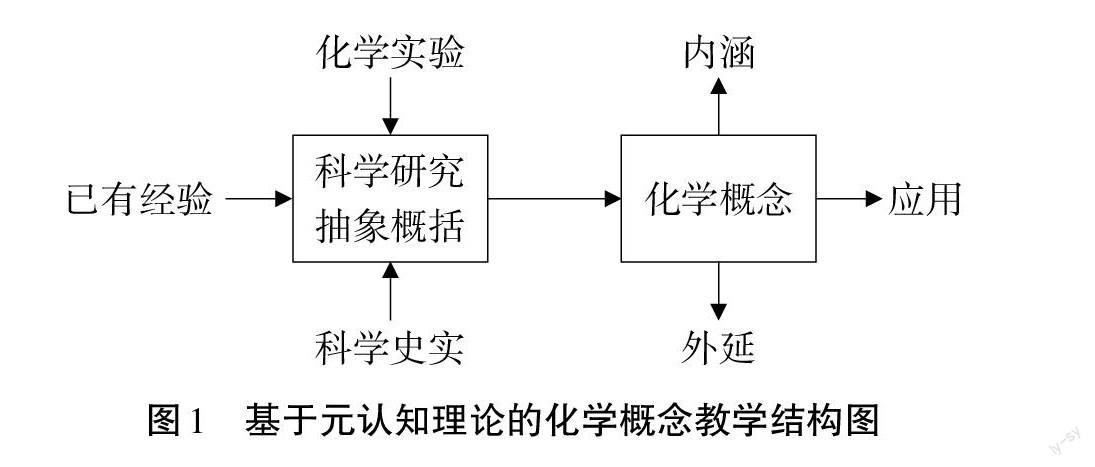
元认知是人类智力的核心组成,管理和组织人类的思维活动,是调整思维、改进思维结果的最有力的内部手段,它就像内心记者,具备行动迅速、来源可靠、提问准确、持续追踪、报道真实等特征。在化学概念教学中,用好元认知可以帮助学生更好地学习、理解和应用复杂的核心概念。经多次实践研究,笔者认为课堂中可以采用图1所示结构图进行化学概念教学,先结合学生的元认知知识,通过化学实验或化学史实等手段让学生在充分元认识体验、监控的基础上进行科学研究,经过分析、比较、抽象、概括等一系列的思维过程,初步形成化学概念,通过分析概念的关键词,研究化学概念的内涵和外延,再在应用概念解决实际问题和用思维导图或概念图梳理的过程中加以巩固。
二、关于化学键概念教学的优秀案例检索
化学键是高中化学必修教材中的一个较抽象的重要概念,学生在学习时往往难以理解。目前对化学键概念教学已经有了很多研究成果,其中部分优秀案例中关于化学键概念教学的主要流程如表1所示。
可以看出,绝大多数案例都是基于学生的能力素养进行设计。考虑到化学键的一致性,通过对比的方法展开离子键和共价键的教学,有一些还拓展延伸到金属键。这些做法从学生能力培养角度来看都是挺好的,但考虑到化学键中的概念本就比较抽象,一节课中还要同时学习2~3个类型的化学键,一方面可能会使部分学生学得不透彻,云里雾里,另一方面对于某些知识点的理解出现偏差。鉴于此,笔者觉得可以将该部分内容划分为两课时进行,第一课时重点研究离子键,第二课时重点研究共价键,并对比两种化学键异同点,可以通过实验方法和理论方法加以判断,这样处理可能更加符合学生的元认知。在教学时要考虑到学生的接受水平,所用的教学方法应“处于简化的最优水平”,既要保持尽可能的简单,同时又是科学正确的。学生如果能较好地理解离子键,那么对共价键也就不难理解了,所以第一课时的教学至关重要。
三、基于元认知理论的化学键概念教学
1.教学目标
(1)认识化学键的涵义。知道离子键的实质与形成过程,能用电子式对离子键进行表征。
(2)在离子键的概念建立和形成过程的探究教学中,培育“宏观辨识与微观探析”“证据推理与模型认知”等学科核心素养。
2.教学重点与难点
本节课的重点是离子键的实质与形成过程和用电子式对离子键进行表征。教学难点有两个,其一是受到NaCl化学式的影响学生潜意识认为1个Na+只能与1个Cl-形成离子键,其二是学生不能真正理解为什么NaCl晶体不导电,而熔化状态或溶于水时能导电,本节课通过模型帮助学生突破。
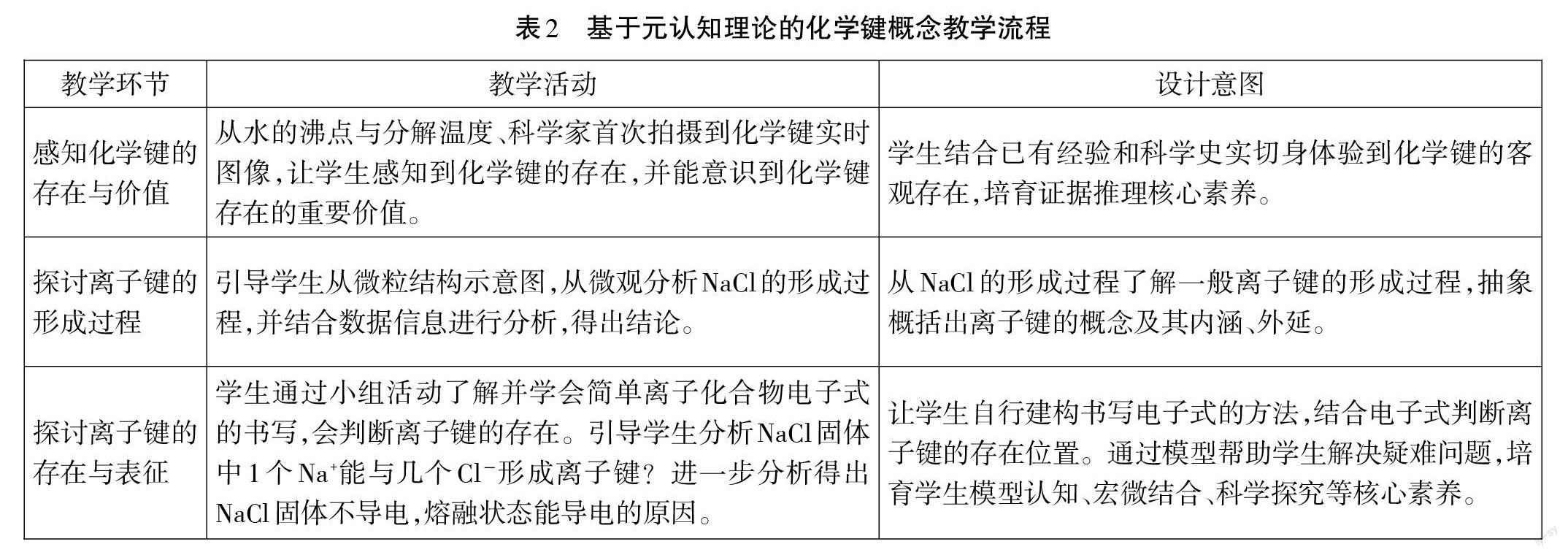
3.教学流程见表2。
4.教学实录
(1)感知化学键的存在与价值【演示】加热试管中的水至沸腾。
【问题】在这个过程中水分子有没有变化?从微观来看,什么发生了改变?
【学生】水分子没有变化,改变的是水分子间的距离。
【模型演示】移动吸在白板上的水分子磁吸的位置,直观感知水分子间的距离增大
【教师】从这个过程中可以看出,水分子与水分子之间的作用力比较小,熔沸点低。如果要使水加热分解,需加热到2200℃以上,这说明H原子与O原子结合得很牢固,应该有一种神奇的强大力量将它们紧密连在一起,这种相邻原子间强烈的相互作用就是我们今天要研究的化学键。键的本义是鼎上贯通两耳的横杠,起联结作用,所以化学键就是通过强烈相互作用将相邻原子联结起来。近年来化学家成功拍摄到化学键存在的实时图像。
【视频】科学家首次拍摄到化学键的振动、结合、断裂的实时图像。
【问题】视频中两个小黑点表示由两个铼原子构成的分子,结合视频你能得出哪些结论?
【学生1】分子是由原子构成的,分子和原子都在不停运动。
【学生2】原子之間是通过化学键联结,化学键很短(小于1nm)
【问题】如果没有化学键的世界将是怎样的?
【学生1】如果没有化学键,就没有氧气,没有食物吃,没有衣服穿。
【学生2】生物将不复存在,绝大多数物质也不存在。
(2)探讨离子键的形成过程
【教师】化学键是怎样形成的呢?下面我们以NaCl的形成为例进行分析。
【问题】结合Na原子和Cl原子的结构示意图,分析Na原子和Cl原子是如何聚集在一起形成NaCl的?
【学生】Na原子失电子变成Na+,Cl原子得电子变成Cl-,Na+与Cl-相互吸引形成NaCl。
【投影展示】见图2。
【追问2】Na+与Cl-能够无限靠近吗?
【学生】不能,因为Na+与Cl-之间除了吸引力外,还存在排斥力。
【追问3】哪些粒子间有排斥力?
【学生】Na+与Cl-的电子与电子之间,原子核和原子核之间都存在排斥力,所以Na+与Cl-不能够无限靠近。
【追问4】Na+与Cl-之间既有吸引力,又有排斥力,那什么时候就稳定了?
【学生】当吸引力和排斥力相等的时候。
【提供证据】见图3。
【问题】Na+与Cl-距离为R0时意味着什么?
【学生】吸引力和排斥力达到了平衡,体系的能量达到最低,形成了稳定的NaCl。
【问题】Na+与Cl-依靠静电作用“成功牵手”形成离子键,你能概括什么叫离子键吗?
【学生】阴阳离子之间通过强烈作用力形成的化学键。
【追问1】离子键存在于什么粒子之间?
【学生】阴阳离子之间
【追问2】阴阳离子之间一定形成离子键吗?
【学生】不一定,要达到合适距离
【追问3】离子键的实质是什么?
【学生】强烈的静电作用
(3)探讨离子键的存在与表征
【教师】由离子键构成的化合物叫做离子化合物。通常,活泼金属元素与活泼非金属元素组成的化合物属于离子化合物。
【投影展示】
阴离子静电作用构成化合物
【问题】刚才我们用图示形象地描述了钠原子与氯原子形成氯化钠的过程,在这个过程中与哪一层电子有关?
【学生】最外层电子。
【教师】这种表示太繁琐,可简化表示为
【任务】在元素符号周围用“●”或“×”来表示原子或离子最外层电子的式子叫做电子式。例如:
①原子·Mg·、··、··
②金属阳离子Na+、Mg2+、Al3+
③阴离子
④离子化合物
(1)分析上述电子式的书写特点或规律,在小组内交流。
(2)分别写出KCl、CaF2、CaO、Na2O的电子式。
【点评提升】学生讨论交流后,展示书写的电子式,师生点评,并对照电子式请学生分析存在离子键,进一步明确离子键存在于阴阳离子之间。
【问题】1个Na+能与几个Cl-形成离子键呢?
【学生】1个。
【模型演示】用红色磁吸表示Na+,蓝色磁吸表示Cl-。结合离子键的形成过程分析,先放一个红色磁吸,引导学生分析得出,周围应吸引多个Cl-,只要空间允许,就能尽可能多地吸引异性离子。研究表明,1个Na+周围最多吸引6个Cl-形成离子键,但Cl-之间又要相互排斥(远离),会是一个什么形状呢?
【学生】平面正六边形。
【教师】要注意,这不是平面结构,而是三维空间结构,会是什么形状呢?
【学生】球形。
【教师】这个词说得好,6个Cl-在空间球面上最大化分布,如果将这6个Cl-用线段连接起来,会构成什么形状呢?
【模型演示】展示扎在一起的6个大小相同的气球,先有意将其变为不规则,再向上抛起,发现是一个正八面体形状,再用球棍模型演示。
【问题】1个Na+与6个Cl-形成离子键,那么1个Cl-与几个Na+形成离子键呢?
【学生】6个。
【模型演示】在由1个Na+、6个Cl-构成的正八面体球棍模型中的其中一个Cl-的球上再连接5个Na+。通过旋转中间的键,让学生感知离子的位置关系。
【问题】你觉得是方方正正的结构稳定呢,还是稍稍错开些稳定呢?
【学生1】错开些稳定,因为这样离子间距离大。
【学生2】方方正正的结构稳定,因为Na+与Cl-异性相吸,而Cl-与Cl-同性相斥,所以Na+与Cl-距离要相对较小,而Cl-与Cl-距离要相对较大。
【教师】从引力和斥力角度就可以正确分析。Na+与Cl-就通过这样的方式向外延伸,你能脑补一下空间排布形状吗?
【提供证据】X射线衍射实验证实的Na+和Cl-在空间的排列方式。
【问题】NaCl固体中有没有单独的NaCl分子?
【学生】没有。
【教师】NaCl只是化学式,表示Na+与Cl-数目最简整数比。
【问题】现在你能解释为何NaCl固体不导电,熔融状态能导电吗?
【学生】因为NaCl固体中,Na+与Cl-通过离子键紧密结合,不能自由移动,而熔融状态时Na+与Cl-之间的距离变大,破坏了离子键,Na+与Cl-可以自由移动。
【教师】化学上常通过熔融状态下是否导电来判断某化合物是否属于离子化合物。今天课堂开始提到的水分子中H与O之间是通过什么化学键联结起来的呢?我们下节课将继续研究。
在运用元认知理论进行化学概念教学时,教师要挖掘概念的价值,从而激发学习这个概念的深厚兴趣,充分了解学生的元认知知识,通过创设基于客观事实的真实问题情境,引发学生思考,诱导学生在探究过程中调动元认知体验和监控,积极参与化学概念的构建与抽象概括,进一步分析概念的内涵与外延,利用思維导图或概念图寻找新旧概念之间的联系,真正理解概念,再应用所学知识解决实际问题,巩固概念。
参考文献
[1]谢泽琛,钱扬义.国内“化学概念教学”研究新进展[J].化学教育,2004(10):58-61.
[2]倪娟.论基于学科观念的化学概念教学[J].化学教育,2014(1):1-2.
[3]林光完,王存宽.基于元认知理论的化学键概念应用问卷开发[J].化学教育,2017(1):27-29.
[4]相佃国.到底该怎样进行化学概念课教学[J].化学教育,2011(11):13-15.
[5]杭伟华.“观念建构”视角下的“化学键”教学设计[J].化学教学,2016(12):45-47.
[6]保志明.证据推理与模型认知:“化学键”的教学与思考[J].中学化学教学参考,2018(7):16-19.
[7]曾应超.“素养为本”的化学教学设计研究[J].化学教学,2018(4):36-39.
[8]马欣怡,沈甸.从静电作用探讨化学键的本质及其教学实践[J].化学教育,2019(5):37-39.
[9]李晓明,叶跃娟.凸显“本质—联系—证据推理”的离子键与共价键教学[J].化学教育,2021(5):34-39.
