吴茱萸碱磷脂复合物自乳化药物递送系统的制备、表征及胃黏膜渗透性研究
2022-05-17宋朔尧杨贵前陶玲沈祥春张环李和蓉王守莉石惠云刘文
宋朔尧 杨贵前 陶玲 沈祥春 张环 李和蓉 王守莉 石惠云 刘文







中圖分类号 R944 文献标志码 A 文章编号 1001-0408(2022)09-1056-06
DOI 10.6039/j.issn.1001-0408.2022.09.06
摘 要 目的 制备吴茱萸碱磷脂复合物自乳化药物递送系统(EVO-PC-SMEDDS),并对其进行表征及胃黏膜渗透性考察。方法 制备EVO-PC-SMEDDS,检测其粒径、多分散系数(PDI)和Zeta电位,并进行显微观察。考察该制剂在不同pH(1.2、2.0、4.0、7.0)模拟胃液中的稳定性。测定该制剂的包封率和载药量,并进行体外释放考察。将大鼠胃黏膜组织和尤斯灌流室技术相结合,考察该制剂的胃黏膜渗透性。结果 EVO-PC-SMEDDS的粒径为(53.63±1.51) nm、PDI为0.217±0.017、Zeta电位为(-12.20±0.15) mV、包封率为(95.25±0.97)%、载药量为(19.30±1.21) mg/g。在透射电子显微镜下,EVO-PC-SMEDDS呈大小均匀的类球形乳滴。稳定性实验结果显示,EVO-PC-SMEDDS在不同pH的模拟胃液中,粒径、PDI、Zeta电位均无明显变化,稳定性良好。体外释放实验结果显示,与吴茱萸碱(EVO)原料药比较,EVO-PC-SMEDDS的体外累积释放率提高了6.83倍,符合一级动力学释放模型。胃黏膜渗透性实验结果显示,EVO-PC-SMEDDS的累积渗透转运量、渗透速率、渗透通量及累积渗透曲线下面积均高于EVO原料药。结论 本研究成功制得EVO-PC-SMEDDS,且该制剂稳定性良好,可明显改善EVO的体外释放行为和胃黏膜渗透性。
关键词 自乳化药物递送系统;吴茱萸碱;表征;胃黏膜;释放
Preparation,characterization and gastric mucosal permeability of evodiamine phospholipid complex self- microemulsifying drug delivery system
SONG Shuoyao1,2,YANG Guiqian1,2,TAO Ling1,2,SHEN Xiangchun1,2,ZHANG Huan1,2,LI Herong1,2,WANG Shouli1,2,SHI Huiyun1,2,LIU Wen1(1. School of Pharmacy,Guizhou Medical University,Guiyang 550025,China;2. Guizhou Province Key Laboratory for Optimal Utilization of Natural Medicine Resources, Guiyang 550025, China)
ABSTRACT OBJECTIVE To prepare and characterize evodiamine phospholipid complex self-microemulsifying drug delivery system (EVO-PC-SMEDDS), and to investigate its gastric mucosal permeability. METHODS EVO-PC-SMEDDS was prepared, and particle size, polydispersity (PDI) and Zeta potential were tested,and microscopic observation was carried out. The stability of EVO-PC-SMEDDS in simulated gastric liquid with different pH (1.2, 2.0, 4.0, 7.0) was investigated. The entrapment efficiency and drug-loading amount of the preparation were determined, and the in vitro release was investigated. The gastric mucosal permeability of EVO-PC-SMEDDS was studied by combining rat gastric mucosal tissue and Ussing Chamber technology. RESULTS The particle size of EVO-PC-SMEDDS was (53.63±1.51) nm, PDI and Zeta potential were 0.217±0.017 and (-12.20±0.15) mV, entrapment efficiency was (95.25±0.97)% and drug-loading amount was (19.30±1.21) mg/g. EVO-PC- SMEDDS exhibited a uniformly dispersed round spherical shape under transmission electron microscope. Stability experiments showed that EVO-PC-SMEDDS exhibited no significant change in particle size,PDI and Zeta potential under the simulated gastric fluid with different pH and showed excellent stability. Results of in vitro release test showed that compared with evodiamine (EVO), in vitro accumulative release of EVO-PC-SMEDDS were enhanced 6.83-fold, which was in line with the first-order kinetic release model. Results of gastric mucosal permeability showed that gastric mucosal permeation transport,permeation rate,permeation flux and area under curve of cumulative permeability of EVO-PC-SMEDDS were higher than those of EVO,respectively. CONCLUSIONS EVO-PC-SMEDDS is prepared successfully and shows good stability. It could significantly improve the release behavior and gastric mucosal permeability of EVO.
KEYWORDS self-microemulsifying drug delivery system;evodiamine; characterization; gastric mucosal; release
口服递送给药是治疗慢性胃炎、胃溃疡和胃癌等胃部疾病最有效的给药方式。但患者年龄、胃部结构、给药时间等因素会影响胃酸分泌,引起胃液酸度波动,导致药物的胃内稳定性差[1]。此外,胃黏膜屏障也会阻碍药物渗透,减少药物在胃部病灶部位的富集[2]。因此,在复杂的胃内环境中,药物常规剂型的治疗效果往往不太理想。
吴茱萸碱(evodiamine,EVO)是从中藥吴茱萸中提取分离出来的吲哚生物碱,也是治疗“肝火犯胃证”的经典名方左金丸的药效物质基础之一[3]。现代药理研究表明,EVO具有镇痛抗炎、抗菌、抗肿瘤、抗胃溃疡、保护胃黏膜等多重药理活性,尤其对胃部疾病的治疗效果显著;但其水溶性极差,口服生物利用度低,体内消除迅速,按生物药剂学分类系统(biopharmaceutics classification system,BCS)分类属于Ⅳ类药物(即低溶解度、低渗透性类药物)[4]。
自乳化药物递送系统(self-microemulsifying drug delivery system,SMEDDS)是由油相、乳化剂和助乳化剂组成的液体制剂,口服后经胃液分散可自发乳化形成粒径小于100 nm的乳滴,被广泛应用于BCS Ⅲ类和Ⅳ类药物的口服递送[5]。SMEDDS粒径小、吸收表面积大,且具有良好的黏膜渗透性和生物相容性,特别有利于药物的跨胃黏膜递送[6]。此外,SMEDDS的油相可提高难溶性药物的溶解度,并通过增强药物的旁路转运,避免首过效应[7]。研究表明,自乳化形成油水界面屏障可以保护药物免受胃酸的破坏,在增加药物稳定性的同时还可降低药物的刺激性,且SMEDDS可通过降低表面张力和改变上皮细胞连接紧密度来增加药物的膜渗透性[8]。相关研究发现,磷脂复合物(phospholipid complexes,PC)和SMEDDS中的脂质成分均与人消化道上皮细胞的细胞膜成分相似,因此,将PC和SMEDDS结合可进一步提高难溶性药物的稳定性、载药量和跨生物膜转运,减少药物的消除以延长作用时间并提高口服生物利用度[9-10]。因此,本研究拟制备吴茱萸碱磷脂复合物自乳化药物递送系统(EVO-PC-SMEDDS),并以粒径、多分散系数(polydispersity index,PDI)和Zeta电位为指标,评价其在胃内的稳定性及释放行为;另外,将大鼠胃黏膜组织和尤斯灌流室技术相结合[11-13],研究该制剂的胃黏膜渗透性,以期为胃部疾病治疗药物的开发提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括VWD/1260 Infinity ⅡPrime型液相色谱系统(美国Agilent公司)、Nano-brook 90Plus PALS型 Zeta电位及粒度分析仪(美国Brookhaven Instruments公司)、UPW-UP-10型纯水仪(四川成都天莘宁科技有限公司)、EO-CVUC型尤斯灌流系统(北京金工鸿泰科技有限公司)、ME104/02型电子天平(瑞士Mettler Toledo公司)、HB ECO S096型旋转蒸发仪(德国IKA公司)、JEM-1400PLUS型透射电子显微镜(日本JEOL公司)。
1.2 主要药品与试剂
本研究所用主要药品与试剂有15-羟基硬脂酸聚乙二醇酯(HS15,德国BASF公司,批号20189322),聚山梨酯80(国药集团化学试剂有限公司,批号20191211),油酸乙酯、卵磷脂(上海阿拉丁生化科技股份有限公司,批号分别为G1508008、20195724),EVO原料药(成都德思特生物技术有限公司,质量分数≥98%,批号2018061321),EVO对照品(中国食品药品检定研究院,批号110802-201606,纯度99.6%),甲醇(美国TEDIA公司,色谱级);其余试剂为实验室常用规格,水为双蒸水。
1.3 动物
本研究所用动物为SPF级雄性SD大鼠,体质量(200±20) g,由贵州医科大学动物中心提供,实验动物生产许可证号为SCXK(黔)2021-0021。本研究动物实验方案经贵州医科大学动物伦理委员会批准通过(编号1900154)。
2 方法与结果
2.1 EVO-PC-SMEDDS的制备
2.1.1 EVO-PC的制备 在实验室前期研究和已有的文献基础上进行改进,采用溶剂挥发法制备EVO-PC[14-15]。将2.0 g EVO原料药与2.0 g 卵磷脂置于50 mL乙醇-四氢呋喃(1 ∶ 1,V/V)混合有机溶液中进行复合反应,反应温度为55 ℃,时间为3 h;反应结束后,采用旋转蒸发仪减压回收有机溶剂,并将残余混合物于真空条件下冷冻干燥48 h;将干燥后的混合物加入150 mL氯仿中复溶,直至其完全溶解,再抽滤过0.22 μm有机膜以去除未复合的杂质;所得滤液采用旋转蒸发仪减压回收氯仿,再于真空条件下冷冻干燥48 h,即得EVO-PC。本研究所制EVO-PC的外观均匀,复合率为95.8%;于-20 ℃条件下保存30 d后再次复溶,亦无沉淀析出,表明EVO-PC的稳定性良好。
2.1.2 EVO-PC-SMEDDS的制备 根据实验室前期研究优化后的处方[16],固定SMEDDS总质量为1 g,其中油酸乙酯25%(油相),聚山梨酯80和HS15组成的混合乳化剂(两者质量比为2 ∶ 1)55%,无水乙醇(助乳化剂)20%。然后将EVO-PC(总质量40 mg)加入SMEDDS中,超声(功率300 W,频率40 kHz,下同)30 min助溶,再置于37 ℃水浴条件下搅拌,直至获得稳定的透明液体,即得EVO-PC-SMEDDS。本研究所制EVO-PC-SEDDS的外观澄清透明,略带淡蓝色乳光;于室温条件下放置7 d后,仍无沉淀、转相和浑浊现象,表明EVO-PC- SMEDDS的稳定性良好。
2.2 EVO-PC-SMEDDS的表征
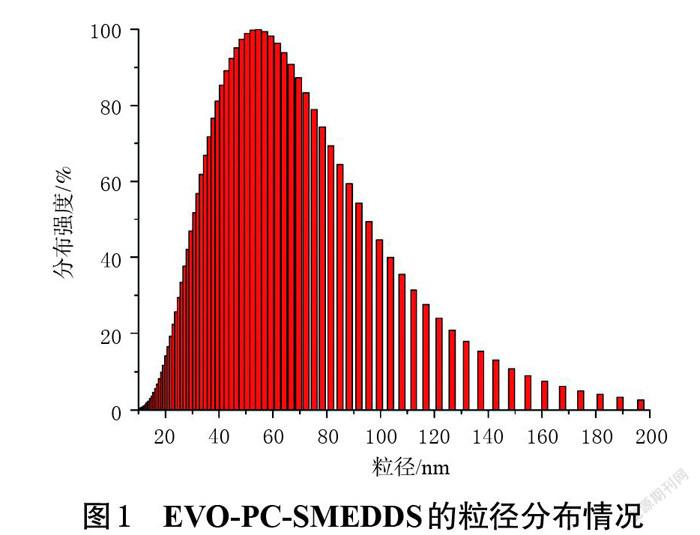
2.2.1 EVO-PC-SMEDDS的粒径及Zeta电位 取适量EVO-PC-SMEDDS加水稀释100倍,使用Zeta电位及粒度分析仪测定其粒径及Zeta电位,实验平行3次。结果显示,EVO-PC-SMEDDS粒径分布均匀,粒径为(53.63±1.51) nm,RSD为1.25%(n=3);PDI为0.217±0.017,RSD为2.06%(n=3);Zeta电位为(-12.20±0.15)mV,RSD为1.38%(n=3)。EVO-PC-SMEDDS的粒径分布情况见图1。
2.2.2 EVO-PC-SMEDDS的顯微观察 取适量EVO- PC-SMEDDS置于铜网上,加入5%磷钨酸溶液染色5 min,风干后置于透射电子显微镜下观察。结果显示,EVO-PC-SMEDDS为大小均匀的类球形乳滴,详见图2。
2.3 EVO-PC-SMEDDS的胃内稳定性考察
将EVO-PC-SMEDDS分散于不同pH(pH值根据人胃酸的动态变化范围设置[11-13])的模拟胃液中,以考察其在胃内的稳定性。具体方法如下:称取胃蛋白酶3.2 g、NaCl 2.0 g溶于1 000 mL水中,平行制备4份,分别使用盐酸调节pH为1.2、2.0、4.0、7.0,即得不同pH的模拟胃液。将“2.1.2”项下制得的EVO-PC-SMEDDS分散于上述模拟胃液中,室温静置24 h后,采用Zeta电位及粒度分析仪分析其粒径、PDI、Zeta电位的变化情况,实验平行3次。结果显示,EVO-PC-SMEDDS在模拟胃液中粒径为50.12~58.08 nm,PDI为0.220~0.250,Zeta电位为-16.43~-11.98 mV。由此可知,EVO-PC-SMEDDS在不同pH的模拟胃液中,粒径、PDI和Zeta电位均无显著变化。结果见图3、图4。
2.4 EVO-PC-SMEDDS的包封率、载药量和体外释放考察
2.4.1 色谱条件 色谱柱为Agilent ZORBAX XDB-C18(250 mm×4.6 mm,5 μm);流动相为甲醇-水(75 ∶ 25, V/V);检测波长为225 nm;流速为1.0 mL/min;柱温为30 ℃;进样量为20 μL[17]。
2.4.2 溶液的制备 (1)对照品溶液:精密称取EVO对照品10.0 mg,置于50 mL量瓶中,以甲醇溶解并定容,即得EVO质量浓度为200 μg/mL的对照品溶液。(2)供试品溶液:取EVO-PC-SMEDDS适量,置于10 mL量瓶中,加入适量甲醇超声破乳并定容,过0.22 μm微孔滤膜后,即得供试品溶液。
2.4.3 标准曲线的绘制 精密量取“2.4.2”项下对照品溶液适量,以甲醇稀释定容,分别制成EVO质量浓度为0.4、1.0、2.0、5.0、10.0、20.0 μg/mL的系列溶液,然后按“2.4.1”项下色谱条件进样分析。以峰面积为纵坐标(y)、EVO质量浓度为横坐标(x),进行线性回归,得回归方程y=102.31x-11.52(R2=0.999 9),EVO的检测质量浓度线性范围为0.4~20.0 μg/mL。
2.4.4 精密度试验 精密量取“2.4.3”项下质量浓度为0.4、5.0、20 μg/mL的EVO对照品溶液适量,每个样品分别连续进样6次,按“2.4.1”项下色谱条件进样分析,计算日内精密度RSD;重复操作2 d,计算日间精密度RSD。结果显示,上述3种样品中EVO峰面积的日内精密度和日间精密度的RSD均小于2%(n=6),表明该方法精密度良好。
2.4.5 重复性试验 精密量取同一批次的EVO-PC- SMEDDS适量,按“2.4.2”项下方法平行制备6份供试品溶液,按“2.4.1”项下色谱条件进样分析,记录峰面积,并根据标准曲线计算EVO含量。结果显示,EVO-PC- SMEDDS中EVO的平均含量为196.4 μg/mL,RSD为0.72%(n=6),表明该方法的重复性良好。
2.4.6 稳定性试验 精密量取“2.4.2”项下供试品溶液适量,于室温放置0、2、6、8、12、24、36、48 h后,按“2.4.1”项下色谱条件进样分析,记录峰面积。结果显示,EVO峰面积的RSD均小于2%(n=8),表明供试品溶液在室温放置48 h内的稳定性良好。
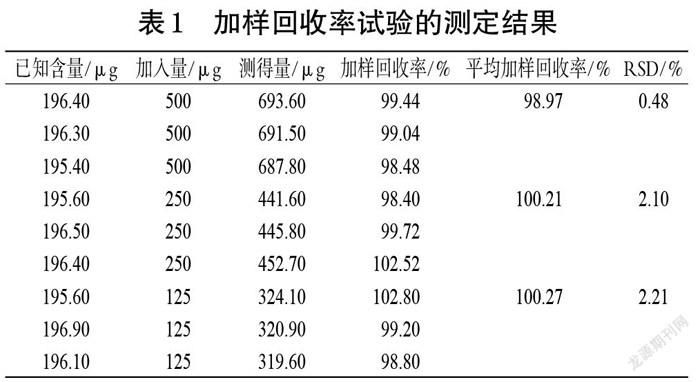
2.4.7 加样回收率试验 精密量取“2.4.2”项下已知EVO含量的供试品溶液,共9份,置于50 mL量瓶中,分为3组;每组分别加入“2.4.2”项下EVO对照品溶液 2.5、1.25、0.625 mL,然后加甲醇定容,按“2.4.1”项下色谱条件进样分析,并计算加样回收率。结果显示,EVO的平均加样回收率为98.97%~100.27%,RSD为0.48%~2.21%(n=3),结果见表1。
2.4.8 EVO-PC-SMEDDS载药量和包封率的测定 采用超滤离心法测定EVO-PC-SMEDDS的载药量和包封率[18]。分别精密量取EVO-PC-SMEDD 1 mL于超滤管内(截留相对分子质量为50 000 Da),以3 500 r/min离心30 min,取超滤液,按“2.4.1”项下色谱条件进样分析,并计算EVO的含量(Wfree)。另取EVO-PC-SMEDDS适量,置于10 mL量瓶中,加适量甲醇超声破乳并定容,再按“2.4.1”项下色谱条件进样分析,计算EVO的含量(Wadd)。根据公式计算EVO-PC-SMEDDS的载药量和包封率。其中,包封率(%)=(Wadd-Wfree)/Wadd×100,载药量(%)=(Wadd-Wfree)/Wall×100(Wall表示EVO-PC-SMEDDS的总质量)。结果显示,EVO-PC-SMEDDS的载药量为(19.30±1.21) mg/g,包封率为(95.25±0.97)%。
2.4.9 EVO-PC-SMEDDS的体外释放考察 以0.1 mol/L盐酸溶液为释放介质,采用动态透析法进行EVO-PC- SMEDDS体外释放考察[19]。取EVO原料药适量,以空白释放介质制成EVO混悬液。分别取EVO混悬液和EVO-PC-SMEDDS适量(EVO含量均为2 mg),置于透析袋(截留相对分子质量为35 000 Da)中,两端扎紧;然后分别置于100倍体积的释放介质中(加入10%无水乙醇助溶),于37.0 ℃、100 r/min恒温振荡器中振荡0、1、2、4、6、8、16、24、48 h后取样(同时补充同温等量的释放介质)。将取样液过0.22 μm微孔滤膜,取续滤液按“2.4.1”项下色谱条件进样分析,根据标准曲线计算EVO的含量,并计算累积释放率,绘制累积释放曲线(见图5);利用Origin 9.0软件拟合EVO-PC-SMEDDS的体外释放模型(见表2)。
由图5可知,与EVO原料药相比,EVO-PC- SMEDDS的体外累积释放率提高了6.83倍;EVO-PC- SMEDDS在4 h时的累积释放率为80.16%,远高于EVO原料药(累积释放率为14.56%)。由表2可知,EVO- PC-SMEDDS一级动力学释放模型的R2值为0.975 2,相较于其他模型,其拟合度更好、可信度更高。这提示该制剂在胃液中的释放更符合一级动力学模型。
2.5 EVO-PC-SMEDDS体外胃黏膜渗透性实验
2.5.1 胃黏膜渗透装置的构建 实验前将3只大鼠禁食不禁水12 h,用异氟烷麻醉后处死,取出胃,并沿外侧胃大弯剖开,收集胃内容物;将胃内侧朝上展开固定在手术台上,用37 ℃生理盐水清洗干净后,先向胃黏膜层浅层带与胃肌固有层中间注射适量生理盐水(以形成水垫,便于两层剥离),再用微型手术刀分离得到大鼠胃黏膜层。将大鼠胃黏膜层无缝隙地嵌入夹片中,插入尤斯灌流室的中间槽,备用。另外,将上述胃内容物置于离心管中,以2 000 r/min离心10 min,取上清液,备用。
2.5.2 体外胃黏膜渗透性实验 分别在尤斯灌流室的供体室和接受室中加入胃内容物上清液与磷酸盐缓冲液的混合溶液(体积比为1 ∶ 1)10 mL作为释放介质,并加入10%无水乙醇助溶;将温度维持在37 ℃,以模拟胃内环境。将两室通入95%O2和5%CO2混合气体以模拟胃蠕动,平衡后,在供体室中分别加入EVO原料药混悬液和EVO-PC-SMEDDS溶液(EVO含量均为0.2 mg);于1、2、4、6、8 h时,在接收室中取1 mL样品(同时补充同温等量介质),置于10 mL量瓶中,加适量甲醇超声溶解并定容,再按“2.4.1”项下色谱条件进样分析,计算各时间点的药物质量浓度(Cn)。按公式(1)(2)(3)分别计算EVO的胃黏膜累积渗透转运量(Qn)、渗透通量(F)和渗透速率(S),并利用Origin 9.0软件计算EVO的累积渗透曲线下面积(AUC0-8 h)[20-21]。
Qn=(10Cn+[∑][i=1][n-1]Ci)/A…(1)
F=Qn/h…(2)
S=(10Cn+[∑][i=1][n-1]Ci)/h…(3)
上述公式中,Cn为第n个取样时间点的药物质量浓度(μg/mL),Ci为第i个取样时间点的药物质量浓度(μg/mL),A为胃黏膜通过面积(本研究取1.25 cm2)。
结果如图6A所示,EVO-PC-SMEDDS 8 h的Qn为106.33 μg/cm2,远高于EVO原料药的28.93 μg/cm2。图6B显示,EVO-PC-SMEDDS的S在2 h时即到达最高点(27.12 μg/h),为EVO原料药的11.4倍。此外,EVO- PC-SMEDDS的F和AUC0-8 h分别为12.69 µg/(cm2·h)和24.30 µg·h/mL,为EVO原料药的7.01倍和3.64倍。由此可知,EVO-PC-SMEDDS具有较高的胃黏膜渗透速率,提示该制剂可增加EVO在胃部的吸收。
3 讨论
片剂、胶囊剂等常规剂型受胃酸、胃黏膜屏障以及胃排空效应的影响,故而对胃部疾病治疗药物的递送作用有限[22]。同时,常见的胃部疾病治疗药物(如胃黏膜保护剂、抑酸剂和抗幽门螺杆菌药物等)也存在体内非特异性分布、溶解度低和生物利用度差等问题[23]。SMEDDS由于粒径小、生物相容性好以及黏膜渗透性强,從而具备增强药物治疗效果的潜力[6]。
本研究在前期研究的基础上,将磷脂复合物与自乳化技术相结合,制得EVO-PC-SMEDDS,从而克服了EVO溶解度低的缺点。EVO-PC-SMEDDS的粒径为(53.63±1.51) nm、PDI为0.217±0.017、Zeta电位为 (-12.20±0.15)mV;进一步显微观察发现,该制剂为大小均匀的类球形乳滴。以粒径、PDI和Zeta电位为评价指标,考察该制剂的稳定性,结果发现,EVO-PC- SMEDDS在不同pH模拟胃液中粒径、Zeta 电位和PDI均无显著变化,这表明该制剂可在胃内均匀分散,且能保持结构稳定。
由于EVO是水溶性极差的药物,因此进行EVO- PC-SMEDDS体外释放考察时,在释放介质中加入10%乙醇来助溶。结果显示,EVO-PC-SMEDDS的体外累积释放率远高于EVO原料药,这表明该制剂可改善EVO的溶解性。
胃黏膜屏障是胃部疾病特异性递送的难题之一,通过功能化的递送材料来提高药物的胃黏膜渗透能力,是实现胃部深层病灶靶向递药的有效手段[24]。本研究将大鼠胃黏膜组织和尤斯灌流室技术相结合,建立了EVO-PC-SMEDDS体外胃黏膜渗透转运模型。结果显示,EVO-PC-SMEDDS的胃黏膜Qn、F、S和AUC0-8 h均高于EVO原料药,具有较强的胃黏膜渗透能力。
综上所述,本研究成功制得了EVO-PC-SMEDDS;该制剂稳定性较好,可明显改善EVO的释放行为和胃黏膜渗透性。
参考文献
[ 1 ] CAI X Q,XU Y T,ZHAO L N,et al. In situ pepsin-assis- ted needle assembly of magnetic-graphitic-nanocapsules for enhanced gastric retention and mucus penetration[J]. Nano Today,2021,36:101032.
[ 2 ] ANGEL L,FRANCIS K C. Peptic ulcer disease[J]. The Lancet,2017,390(10094):613-624.
[ 3 ] 李艳英,黄能听,韩馥蔓,等.左金丸的古代文献分析[J/OL].中国实验方剂学杂志,2022[2022-03-22]. https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CAPJ&dbname= CAPJLAST&filename=ZSFX20210811000&uniplatform=NZKPT&v=ZoxzmtHRskyq5dwUEd9F87v9kzHgqxHsyR_ QNqlUnOpm_zF56DXOOqHt95Ol0ZFM. DOI:10.13422/j.cnki.syfjx.20211854.
[ 4 ] SUN Q,XIE L,SONG J W,et al. Evodiamine:a review of its pharmacology,toxicity,pharmacokinetics and preparation researches[J]. J Ethnopharmacol,2020,262:113164.
[ 5 ] MAHMOOD A,BERNKOP-SCHNÜRCH A. SEDDS:a game changing approach for the oral administration of hydrophilic macromolecular drugs[J]. Adv Drug Deliv Rev,2019,142:91-101.
[ 6 ] ABDULKARIM M,SHARMA P K,GUMBLETON M. Self-emulsifying drug delivery system:mucus permeation and innovative quantification technologies[J]. Adv Drug Deliv Rev,2019,142:62-74.
[ 7 ] 马巧芳,曾佳,沙康,等.口服自微乳给药系统的研究进展[J].药学进展,2020,44(6):466-475.
[ 8 ] XIA F,CHEN Z J,ZHU Q G,et al. Gastrointestinal lipolysis and trans-epithelial transport of SMEDDS via oral route[J]. Acta Pharm Sin B,2021,11(4):1010-1020.
[ 9 ] NOURAEI M,COLLYMORE C,DIOSADY L,et al. HLD-NAC design and evaluation of a fully dilutable lecithin-linker SMEDDS for ibuprofen[J]. Int J Pharm,2021,610:121237.
[10] WU H Y,LONG X Y,YUAN F,et al. Combined use of phospholipid complexes and self-emulsifying microemulsions for improving the oral absorption of a BCS class Ⅳ compound,baicalin[J]. Acta Pharm Sin B,2014,4(3):217-226.
[11] MAMADOU G,CHARRUEAU C,DAIROU J,et al. Increased intestinal permeation and modulation of presystemic metabolism of resveratrol formulated into self-emulsifying drug delivery systems[J]. Int J Pharm,2017,521(1/2):150-155.
[12] BABADI D,DADASHZADEH S,OSOULI M,et al. Nanoformulation strategies for improving intestinal permeability of drugs:a more precise look at permeability assessment methods and pharmacokinetic properties changes
[J]. J Control Release,2020,321:669-709.
[13] 胡詠梅,张珊珊,张磊,等. Ussing chamber技术评价P-糖蛋白及有机阳离子转运体对左氧氟沙星跨胃黏膜转运的影响[J].中国临床药理学杂志,2015,31(17):1732- 1735.
[14] 柳珊,谭群友,王红,等.吴茱萸碱磷脂复合物的制备、表征及体外抗肿瘤活性的研究[J].中国药学杂志,2012,47(7):517-523.
[15] 王益,李婉蓉,杨佳佳,等.氧化苦参碱磷脂复合物自乳化释药系统的研制[J].中草药,2018,49(18):4277-4283.
[16] JIANG F,WU G P,LI W R,et al. Preparation and protective effects of 1,8-cineole-loaded self-microemulsifying drug delivery system on lipopolysaccharide-induced endothelial injury in mice[J]. Eur J Pharm Sci,2019,127:14-23.
[17] 杨婕,刘宏明,陈云,等.吴茱萸碱脂质纳米粒的药代动力学和在体肠吸收特性研究[J].中国药科大学学报,2020,51(6):696-701.
[18] TIMUR S S,YÖYEN-ERMIŞ D,ESENDAĞLI G,et al. Efficacy of a novel LyP-1-containing self-microemulsi- fying drug delivery system(SMEDDS)for active targeting to breast cancer[J]. Eur J Pharm Biopharm,2019,136:138-146.
[19] 杨佳佳,韦世权,李婉蓉,等.星点设计-效应面法优化丹皮酚脂微球处方工艺及其体外释药机制研究[J].中草药,2020,51(15):3901-3910.
[20] 陈蓓,文丽梅,巩月红,等.基于Ussing Chamber技术评价阿苯达唑纳米晶体在大鼠不同肠段的吸收特性[J].中国医院药学杂志,2021,41(12):1192-1196.
[21] 朱蕴,顾星,张兵,等.基于尤斯灌流室技术的泽泻汤大鼠肠吸收研究[J].天津中医药大学学报,2017,36(4):299- 302.
[22] ALEXANDER A,AJAZUDDIN,PATEL R J,et al. Recent expansion of pharmaceutical nanotechnologies and targeting strategies in the field of phytopharmaceuticals for the delivery of herbal extracts and bioactives[J]. J Control Release,2016,241:110-124.
[23] YAN X M,HUANG Z C,WU Y Y,et al. Sequential loa- ding of inclusion complex/nanoparticles improves the gastric retention of Vladimiriae Radix essential oil to promote the protection of acute gastric mucosal injury[J]. Int J Pharm,2021,610:121234.
[24] O’NEIL D H R,LEONARD A. Gastric disorders:modifications of gastric content,antacids and drugs influencing gastric secretions and motility[J]. Anaesth Intensive Care Med,2012,13(2):67-70.
(收稿日期:2021-12-23 修回日期:2022-03-24)
(編辑:唐晓莲)
