过氧化物酶体增殖物激活受体PPAR在缺血性脑卒中作用的研究进展
2022-05-11吴玉佳高健美龚其海
吴玉佳,高健美,2,龚其海,2
(遵义医科大学1.基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室、2.药学院,贵州 遵义 563000)
脑卒中是临床上脑血管疾病中最常见的疾病之一,以猝然昏仆、口舌歪斜、半身不遂、语言不利为症,是由于脑部血管突然阻塞或破裂,导致血液不能进入大脑相应组织而引起的因缺血、缺氧导致的一类脑部疾病。根据发病原因的不同,脑卒中又分为缺血性脑卒中(ischemia stroke,IS)和出血性脑卒中两种,其中IS约占总发病人数的80%~85%[1]。IS具有高发病率、高致死率及高致残率的特点,严重影响患者的生活质量,给患者的家庭和整个社会带来了沉重的负担[2]。我国在IS的发生率及其引发的疾病负担方面位居全球第一位,其基本病理生理过程是脑缺血。目前治疗IS最有效的措施是及时恢复缺血区域的血供。然而,临床和实验研究均发现,缺血区恢复血供后可继发脑缺血/再灌注损伤、脑水肿和出血转化等多种病理学表现[3]。IS作用机制复杂,主要涉及神经炎症、细胞凋亡、氧化应激损伤等密切相关。因此,阐明IS的作用机制,寻找新的治疗靶点和药物对防治缺血性卒中具有重要意义。
过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARs)是核受体超家族中的配体激活转录因子,主要包括α、β、γ三种亚型,具有调节糖代谢和脂质代谢、抑制炎症和氧化应激损伤的作用。PPARs是依赖配体的转录因子,可通过与调节基因增强子中的特定过氧化物酶体增殖物应答元件结合来调节靶基因的表达。在与激动剂结合时,PPAR的构象被改变,从而产生转录共激活因子的募集,导致基因转录的增加[4]。最近研究发现,PPARs不仅在糖尿病的病理发生发展中发挥重要作用,在缺血性脑卒中的发生发展中也发挥关键作用。因此,本文综述国、内外关于PPARs在IS中的作用及其可能的神经保护作用机制,旨在为阐明缺血性脑卒中的病理机制,寻找防治缺血性脑卒中的作用新靶点提供线索和依据。
1 PPARs通过抑制神经炎症发挥抗IS的作用
神经炎症是IS的核心机制之一,主要表现为脑内的胶质细胞过度激活释放大量促炎症因子,从而产生细胞毒性[5]。因此,抑制神经炎症反应是治疗IS的重要策略之一。
体内实验研究结果显示,采用大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)法导致的IS大鼠模型脑中小胶质细胞和星形胶质细胞被激活,导致促炎症因子释放增加,如白介素(interleukin,IL)-1β和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α);同时减少抗炎症因子的释放,如趋化因子(chemokine CXC ligand,CXCL)-9、CXCL-10、IL-4等[6]。此外,PPARα、PPARβ、PPARγ表达均明显降低。PPARα激动剂油酸乙醇胺能够明显抑制星形胶质细胞激活和胶质瘢痕形成,进而发挥抗IS神经炎症发挥的作用[7]。而PPARγ激动剂米非司酮、叶黄素苷、吡格列酮能够明显升高MCAO大鼠模型脑内PPARγ的蛋白表达,进而降低TNF-α、IL-1β和IL-6等促炎因子的水平发挥抗IS的作用[8]。值得注意的是,PPARα/γ双重激动剂GW0742明显增加PPARα、PPARγ蛋白表达且减少促炎症因子释放,增加抗炎症因子的水平发挥抗IS的作用,其作用机制可能与下调Toll样受体/核因子-κB(nuclear factor-κB,NF-κB)信号转导通路、调节基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)和金属蛋白酶的组织抑制剂-1蛋白之间的平衡有关[9]。有趣的是,PPARα激动剂非诺贝特预处理仅可改善MCAO雄性小鼠的神经功能并上调CD8+调节性T细胞,而对MCAO雌性小鼠的神经功能无改善作用,并下调CD4+调节性T细胞。PPARα基因敲除(knock out,KO)雄性小鼠较PPARα KO雌性小鼠促炎症因子基因表达增加[10]。
体外研究实验结果显示,脂多糖(lipopolysaccharide,LPS)明显增加小鼠巨噬细胞RAW264.7炎症因子表达并降低PPARα、PPARγ蛋白表达。PPARα激动剂WY14643能够明显增加PPARα并降低TNF-α、IL-1β、IL-6、CXCL-1和CXCL-10的水平发挥抑制炎症反应的作用[11]。在氧糖剥夺再灌注(oxygen and glucose deprivation/reperfusion,OGD/R)模拟IS的小鼠巨噬细胞RAW264.7中,PPARα、PPARγ、促炎因子诱导性一氧化氮合酶、IL-6、TNF-α、γ-干扰素、高迁移率族蛋白B-1(high mobility group protein B-1,HMGB-1)的表达均升高。阿托伐他汀、罗格列酮作用后,PPARγ表达升高,抑制了OGD/R诱导促炎因子的表达[12]。PPARγ激动剂银杏内酯B的衍生物作用后可以调节微胶质细胞从促炎表型分化为抗炎表型,发挥抗炎作用。PPARα/γ双重激动剂阿格列扎能够抑制小胶质细胞活化进而减少促炎性细胞因子的合成、释放、迁移发挥抑制炎症反应的作用[13]。
以上研究结果显示,PPARs能够减少促炎因子的释放、增加抗炎因子的生成,发挥抗IS神经炎症的作用。
2 PPARs通过抑制神经细胞凋亡发挥抗IS的作用
凋亡是机体自主程序性死亡主要方式之一,在机体发育过程中维持机体稳态。IS后,自由基的产生,线粒体损伤过程中细胞色素C的释放以及胱天蛋白酶的激活等死亡信号均可触发细胞凋亡[14]。抑制神经细胞凋亡是治疗IS的重要策略之一。
体内研究实验结果显示,采用缺氧缺血性脑损伤(hypoxic-ischemic brain injury,HIE)诱导建立的大鼠IS模型大脑中,PPARβ/δ的表达明显降低;而PPARβ/δ激动剂GW0742或腺病毒介导PPARβ/δ过表达能够明显增加HIE大鼠模型脑内PPARβ/δ蛋白表达,进而通过抑制凋亡信号调节激酶1/p38-丝裂原活化的蛋白激酶(mitogen activated protein kinase,MAPK)通路或NF-κB/MMP-9途径,进而抑制了脑水肿的形成发挥抗凋亡作用,且改善了IS后大鼠的神经缺陷,降低了BBB的通透性[15]。在采用MCAO法诱导建立的IS大鼠模型大脑中,PPARγ蛋白表达明显降低,而PPARγ激动剂罗格列酮能够通过调控HMGB-1/晚期糖基化终产物受体信号通路抑制细胞凋亡,进而缓解了缺血/缺氧引起的细胞焦亡,发挥抗IS作用[16]。PPARγ KO小鼠IS损伤较野生型严重,其脑中内质网应激蛋白、凋亡相关蛋白明显上调。而PPARα激动剂非诺贝特和和PPARγ激动剂吡格列酮联合治疗能够明显抑制凋亡发挥抗IS作用[17]。
体外研究实验结果显示,在OGD诱导建立的IS细胞模型中,半胱氨酸天冬氨酸蛋白酶(cysteinyl aspartate specific proteinase,caspase)-3,caspase-9等促凋亡蛋白明显增加;而Bcl-2、Bcl-xL等抗凋亡蛋白明显减少。同时,PPARγ表达明显降低。而PPARγ激动剂罗格列酮预处理或者PPARγ过表达均可通过抑制抑制细胞凋亡途径发挥抗IS作用[18]。
以上研究结果显示,PPARs能够通过调控caspase依赖的凋亡途径和内质网应激而抑制细胞凋亡发挥抗IS作用。
3 PPARs通过抑制氧化应激损伤发挥抗IS的作用
氧化应激是指机体在遭受各种有害刺激时,体内或细胞内活性氧(reactive oxygen species, ROS)的产生与抗氧化之间失衡,从而导致ROS在体内蓄积而引起细胞和组织的损伤。氧化应激与IS关系密切,减少神经细胞的氧化应激损伤亦是治疗IS的重要策略之一[19]。
体内研究结果显示,在MCAO诱导建立的IS大鼠模型脑中,ROS及产生ROS的NADPH氧化酶(NADPH oxidase, NOX)含量明显增加,而PPARγ、PPARα表达明显降低。PPARγ激动剂吡格列酮能够降低NOX含量、上调PPARγ蛋白表达,进而抑制神经元死亡发挥抗IS作用,PPARα激动剂法舒地尔能够升高过氧化物歧化酶(superoxide dismutase,SOD)的含量和PPARα的蛋白表达,进而抑制氧化应激损伤发挥抗IS作用。在MCAO诱导建立的IS大鼠模型中,内源性抗氧化酶如SOD、过氧化氢酶(catalase, CAT)明显减少,PPARγ表达明显降低;而PPARγ激动剂人参皂苷作用能够明显降低髓过氧化物酶活性,并提高抗氧化酶SOD和CAT的活力,进而发挥抗IS的作用[20]。
体外研究结果显示,在OGD诱导的神经细胞损伤中,ROS含量明显增加,PPARγ蛋白表达明显降低;而PPARγ过表达能够降低ROS含量并增加PPARγ表达,其作用可能与调控核因子E2相关因子2/抗氧化反应元件途径、NF-κB信号途径有关。在PPARγ特异性敲除的体外转染neuron 2a细胞系中,PPARγ基因敲除神经元损伤或缺失严重、内质网应激蛋白蛋白表达明显上调[21]。
以上研究结果显示,PPARs通过调控氧化应激通路抗发挥抗IS的作用。
4 PPARs通过抑制神经细胞自噬发挥抗IS的作用
自噬是指膜吞噬或包裹小胶质细胞和胞质大分子以形成自噬体的过程,吞噬的物质被送至溶酶体进行降解。自噬在大脑轻度缺氧或缺血激活时具有保护作用,对神经元发育至关重要。然而,严重缺氧或缺血引起的自噬过度激活会加重IS损伤[22]。因此,抑制脑缺血引起的过度自噬是治疗IS的重要策略之一。
体内研究结果显示,MCAO诱导建立的IS小鼠模型大脑中自噬相关蛋白微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)和Beclin-1表达明显增加,同时PPARγ表达降低。而PPARγ激动剂罗格列酮能够抑制神经元自噬,减少IS小鼠脑梗死体积和脑水肿,增加神经元存活率并促进其神经功能恢复[23]。体外研究结果显示,采用OGD/R导致的IS细胞模型中,可见自噬小体明显增加,LC3、Beclin-1表达明显增加,PPARγ表达明显降低;而PPARγ激动剂15d-PGJ2可以通过促进PPARγ的表达,抑制自噬相关蛋白的表达而抑制细胞过度自噬,发挥抗IS作用[24]。
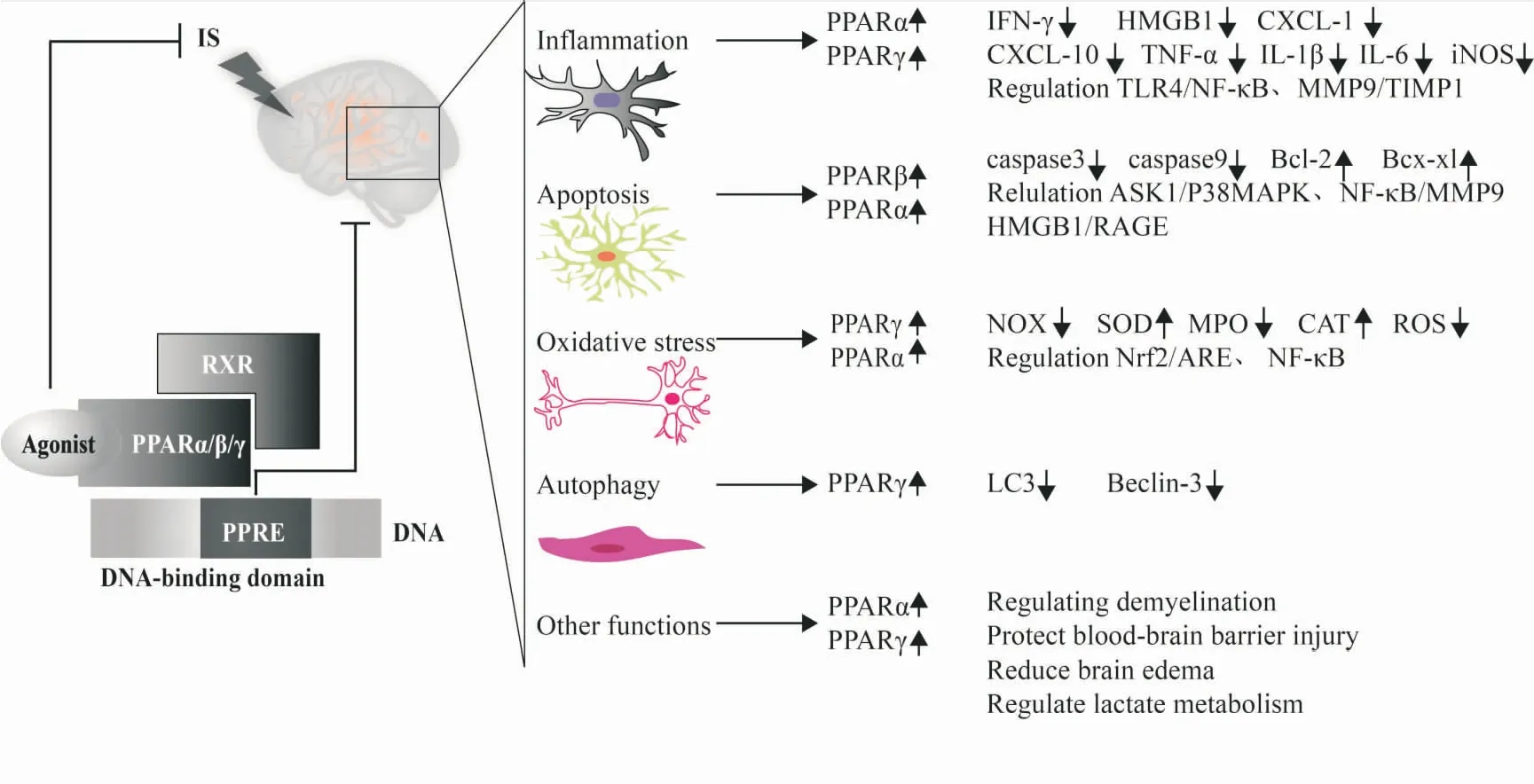
Fig 1 The protective mechanism diagram of PPARs in IS
以上研究结果表明,PPARs能够通过调控自噬信号转导通路抑制神经元过度自噬发挥抗IS的作用。
5 其他作用
此外,最近研究发现LPS能够明显减少PPARγ的表达,抑制脱髓鞘和再髓鞘化过程,进而抑制少突胶质祖细胞(oligodendrocyte progenitor cells,OPC)分化和成熟。而PPARγ激动剂丙戊酸钠、姜黄素等可通过升高PPARγ的表达,诱导OPC的增殖和分化,进而促进髓鞘再生和神经功能恢复发挥抗IS的作用[25-26]。在MCAO诱导建立的IS小鼠模型大脑中,PPARα、PPARγ表达明显降低,血脑屏障(brain blood barrier,BBB)损伤明显。而PPARα/γ双重激动剂GW0742和PPARγ激动剂重组成纤维细胞生长因子、虎杖苷等通过上调PPARα、PPARγ的表达,减少血脑屏障损伤进而发挥抗IS的作用[27]。同时,PPARγ激动剂ISO-α酸通过激活PPARγ,增加M2小胶质/巨噬细胞CD36的表达减轻脑水肿[28]。PPARγ激动剂格列卫通过结合珠蛋白-血红蛋白-CD163促进血肿清除,明显降低血肿体积、脑水肿和血红蛋白[29]。此外,有文献报道OGD/R导致的体外IS细胞模型中,乳酸代谢障碍可加速大鼠星形胶质细胞死亡,而PPARγ激动剂吡格列酮能够通过上调PPARγ,诱导星形胶质细胞乳酸释放进而发挥抗IS的作用[30]。
以上研究结果表明,PPARs还可通过调控脱髓鞘、保护BBB损伤、减轻脑水肿及调节乳酸代谢发挥抗IS的作用。
6 总结与展望
IS病理过程复杂,阐明其病理学机制对明确IS的治疗靶点具有重要意义。本文综述了PPARs在IS的保护作用,其机制与调控神经炎症、细胞凋亡、氧化应激、细胞自噬、调控脱髓鞘、保护BBB损伤、减轻脑水肿及调节乳酸代谢相关途径有关(Fig 1)。值得注意的是,炎症、氧化应激、凋亡、自噬和BBB损伤等之间关系密切。炎症与自噬的相互调节涉及多种信号转导途径。炎症反应可诱导IS过度自噬的发生,而自噬也可通过mTOR、AMPK、NF-κB等途径促进IS炎症反应加重。此外,炎症反应可通过调控凋亡途径诱导IS神经元死亡。最近研究发现,氧化应激损伤与炎症、凋亡和自噬间存在相互作用,IS后ROS大量产生,可促进炎症因子的释放、诱导神经元凋亡或自噬进而损伤BBB并加重IS损伤。因此,进一步研究炎症、氧化应激、凋亡、自噬和BBB之间的关系对阐明IS的病理机制并寻找有效的治疗IS的PPARs激动剂具有重要意义。
此外,目前针对PPARs与IS的相关研究尚处于初步研究阶段,关于PPARs对IS后血脑屏障的影响及其在IS的急性期、亚急性期、恢复期不同阶段的变化尚不清楚。因此,仍需系统研究PPARs在IS不同时间段的变化规律及其可能的作用机制。通过对PPAR在缺血性脑卒中作用的深入研究,后续必将为探索新的PPAR亚型激动剂或者PPAR多重激动剂用于IS的治疗奠定坚实的基础。
