长春花不同花色品种呈色的关键理化性质分析
2022-04-12唐玉情唐中华
高 赛,刘 佳,唐玉情,唐中华,张 捷
(1.东北林业大学 a.园林学院;b.化学化工与资源利用学院,黑龙江 哈尔滨 150040;2.中国科学院 东北地理与农业生态研究所,黑龙江 哈尔滨 150081)
花色作为观赏植物的重要品质性状,其形成受到多方面因素的共同影响。其中,花瓣作为花色素的物质载体其直接接受光源的照射,内部结构及表皮细胞构造等物理特性均会影响花瓣的呈色[1-2]。此外,花瓣细胞内的重要环境因子(如色素细胞介质环境的pH 值、金属元素含量等)均会影响花色素的呈色,进而影响花色[3-4]。花色素是花瓣呈色的物质基础,不同的色素种类及其含量差异是花色形成的直接影响因素。植物体内可产生不同类型的化合物200 000 余种,其中包括许多有色化合物,有关研究结果表明,参与花色形成的色素类型主要包括类胡萝卜素、类黄酮和甜菜碱这三大类。类胡萝卜素属萜类化合物的一个子类,是黄色、橙色花形成的重要色素。类黄酮是属于苯丙烷类的一类次级代谢产物,其化合物众多,对花色的影响范围也更广,颜色可由浅黄到蓝色;其中的花青素作为花色形成中最重要的基础色素化合物,其可为植物花瓣提供多种颜色,从红色、橙色到紫色、蓝色。甜菜素属含氮类化合物,其仅存在于石竹科等少数植物谱系中,可赋予花瓣以黄色至红色[5-6]。由于不同植物合成和积累的色素类型不同,花色多样性差异很大。如草莓Fragaria ananassa和杨梅Myrica rubra通常只能产生并积累一种色素,因此其仅能呈现单种颜色[7-8];而如玫瑰Rosa rugosa、菊花Chrysanthemum morifolium、月季Rosa chinensis等花色丰富,是因为其花瓣中同时存在多种花青素苷和类胡萝卜素[9-11]。
长春花Catharanthus roseus为夹竹桃科Apocynaceae 长春花属Catharanthus多年生草本或亚灌木植物。近年来,针对不同的园林用途及应用地域,国内外特别是美国和欧洲的一些国家的育种专家及园艺公司已选育出不少不同花色、株型的新品种,扩大了长春花的应用范围,极大地提高了其观赏价值。近年来,我国从国外引进了不少长春花的新品种用于盆栽和园林中,主栽品种包括太平洋系列(Pacifica)、地中海系列(Mediterranean)、清凉系列(Cooler)、热浪系列(Heat Wave)、太阳风暴系列(Sun Storm)、大力神系列(Titan)及中国(主要是海南省)主栽的品种等。目前,针对长春花的相关研究内容主要集中于长春花生活史型的形成、逆境胁迫下相关生理代谢特性、不同品种相关农艺性状及品种资源遗传关系等方面[12-14];此外,长春花是研究萜类吲哚生物碱(Terpenoid indole alkaloids,TIA)生物合成与调控的模式物种,因此更多更深的研究内容主要集中于其成分提取及药用价值方面[15]。长春花作为我国南、北方园林中的重要观赏花卉,其在园林应用中的相关研究仅见于其引种栽培技术与景观设计方面,尚未见到有关长春花花色形成及新花色品种培育的相关研究报道。为此,本研究对长春花部分品种的花色表型、花瓣结构、花瓣细胞液pH 值、金属元素含量和花色素的组分与含量进行了测定及分析,以研究长春花花色形成与细胞内重要理化环境的关系,为深入研究长春花花色形成的机理及新花色品种的培育奠定理论基础。
1 材料和方法
1.1 试验材料
供试材料包括4个红色长春花品种‘Cranberry’‘Red Halo’‘Burgundy’‘Lilac’与1个白花品种‘White with Eye’和1个蓝花品种‘Light Blue’,其花色如图1所示。供试的长春花品种种子购自高美(Goldsmith seeds)育种公司,于2020年7月29日播于试验用的温室中,1 周后陆续上盆进行水培。10月中下旬其陆续达到盛花期,于此期随机采集各品种不同单株生长良好且着色充分的新鲜花瓣,将采集的一部分花瓣样品立即用于花色表型的测定和解剖结构特征的观察,将其余花瓣样品保存于-80 ℃的冰箱中以用于后续花瓣细胞液pH 值、金属元素含量及花色素组分含量的测定。

图1 6个长春花品种的花色表型Fig.1 Petal phenotypes of six vinca cultivars
1.2 试验方法
1.2.1 花色表型的观测
取新鲜花瓣,于室内靠近北面的自然散射日光光源下,将不同品种长春花花瓣的中间部分与英国皇家园艺学会比色卡(Royal Horticultural Society Color Chart,RHSCC)进行比对,以判断花色的类型[16]。同时,为了将不同品种长春花花瓣的颜色数量化,以便进行量化分析,根据国际照明委员会(Commission Internationale De L’Eclairage,CIE)的CIELab 色空间系统,使用CR-400 便携式色差仪测定各品种的花色参数明度(L*)、红度(a*)、黄度(b*)值[17-18]。观测时应注意将色差仪的集光孔对准长春花花瓣的中间部分进行测量,每个品种各取5个不同单株的盛花期花瓣,每个样品的观测各设3个技术重复,取其平均值。
1.2.2 花瓣解剖结构的观察
采用徒手切片法,分别制作长春花花瓣上、下表皮细胞及横截面的临时水装片。制片后立即进行光学显微观察,利用尼康制冷DS 显微镜相机及显微图像分析软件NIS-Elements 进行拍照,观察色素细胞在花瓣结构中的排列分布状况及花色素在细胞中的呈色类型。同时,用目镜测微器测量6 种花瓣横截面的厚度及其单层上、下表皮细胞的高宽比,每个品种各选取3 张照片观测,每张照片至少测定5个细胞,取其平均值。
1.2.3 花瓣细胞液pH 值的测定
取2 g 新鲜花瓣,在液氮中迅速研磨成粉末,充分均质化后盛入10 mL 的离心管中,于4 ℃的温度条件下以12 000 r·min-1的转速离心10 min,将上层细胞液转移至另一离心管中,采用pH 计在25 ℃的温度条件下测定各个品种的细胞液pH 值,每个品种的测定各设3个生物学重复,每个样品重复测定4 次,取其平均值。
1.2.4 花瓣金属元素含量的测定
参照Qi 等[19]的操作方法测定花瓣中各种金属元素的含量。每个品种各取适量花瓣,用去离子水洗净,置于105 ℃的烘箱中杀青15 min,再置于70 ℃的温度条件下干燥12 h。精确称取干燥花瓣1 g,充分研磨后,分别加入5 mL 的HNO3和1 mL 的HClO4,使用高效微波消解仪进行消解,经过消解及脱酸后,采用去离子水溶解稀释样品。然后,采用电感耦合等离子体发射光谱仪(ICPOES)分别测定各个样品中钾(K)、钙(Ca)、钠(Na)、镁(Mg)、铁(Fe)、铜(Cu)、锌(Zn)、锰(Mn)、硼(B)、钼(Mo)这10 种金属元素的含量。测定前将所需的玻璃及塑料制品均放在5%的HNO3水溶液中浸泡3 d,并用超纯水冲洗3 遍以上。每个品种各设3个生物学重复,每个样品各重复测定3 次,取其平均值。
1.2.5 长春花不同花色素含量的测定
花色苷含量的测定:取长春花新鲜花瓣,剪碎后混匀,准确称取0.2 g 置于15 mL 的离心管中,向离心管中加入1%的盐酸-甲醇(1∶99,V∶V)溶液10 mL,拧紧管塞后用锡箔纸包严,于室温下浸提24 h,期间振荡几次,直至样品组织变白[20-22]。取过滤后的长春花花色苷提取液,稀释后置于光径为1 cm 的比色杯中,以1%的盐酸-甲醇溶液为空白对照,使用紫外-可见分光光度计测定530 nm 处的吸光值。根据如下公式计算花青素苷含量:
AMF=A530×V×N/(98.2×m)。
式中,AMF表示花瓣中花青素苷的质量分数,其计量单位为mg·g-1;A530表示530 nm 处的吸光值;V表示定容体积,其计量单位为mL;N表示稀释倍数;98.2 为平均消光系数;m为花瓣质量,其计量单位为g。每个品种的测定各设3个生物学重复,取其平均值。
叶绿素、类胡萝卜素含量的测定:准确称取不同花色长春花品种的新鲜花瓣粉末0.2 g,置于15 mL 的离心管中,向离心管中加入10 mL 的无水乙醇-丙酮(1∶2,V∶V)浸提液,拧紧管塞后用锡箔纸包严,置于常温下避光环境中浸提24 h,期间振荡几次,直至样品组织变白。取过滤后的提取液,稀释后置于光径为1 cm 的比色杯中,以无水乙醇-丙酮(1∶2,V∶V)的混合液为空白对照,使用紫外-可见分光光度计测定波长分别为635、649 及470 nm 处的吸光值。每个品种的测定各设3个生物学重复,取其平均值。根据以下公式分别计算叶绿素和类胡萝卜素的含量:
Ca=13.95A665-6.88A649;
Cb=24.96A649-7.32A665;
C(a+b)=(1000A470-2.05Ca-114.8Cb)/245。
式中:Ca表示叶绿素a 的浓度,Cb表示叶绿素b的浓度,Ca与Cb相加即为总叶绿素的浓度;C(a+b)表示类胡萝卜素的浓度(mg·L-1)。
色素含量(mg·g-1)=C×V×N/(1 000×W)。式中:C表示色素浓度,其计量单位为mg·L-1;V表示提取液体积,其计量单位为mL;N表示稀释倍数;W表示样品质量,其计量单位为g。
总黄酮含量的测定:称取不同花色长春花花瓣粉末0.10 g 放入15 mL 的离心管中,加入10 mL的甲醇浸提48 h,将浸提液定容至10 mL[23]。采用氯化铝显色法,黄酮化合物与AlCl3发生反应后会生成黄色的黄酮铝络合物。将标准样品芦丁(Rutin,芸香苷为C27H30O16·3H2O,纯度≥95%,Sigma 试剂公司)于105 ℃的烘箱中烘干1 h[24],准确称取芦丁样品20.30 mg,用1%的盐酸甲醇(1∶99,V∶V)溶液定容至25 mL,配成0.812 mg·mL-1的标准样品溶液。分别取0.0、0.2、0.4、0.6、0.8、1.0 mL 的标准液加入1%的盐酸甲醇溶液至4 mL,再分别加入1%的AlCl3·6H2O 甲醇溶液6 mL,平衡10 min。使用紫外-可见分光光度计在220 ~700 nm 的波长范围内扫描,结果发现,在波长分别为330 和270 nm 处各有一个吸收峰,以330 nm 为检测波长测定标准样品溶液的吸光值(A330),根据A330的吸光值和标准样品芦丁溶液的浓度绘制标准曲线,得到的线性回归方程为:C=0.076A330+0.001,R2=0.997。式中,C为芦丁浓度(mg·mL-1),A330为330 nm 处的吸光值。分别取不同品种的提取液2 mL,加入1%的AlCl3·6H2O 甲醇溶液3 mL,平衡10 min,上机测定A330,将其代入回归方程中,计算各个长春花样品溶液的浓度,并计算样品中总黄酮的含量(mg·g-1)。每个品种的测定各设3个生物学重复,取其平均值。
1.3 数据处理
采用 Excel 2013、SPSS 22.0 及Canoco 5.0 软件进行数据处理与分析,所有统计数据均为(平均值±标准差)。
2 结果与分析
2.1 花色表征
不同品种长春花花色的分类结果见表1。以RHSCC 植物标准比色卡比对后判断,6个品种的花色可以分为4个色系:‘White with Eye’为白色系;‘Red Halo’‘Burgundy’‘Lilac’均为红紫色系;‘Cranberry’为红色系;‘Light Blue’为紫罗兰色系。由表1 可知,6个长春花品种之间花色值的差异显著。其中,明度L*值表示花色的明暗程度,其度量值为0 ~100,颜色表现为从黑色到白色的变化状态,L*值越小则花色越暗,反之则花色越亮。白色系品种‘White with Eye’花瓣的明度L*值最高,而红色系品种‘Cranberry’花瓣的明度L*值最低;除‘White with Eye’外,其他5个品种花瓣正面的L*值均小于其背面的L*值,且其花色均由白色变至正红色,随着花色的加深,其L*值均呈逐渐下降趋势。色相a*值反映花瓣的红绿程度,其度量值为-128 ~127,正值表示颜色偏红,负值表示颜色偏绿。6个品种花瓣正面的a*值均大于其反面的,除白花品种‘White with Eye’的a*值为负值外,其他品种的a*值均为正值,且红、紫色系品种花瓣的a*值比蓝白色系品种的明显偏高,因此,依据a*值可以有效区分长春花红、紫色系与其他色系,随着a*值的逐渐增大,长春花的花色逐渐变为正红色。色相b*值的正、负值分别代表黄度和蓝度,其度量值亦为-128 ~127。长春花品种中缺少黄色系花,因此各品种的黄度值普遍较低,其中‘Light Blue’‘Lilac’‘Burgundy’这3个品种花瓣的b*值均为负值,说明其花色相对更偏蓝色。
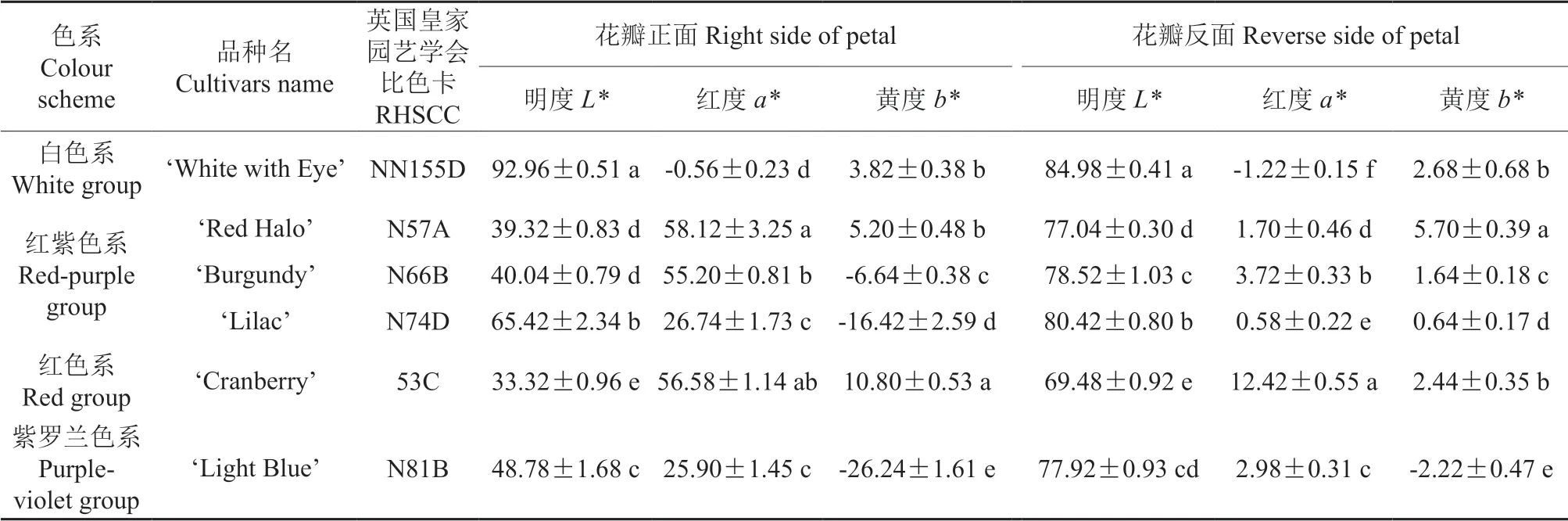
表1 不同长春花品种的花色类别及花色值†Table 1 Classification and value of floral color of different vinca cultivars
2.2 长春花花瓣呈色的相关理化指标分析
2.2.1 花瓣解剖结构分析
长春花花瓣横截面及上、下表皮细胞解剖结构如图2所示。由图2 可知,长春花花瓣横截面结构包括上表皮、中层组织及下表皮,中层组织部分未观察到栅栏组织和海绵组织的明显分化。在‘White with Eye’花瓣的各个组织中,没有观察到明显的有色物质的积累,白色花表型可能是由入射光线在花瓣内部连续折射而形成的一种光学现象。其他5个长春花品种的有色细胞均集中分布于花瓣的上表皮,而中层组织及下表皮细胞中基本观察不到色素物质的存在,这种色素分布方式可能有助于长春花花色的呈现。

图2 长春花花瓣横截面及上、下表皮细胞解剖结构Fig.2 Anatomical structure of petal cross section and upper and lower epidermal cells of vinca

续图2Continuation of Fig.2
不同花色品种长春花花瓣厚度的观测结果如图3所示。图3 表明,6个品种长春花的花瓣厚度为193.10 ~200.47 μm,不同品种间其花瓣厚度存在显著差异。红色系‘Cranberry’的花瓣最厚,红紫色系‘Red Halo’和‘Burgundy’的花瓣均较厚,而白色系‘White with Eye’的花瓣最薄。不同花色品种长春花花瓣表皮细胞高宽比的测量结果如图4所示。图4 表明,6个品种长春花上表皮细胞的高宽比均高于其下表皮的。结合图2 的花瓣解剖结构分析可知,长春花花瓣上表皮细胞呈圆锥状,向上凸起,且相邻细胞间略有间隙,其上无角质层覆盖;中层组织细胞为不规则长椭圆形,大小不一,且排列较为疏松;下表皮细胞为不规则多边形,扁平状无凸起,排列较为紧密。
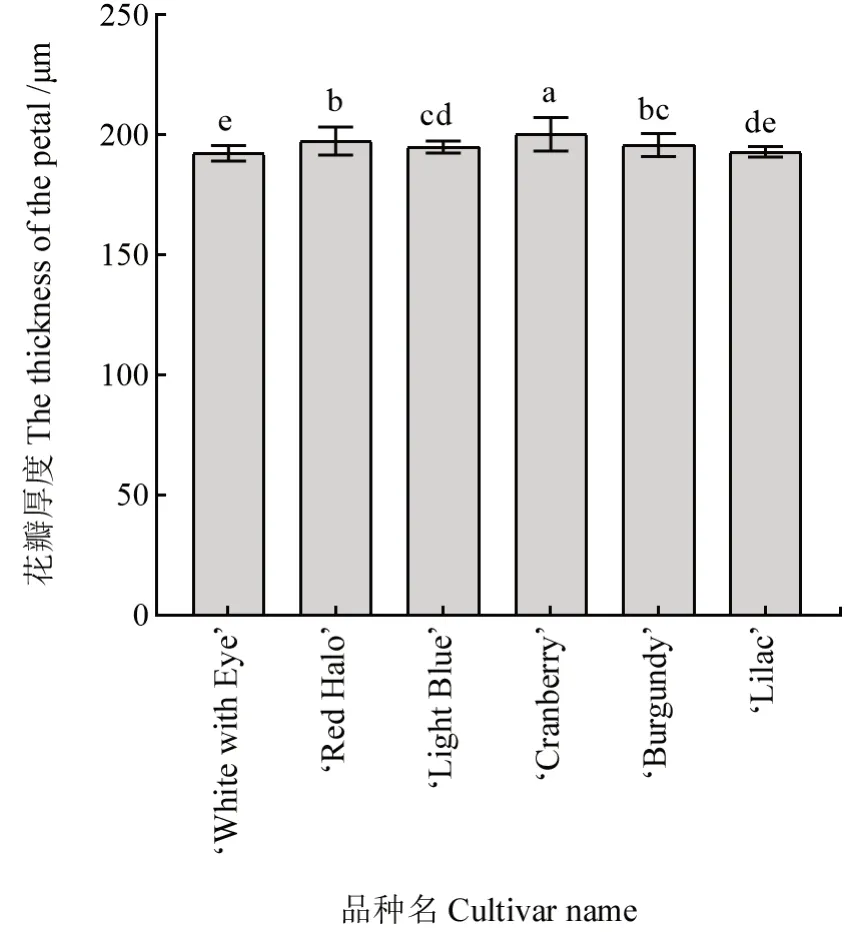
图3 不同花色品种长春花花瓣厚度的观测结果Fig.3 Petal thickness values of vinca varieties with different floral colors
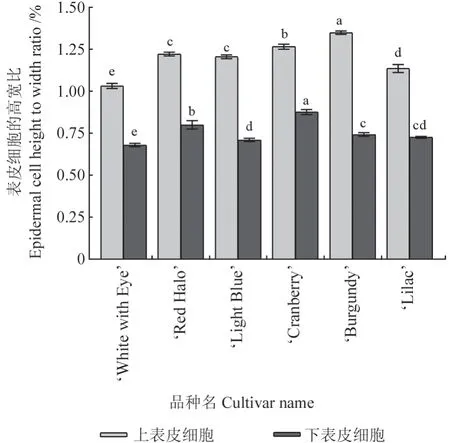
图4 不同花色品种长春花花瓣表皮细胞高宽比的观测结果Fig.4 The ratio of height to width of petal epidermal cells in different floral colors of vinca varieties
2.2.2 细胞液的pH 值
不同花色品种长春花花瓣细胞液pH 值的测定结果如图5所示。图5 表明,6个品种长春花的花瓣细胞液pH 值为4.58 ~5.68,其平均值为5.12,说明其细胞液均呈偏酸性,且不同花色品种间其差异显著。其中,紫罗兰色系‘Light Blue’的花瓣细胞液pH 值最高,白色系‘White with Eye’的次之,红、紫色系的花瓣细胞液pH 值普遍低于蓝、白色系的。

图5 不同花色品种长春花花瓣细胞液pH 值的测定结果Fig.5 The pH of petal cell fluid of different floral varietals of vinca
2.2.3 金属元素的含量分析
不同花色品种长春花花瓣中10 种金属元素含量的测定结果如图6所示。6个品种长春花花瓣内的大量元素中,钾(K)元素含量均最高,为2.25 ~3.45 mg·g-1,平均为2.72 mg·g-1,是其他9 种元素含量总和的3.7 倍;红紫色系‘Red Halo’花瓣中的K 含量最高,红紫色系色系‘Burgundy’花瓣中的K 含量最低。其次为钙(Ca)元素,其含量为0.16 ~0.40 mg·g-1,平均为0.26 mg·g-1;白色系‘White with Eye’花瓣中的Ca 含量最高,红色系‘Cranberry’花瓣中的Ca 含量最低。含量排在第三位的是镁(Mg)元素,其含量为0.09 ~0.13 mg·g-1,平均为0.11 mg·g-1;红紫色系‘Red Halo’花瓣中的Mg含量最高,红紫色系色系‘Lilac’花瓣中的Mg 含量最低。6个品种长春花花瓣中的钠(Na)元素含量为0.07 ~0.12 mg·g-1,平均为0.10 mg·g-1;红色系‘Cranberry’花瓣中的Na 含量最高,红紫色系‘Red Halo’花瓣中的Na 含量最低。6个品种长春花花瓣内的微量元素中,铁(Fe)元素含量明显高于其他元素的含量,为99.00 ~247.23 mg·g-1,平均为167.13 mg·g-1;红紫色系色系‘Burgundy’花瓣中的Fe 含量最高,红紫色系色系‘Red Halo’花瓣中的Fe 含量最低。6个品种长春花花瓣中其他5 种金属元素的含量由高到低依次为锰(Mn)、锌(Zn)、硼(B)、铜(Cu)、钼(Mo)。6个品种长春花花瓣中的Mn 含量为21.17 ~52.03 mg·g-1,其平均值为35.52 mg·g-1;其Zn 含量为16.07 ~31.77 mg·g-1,其平均值为23.62 mg·g-1;其B 含量为13.27 ~26.47 mg·g-1,其平均值为19.84 mg·g-1;其Cu 含量为2.87 ~7.00 mg·g-1,其平均值为4.51 mg·g-1;其Mo 含量为0.73 ~1.70 mg·g-1,其平均值为1.13 mg·g-1。各品种间所测10 种金属元素的含量差异均显著。
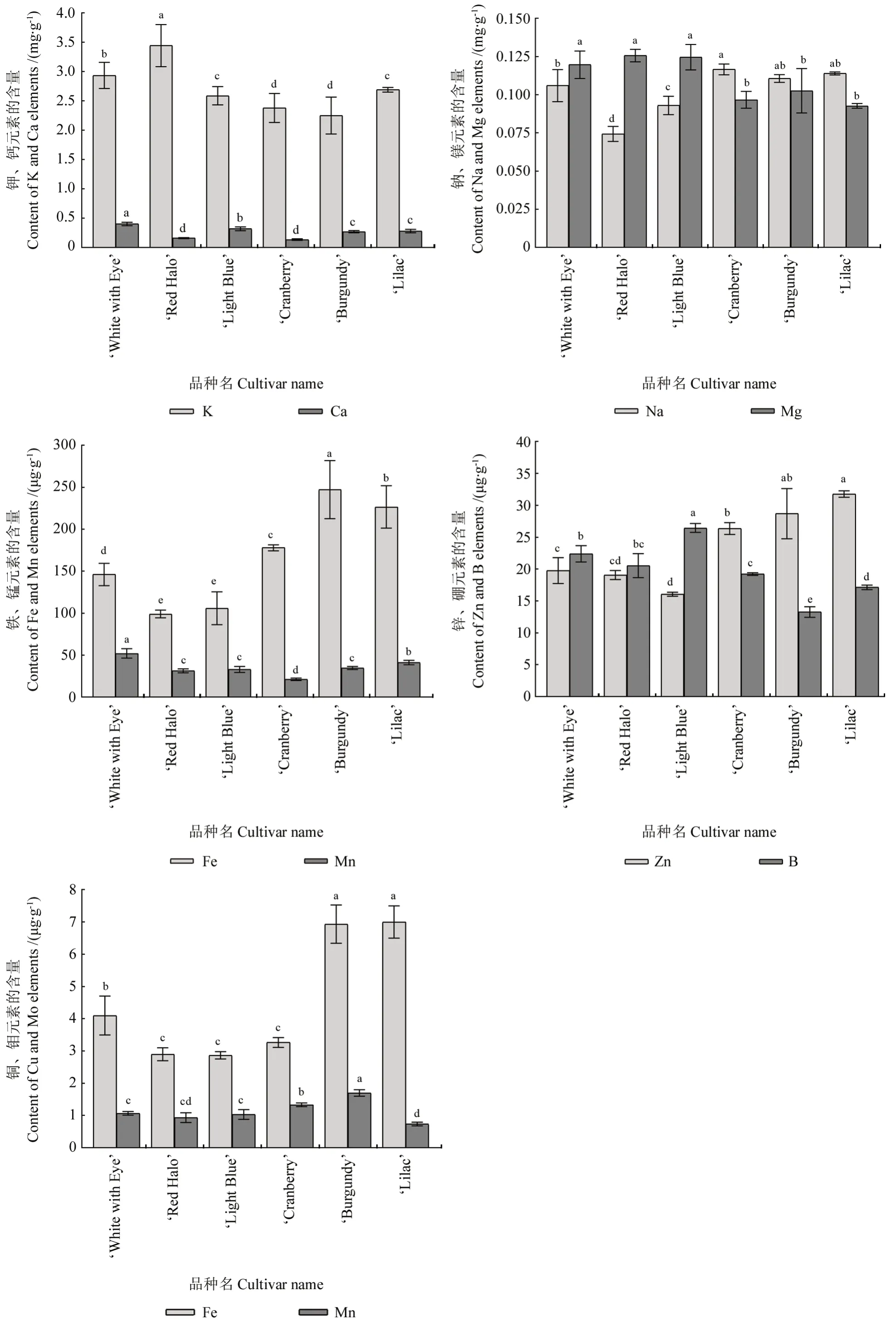
图6 不同花色长春花品种花瓣中不同金属元素的含量Fig.6 Different contents of metal elements in petals of vinca varieties with different colors
2.2.4 花色素含量的测定结果
不同花色品种长春花结果盛花期的花瓣中均含有四大类色素,且各种类型的色素在不同品种中的含量均存在明显差异,测定结果见表2。表2表明,‘Red Halo’与‘Cranberry’这2个品种花瓣中的叶绿素与类胡萝卜素的含量均显著高于其他品种的;6个品种长春花的花瓣中,叶绿素的平均含量仅为0.025 mg·g-1,类胡萝卜素的平均含量仅为0.006 5 mg·g-1,此二者在长春花花瓣中都表现为痕量存在。花色苷是花瓣着色的主要色素类型。6个品种长春花花瓣中的花色苷含量,白色系‘White with Eye’的含量最低,为0.203 mg·g-1;红色系‘Cranberry’的含量最高(22.577 mg·g-1),是‘White with Eye’含量的111 倍。4个色系的花色苷含量由高至低依次为红色系>红紫色系>紫罗兰色系>白色系。黄酮类化合物也是影响花瓣着色的重要物质。6个品种长春花花瓣中黄酮类化合物的平均含量为38.275 mg·g-1;其中,‘Cranberry’的含量最高,‘Red Halo’的含量次之,‘White with Eye’的含量最低。
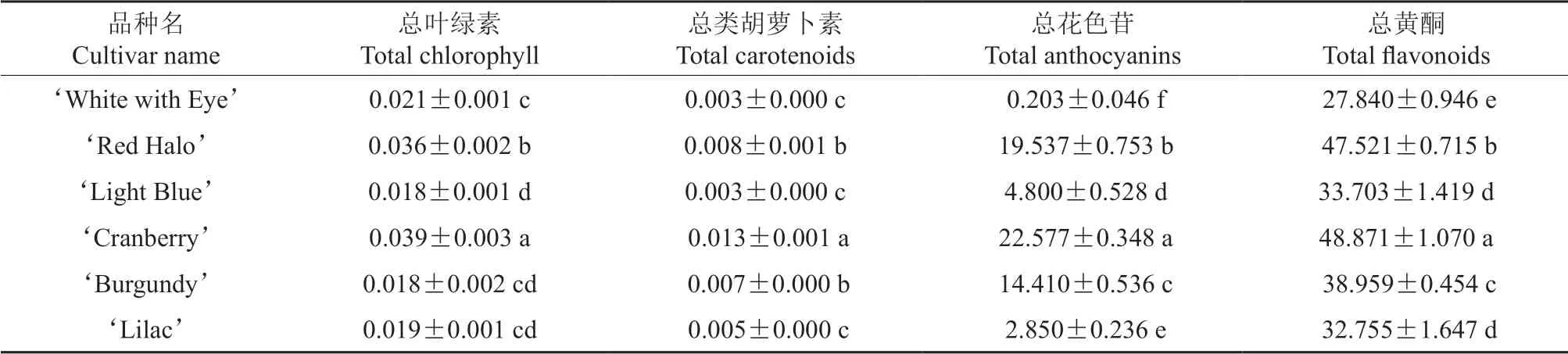
表2 不同花色品种长春花花瓣中不同色素含量†Table 2 Different pigment content in petals of different color vinca varieties mg·g-1
2.3 影响长春花花瓣呈色的各项理化指标间的相关性分析
长春花花色值、花瓣结构与各项理化指标间的相关系数见表3,花瓣中不同金属元素含量及各种花色素间的相关系数见表4。由表3 可知,不同花色品种长春花花瓣的L*值与a*值之间均呈极显著负相关(P<0.01),而与b*值之间均无显著相关性。长春花花瓣的明度L*值与花瓣厚度、上表皮细胞高宽比、总花色苷及总黄酮含量之间均存在极显著负相关性(P<0.01),而与花瓣细胞液pH 值、Ca 元素和Mn 元素含量之间均存在极显著正相关,同时与叶绿素和类胡萝卜素含量之间均存在显著负相关性(P<0.05);反之,红度a*值与花瓣厚度、上表皮细胞高宽比、总花色苷及总黄酮含量之间均存在极显著正相关,而与花瓣细胞液pH 值、Ca 元素和Mn 元素含量之间均呈极显著负相关,与叶绿素和类胡萝卜素含量之间均存在显著正相关。由此可知,花瓣厚度、上表皮细胞的高宽比、总花色苷及总黄酮含量的增加可明显提高长春花花瓣的红度,在花瓣红度增加的同时,花瓣表面的光泽度却随之降低,花色加深变暗;而细胞液pH 值、Ca 元素和Mn 元素含量的增加会降低花瓣的红度值,而有效提高花瓣的亮度。叶绿素和类胡萝卜素的含量都很少,但对于花瓣的花色值也都有一定程度的影响。6个品种的b*值与花瓣细胞液pH 值之间均呈极显著负相关,而与花瓣厚度及色素含量间均呈显著正相关。此外,长春花花瓣的各项理化指标之间也存在着明显的相关性。其中,叶绿素、类胡萝卜素、花色苷和总黄酮四大类色素含量彼此之间存在极显著的正相关性(表4),且四者与花瓣细胞液pH 值和Ca、Mn 元素含量之间均呈极显著负相关。此外,花瓣厚度、表皮细胞高宽比与细胞液pH 值三者彼此之间也具有显著的相关性。
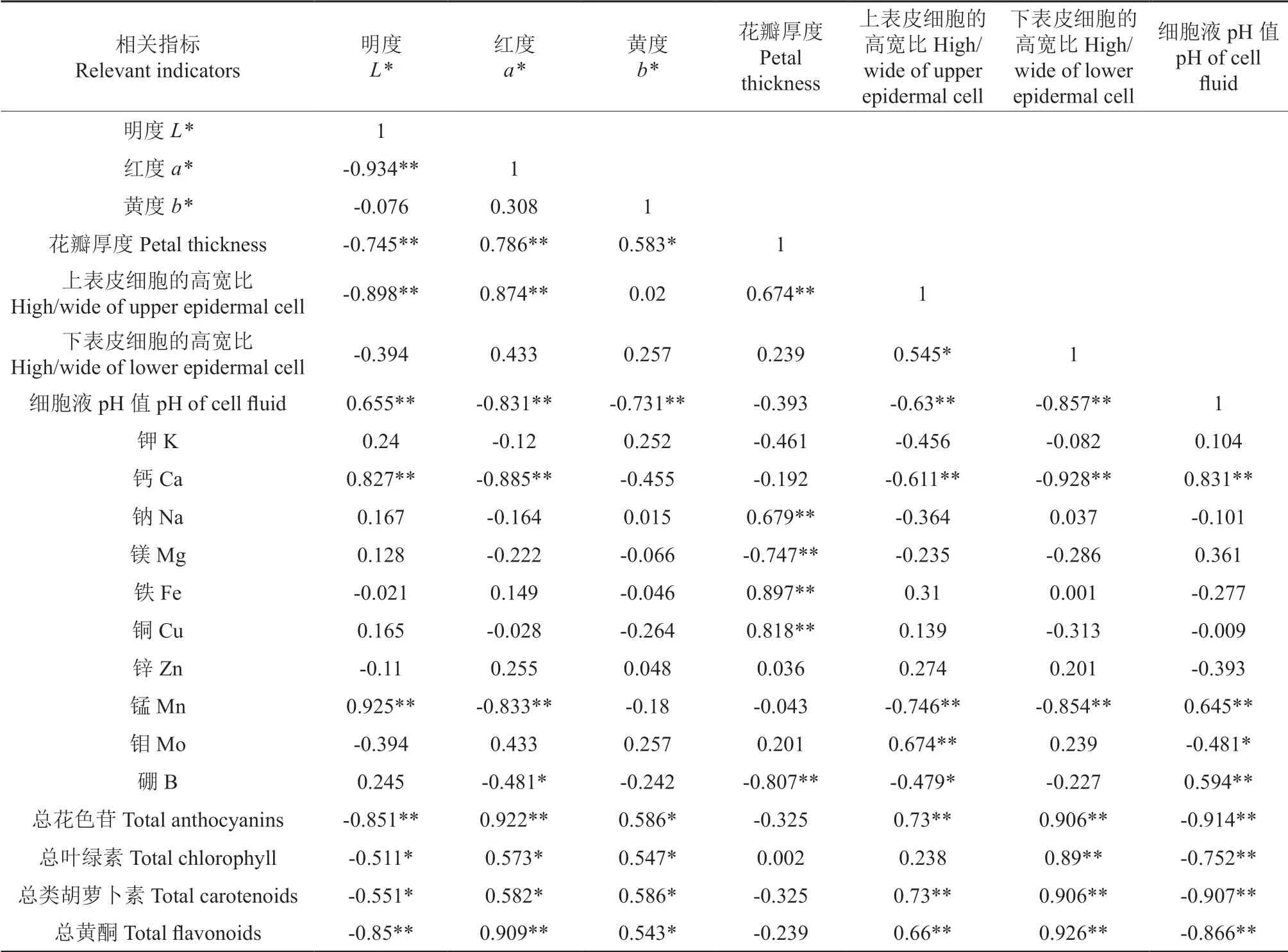
表3 长春花花色值、花瓣结构与各项理化指标值之间的相关系数†Table 3 Correlation coefficient between flower color value,petal structure and physicochemical indexes of vinca
以上分析结果表明,长春花花瓣中叶绿素、类胡萝卜素、花色苷及黄酮类化合物之间彼此相互促进,而花瓣细胞液pH 值和Ca、Mn 元素含量与四大类花色素含量间却相互抑制。细胞液pH 值与Ca、Mn 元素含量间相互促进,而与表皮细胞高宽比之间却相互抑制。由此可知,影响长春花花瓣呈色的各项理化指标之间既相互联系又彼此影响,共同决定了长春花花瓣颜色的呈现。其中,色素作为花瓣呈色的物质基础,叶绿素、类胡萝卜素、花色苷及总黄酮含量直接影响着长春花的花色,而花瓣厚度、表皮细胞高宽比与细胞液pH值和Ca、Mn 元素含量可能通过影响光线的吸收折射及花色素的组分含量从而间接影响了长春花花色的改变。
2.4 冗余分析
冗余分析(RDA 排序)能够针对多项理化指标有效地进行统计与检验,并可确定对于长春花花瓣呈色多样性变化具有最大解释率的最少变量的组成,能够有效地简化变量个数,从而进一步地作简化分析。对长春花的花色值(L*、a*、b*值)与花瓣内各项相关理化指标之间的相关性进行冗余分析,结果如图7所示。图7 中的实心箭头表示花色值指标,空心箭头表示理化指标;箭头连线的长短表示花色值与理化指标间关联度的大小,长度越长表示相关性越大,反之则相关性越小;两个箭头间的夹角表示花色值与理化指标间相关性的大小,角度越小则相关性越大[25-26]。由图7可知,花色值与各项理化指标之间均显著相关。其中,第Ⅰ轴(即RDA1,约束排序模型中的第1个约束轴)解释了不同品种花色值的81.94%的变异信息,第Ⅱ轴(即RDA2,约束排序模型中的第2个约束轴)解释了其16.57%的变异信息,前两轴累计解释量达到98.51%;第Ⅲ轴与第Ⅳ轴的解释量之和仅为1.48%。因此,前两轴可以很好地说明长春花花色值指数与各项理化指标之间的关系,且其主要取决于第Ⅰ轴。为将理化因子变量对花色值的贡献率进行量化分析,同时进行了蒙特卡罗检验,结果见表5。由表5 可知,长春花花色值与花瓣中的花色苷含量、总黄酮含量、上表皮细胞高宽比、Mn 元素含量、Ca 元素含量、花瓣厚度、细胞液pH 值与下表皮细胞高宽比之间均呈现出极显著的相关性。其中,Mn 元素含量、Ca 元素含量、细胞液pH 值与RDA1 轴之间均呈极显著正相关,而总花色苷含量、总黄酮含量、上表皮细胞高宽比、花瓣厚度及下表皮细胞高宽比与RDA1 轴之间均呈极显著负相关。由表4 还可知,花色苷含量与总黄酮含量对于长春花花色值的解释率最高,分别为71.9%(F=40.9,P<0.01)和70%(F=37.3,P<0.01)。因此,花色苷与总黄酮含量的差异是长春花不同花色形成的主要影响因子,而花瓣厚度、表皮细胞形态、细胞液pH 值及Mn、Ca 之值等作为辅助因子也都会影响其呈色。

表5 各项理化指标的蒙德卡罗检验结果Table 5 Monde Carlo test for physical and chemical factors
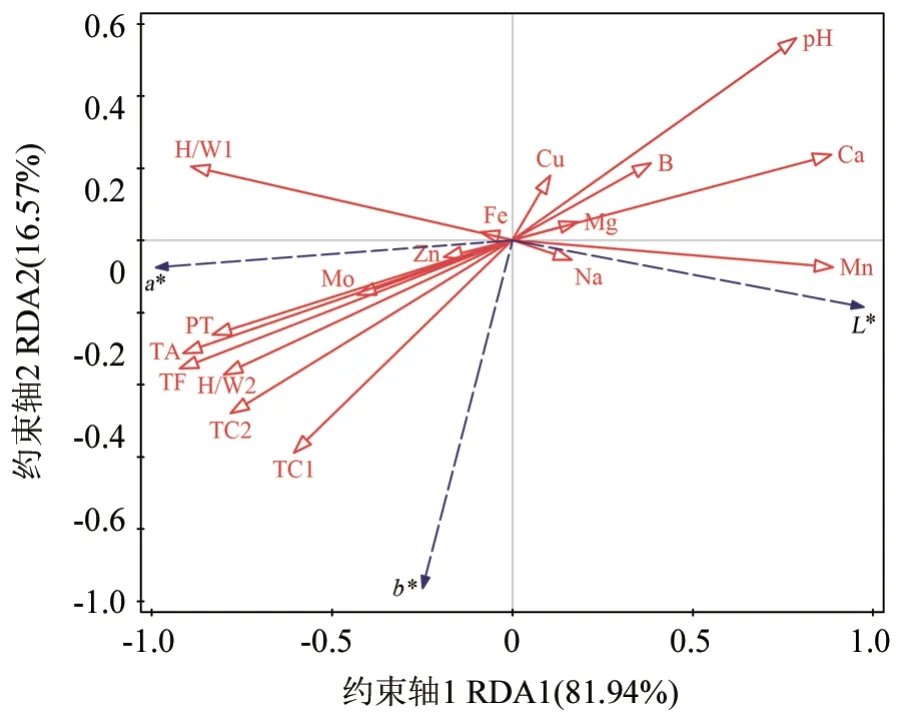
图7 长春花花色值与各项理化指标之间关系的冗余分析结果Fig.7 Redundancy analysis of the relationship between folwer color value and physicochemical index of vinca

表4 长春花花瓣中不同金属元素含量与各种花色素含量间的相关系数Table 4 Correlation coefficients of different metal elements and anthocyanidins in vinca petals
3 讨论与结论
花色的系统分类及量化对于种质资源的标准化评价和新花色品种的培育都十分重要。采用RHSCC 标准比色及CIELab 颜色系统可以对花瓣颜色进行专业性描述及数量化表征处理,不同花色品种长春花的花色值L*与a*值之间均呈现极显著的负相关性,这与Akbari 等[27]和吴静等[28]的研究结果均一致。红色系和红紫色系是长春花品种资源的主要色系,因此,在对其花色进行定量分析时,红度a*值相较于黄度b*值的参考价值更大。
研究结果表明,长春花白花品种的花瓣组织中无明显色素细胞的分布,而在其他5个品种花瓣的上表皮细胞中均可明显地观察到花色素的大量积累,色素在细胞中的呈色类型与花瓣表型几近一致。这种色素分布方式与岳娟[29]对蓝色鸢尾与紫色鸢尾的相关研究结果一致,而与葡萄风信子、非洲菊等[1]花卉不同的是,长春花花色素的分布更加集中,这种色素分布方式可能更有助于长春花的呈色。研究中发现,花瓣厚度、上表皮细胞形态与长春花花色值L*、a*值之间均有显著的相关性,这与殷涵泰等[2]对秋石斛的研究结果相同。花瓣呈色过程中,光线由外部环境首先照射至花瓣表面,其在穿透色素层时一部分会被吸收,而另一部分则在海绵组织层中被反射折回,而后再次通过色素层最终进入观察者的眼睛中。在此过程中,花瓣厚度与表皮细胞的形态对光线均会造成影响,进而影响花色的呈现。
研究中发现,6个长春花品种的花瓣细胞液均呈偏酸性,且其细胞液pH 值与花色值a*值之间均存在显著负相关性。细胞液酸碱性的强弱是花瓣呈色稳定与否的重要影响因素。有关研究者[30-31]在对矮牵牛的研究中发现,当花瓣细胞液呈偏酸性时,花色则趋向红色;当花瓣细胞液呈近中性或呈弱碱性时,花色则呈现蓝色。细胞液pH 值是通过影响花色苷的稳定性而影响花色呈现的。在强酸性环境中,花色苷的化学性质较为稳定,一般呈红色;而在高pH 值的介质环境中,其性质趋于不稳定,花色苷最大吸收波长发生红移,花色偏蓝;随着环境碱性的继续增强,花色苷结构遭到严重破坏,颜色发生褐变[32-33]。因此,长春花花瓣细胞液的酸性环境有利于花色素苷的保存与积累,这使得长春花花色的呈现更为稳定。
长春花花瓣中Ca、Mn 元素含量与花色值L*、a*值之间均显著相关,随着Ca、Mn 元素含量的升高,花瓣的亮度逐渐升高,而红度值随之逐渐降低,花色变浅。白新祥[34]在对菊花的研究中发现,Fe3+、Mg2+、Al3+和Ca2+对红色品种‘龙卷狂飙’的花青素均可起到增色作用,而对白色品种‘圣光白雪姬’的黄酮类化合物却没有明显的影响。Razieh 等[35]在对非洲菊的研究中发现,Fe2+和Ca2+对黄色花非洲菊花色的影响均显著,而Mg2+的影响并不显著。花瓣中金属元素含量及其存在状态对于不同物种、不同花色植物的影响复杂且各有差异。Goto 等[36]提出,金属元素可以不同离子态形式与花色苷的发色团或是黄酮醇核进行分子堆叠,这种螯合机制抑制了花色素发色团的水合作用,促进其增色。Kazuaki 等[37]在对郁金香‘Murasakizuisho’的研究中发现,其花被底部显示出与花被不同的颜色的原因是其Fe3+含量有差异。本研究对各种金属元素仅进行了定量分析,在长春花花色苷呈色过程中,是否有Ca2+、Mn2+的参与及其是否存在特殊的络合机制,仍需进一步研究。
花色苷作为红色和蓝、紫色花形成的决定性色素,也是决定花瓣红度值的重要物质基础。长春花花色苷含量与明度L*值和红度a*值之间均存在显著的量效关系。Wan 等[38]在对现代月季的研究中发现,黄酮类物质不仅其自身可呈色,而且可与花色苷产生共色效应,从而加强花色苷的显色。黄酮类物质是长春花花色形成的重要辅助色素,6个品种的总黄酮含量均较高。此外,黄酮类物质作为花青素苷的直接前体物质,研究中还发现,长春花花瓣中总花色苷和总黄酮的含量之间呈现出极显著的正相关关系。此前已有研究者[39]报道,花瓣中含有叶绿素。在6个花色品种长春花的花瓣中也检测到了叶绿素及类胡萝卜素,但二者仅表现为痕量存在,冗余分析结果表明,其对花瓣呈色的影响均较小。分析当前相关研究的现状,后续研究可以利用液质联用技术(HPLC-MS)对花色苷及黄酮类单体进行鉴定及定量分析,从次生代谢水平上对长春花花瓣中的差异化合物进行表征,以揭示其色素代谢机理。
综上所述,不同品种长春花的花色差异不是单一指标作用的结果,而是多项理化指标共同作用、相互影响的结果。类黄酮化合物作为长春花花瓣呈色的化学基础,其组分与含量的差异是决定长春花不同花色形成的主要因素。其中,花色苷是影响长春花花瓣着色的主要色素,黄酮类作为辅助色素协同花色苷共同呈色。此外,花瓣厚度、表皮细胞形态、细胞液pH 值及Mn 或Ca 元素含量等指标作为辅助因子协助参与了花瓣的呈色。该研究结果可为长春花花色形成机制的研究及新花色品种的培育提供一定的理论依据。
