羊源生物2型犬巴氏杆菌的分离鉴定及药敏试验
2022-04-11白新栋王晨骁王小园党如意杨增岐
白新栋,王晨骁,王 斌,吴 克,王小园,王 娟,党如意,杨增岐
(西北农林科技大学动物医学院,陕西杨凌 712100)
巴氏杆菌属细菌是一类革兰氏阴性短杆菌或球杆菌,其菌体经瑞氏染色、姬姆萨染色或美蓝染色后,镜检可见典型两极着色[1]。本属细菌有13个种,许多种属巴氏杆菌长期存在畜禽上呼吸道或消化道黏膜表面,作为条件致病菌继发于其他传染病或环境应激,也可作为原发性病原给动物造成严重损害,最具代表性的为多杀性巴氏杆菌,可引起多种动物的出血性败血症和传染性肺炎,而犬巴氏杆菌在兽医临床上的相关研究报道较少。根据其生化反应能否产生吲哚,犬巴氏杆菌可分为2个生物型,犬巴氏杆菌生物1型能产生吲哚,主要存在于犬猫等动物的口腔中,可经咬伤途径引起人的伤口化脓性炎症、腹膜炎、骨关节炎、眼内炎甚至全身性感染[2-6];犬巴氏杆菌生物2型不能产生吲哚,主要引起牛的肺炎[7]。关于生物2型犬巴氏杆菌引起羊感染肺炎的病例在国内未见报道,本病例从陕西省某奶山羊场获得病死羔羊肺脏病料,由肺脏组织分离到1株生物2型犬巴氏杆菌,并对该菌株进行了动物致病性试验和药敏试验。
1 材料与方法
1.1 材料
1.1.1 病料来源与实验动物 2021年2月中旬陕西省某奶山羊场羔羊舍发生肺炎疫情,该羔羊舍存栏量约600只,发病率近50%,病死率约10%。病理剖检可见死亡羔羊肺脏充血肿大、暗红、肝样变,伴有局部化脓灶及胸腔积液等病理变化,无菌采集病死羔羊的肺脏组织低温保存运送至实验室进行实验室诊断;6只SPF级昆明系小鼠购自成都达硕实验动物有限公司。
1.1.2 主要试剂与仪器 营养琼脂、MH琼脂,青岛海博生物技术有限公司产品;绵羊血采自西北农林科技大学实验动物中心健康绵羊;细菌微量生化反应管,杭州滨和微生物试剂有限公司产品;药敏纸片由本实验室参考欧盟药敏试验标准(EUCAST 2017)自行制备并低温保存;细菌DNA提取试剂盒(离心柱型),天根生化科技有限公司产品;引物合成和产物测序由西安擎科生物公司完成;细菌浊度仪,杭州齐威仪器有限公司产品。
1.2 方法
1.2.1 细菌分离鉴定
1.2.1.1 细菌分离培养与染色镜检 无菌操作剪取一小块肺脏病变组织,用切面涂布接种于50 mL/L绵羊血琼脂培养基上进行划线培养,培养24 h后择优势菌再进行纯化培养,纯化后挑取单菌落涂片进行革兰氏染色,镜检观察其形态。
1.2.1.2 生化鉴定 挑取纯化培养后的单菌落,分别接种于葡萄糖、乳糖、麦芽糖、甘露醇、山梨醇、枸橼酸盐、硫化氢、尿素、蛋白胨水(加靛基质1~2滴)、磷酸盐葡萄糖胨水(加MR试剂1滴)、鸟氨酸脱羧酶、β-半乳糖苷等细菌微量生化反应管中,用封口膜封口,然后放入37℃恒温培养箱中培养24 h~36 h,观察其生化反应并记录。
1.2.1.3 PCR扩增和16SrRNA基因测序及遗传进化分析 以分离菌株的DNA为模板,上下游引物选用细菌16SrRNA基因PCR扩增通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′),以25 μL反应体系按常规PCR方法进行扩增。将PCR产物进行核酸凝胶电泳,核对目的条带大小后将PCR产物进行测序,并将测序结果于NCBI官网上进行Blast序列比对分析,并选取数据库中部分菌株序列与分离菌株16SrRNA基因序列进行系统遗传进化分析,用MEGA7软件构建进化树。
1.2.2 小鼠致病性试验 挑取纯化培养物于无菌生理盐水中以制备细菌悬液,利用细菌浊度仪将菌液浓度调至约1.5×108CFU/mL。将6只体重相近的小鼠随机分成2组(n=3),试验组小鼠每只腹腔注射0.2 mL菌液,对照组小鼠每只腹腔注射相同剂量的无菌生理盐水,于相同饲养条件下饲养,观察小鼠状态,如有死亡则对其进行病理剖检,并采取肺脏和肝脏再次进行细菌的分离鉴定,同时,对照组小鼠作相同处理。
1.2.3 药敏试验 选取复方青霉素、复方阿莫西林、庆大霉素等18种抗菌药物,用纸片扩散法对分离菌株进行药敏试验,根据欧盟药敏试验标准委员会公布的兽用抗菌药物耐药判定标准判定结果。
2 结果
2.1 菌落特征与细菌形态
分离菌株在绵羊血琼脂培养基上培养24 h后,可见灰白色、水滴样、表面光滑、边缘整齐的小菌落,无溶血现象(图1A)。革兰氏染色镜检为阴性球菌或短杆菌,两端钝圆,多见单个存在,有的成对出现,偶见两极着色(图1B)。根据菌落形态和染色特征,初步诊断分离菌株为巴氏杆菌属细菌。

图1 分离菌株菌落形态与细菌形态(1 000×)
2.2 生化鉴定结果
根据细菌微量生化反应管试剂盒操作规范对该分离菌株进行生化鉴定试验(表1),将生化试验结果与《伯杰细菌鉴定手册》第8版比对,表明该分离菌株疑似为犬巴氏杆菌。
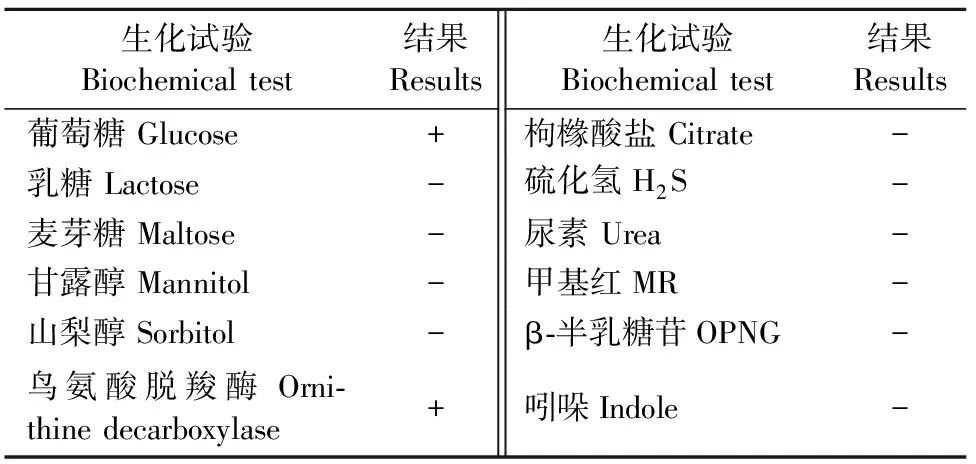
表1 分离菌株的生化特性
2.3 16S rRNA基因测序及系统进化树
将分离菌株进行16SrRNA基因扩增后,扩增目的基因长度为1 300 bp,符合预期大小(图2)。16SrRNA基因进化树分析表明该分离菌株与犬巴氏杆菌亲缘关系最近聚为一支(图3),进一步确定该分离菌株为犬巴氏杆菌,且根据上述吲哚试验阴性结果,判定其为生物2型犬巴氏杆菌。
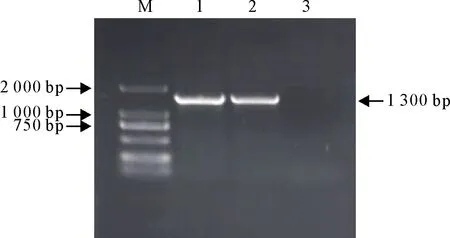
M.DNA标准DL 2 000;1~3.阳性对照、本试验菌株、阴性对照
2.4 小鼠致病性试验结果
试验组小鼠注射菌液4 h后,开始出现呆立、畏寒扎堆等症状,并于12 h内全部死亡,而对照组小鼠精神状态良好。试验组死亡小鼠剖检可见肺脏肿大、严重出血,呈现红色肝变(图4A),肝脏淤血,呈胶冻样肿大(图4B),对照组小鼠剖检未见异常病理变化(图4C、D)。试验组小鼠肺脏和肝脏进行细菌分离培养,可再次获得该生物2型犬巴氏杆菌,而对照组小鼠组织培养未能获得生物2型犬巴氏杆菌。表明该分离菌株对小鼠有致病性,其导致的病理变化以肺脏和肝脏病变最具特征。
2.5 药敏试验结果
药敏试验结果表明分离菌株对阿莫西林、头孢噻呋钠、新霉素、氟苯尼考、恩诺沙星、泰妙菌素敏感,对复方阿莫西林、氨苄青霉素、氨苄西林、替米考星中介,对链霉素、庆大霉素、安普霉素、泰万菌素、泰乐菌素、多西环素、金霉素、土霉素、磺胺氯达嗪呐耐药。
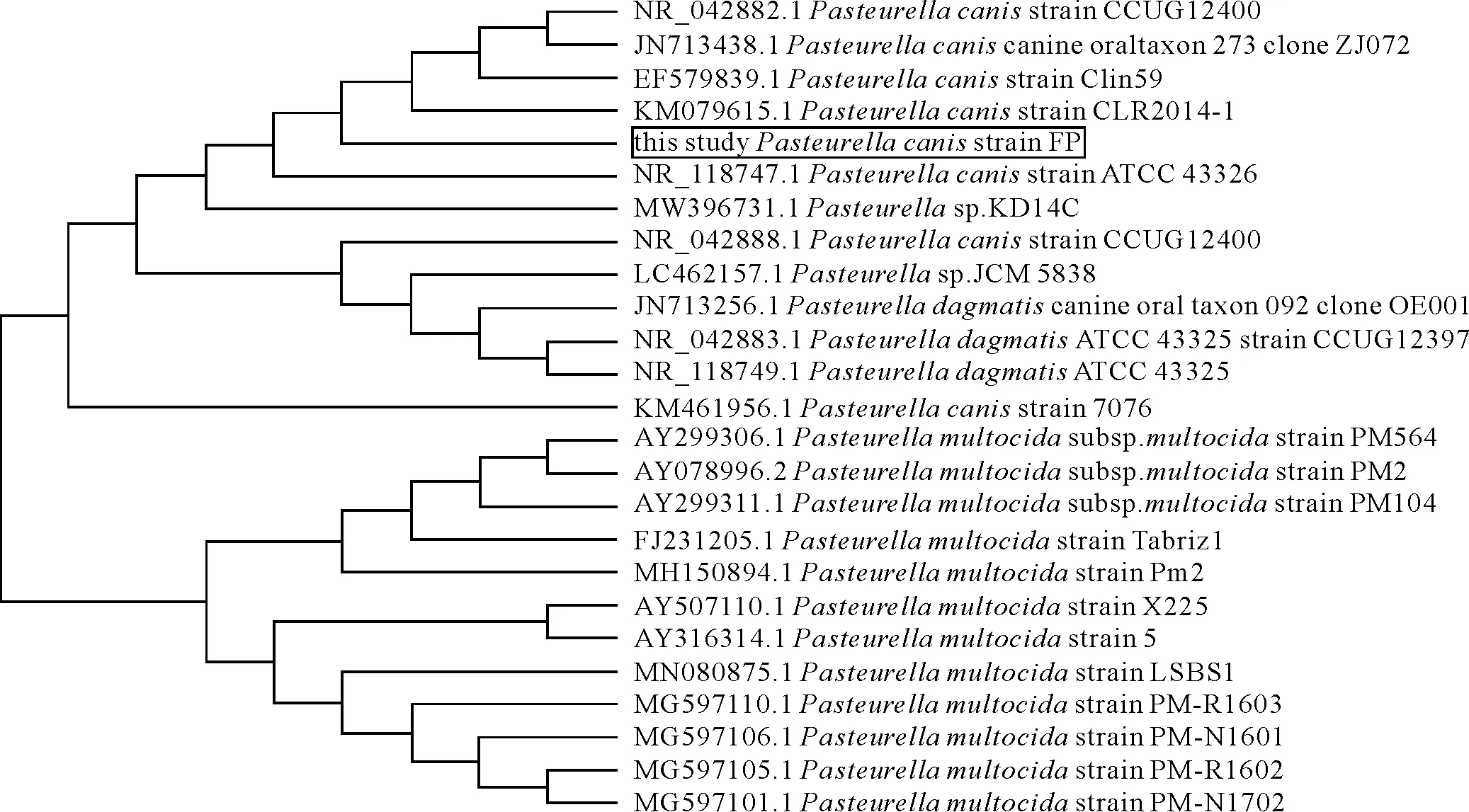
图3 16S rRNA基因进化树

图4 人工感染小鼠肺肝病变剖检结果
3 讨论
犬巴氏杆菌为重要人兽共患病病原[8],犬、猫等动物咬伤、伤口舔舐或与之密切接触均可引起局部或全身感染[9-10]。犬巴氏杆菌也可引起犬传染性心内膜炎及新生幼犬的全身性感染[11-12],以及貂的急性死亡[7]。上述病原多为生物1型犬巴氏杆菌,生物2型犬巴氏杆菌虽然以犬来命名,但其早期分离的宿主来源都为肺炎牛,生物2型犬巴氏杆菌与犊牛肺炎密切相关[13],与牛密切接触的艾滋病患者感染生物2型犬巴氏杆菌而导致泪囊炎[14]。从羊的鼻拭子、病死羊及屠宰羊肺脏中分离到的135株巴氏杆菌中有3株为生物2型犬巴氏杆菌,说明生物2型犬巴氏杆菌也可能在羊群中传播。本文从某集约化养殖场羔羊舍的病死羊肺脏病料中分离到1株生物2型犬巴氏杆菌,小鼠致病性试验证明该菌株有致病性,且能造成肺脏严重出血、肝样变,对比剖检羔羊的肺脏严重肝变有相似之处。本文涉及的羔羊肺炎为群体发病,但生物2型犬巴氏杆菌在羊上的相关研究和病例报道太少,其在羊群中的传播能力及致病性强弱存疑,且本次试验采集到的病料样本数量太少,无法评估其传染性。本实验室人员在同一份病料中进行支原体检测后,结果显示山羊支原体肺炎亚种的PCR检测为阳性,由此推测生物2型犬巴氏杆菌在羊体内可能长期定殖,作为机会致病菌诱发于支原体感染或环境应激。
药敏试验结果显示,该分离菌株对阿莫西林、头孢噻呋钠、新霉素、氟苯尼考、恩诺沙星、泰妙菌素均敏感,对复方阿莫西林、氨苄青霉素、氨苄西林、替米考星介于敏感与耐药之间,对链霉素、庆大霉素、安普霉素、泰万菌素、泰乐菌素、多西环素、金霉素、土霉素、磺胺氯达嗪呐均表现不同程度耐药。该分离菌株对受试半数抗菌药物均呈现耐药性,说明该分离菌株已存在较为严重的多重耐药性,该结果有助于指导针对生物2型犬巴氏杆菌感染症的临床用药。
