烟草NtNRAMP3.1基因克隆、表达及Cd转运特性分析
2022-04-06陈邦兰高永峰黄仁华刘继恺
陈邦兰,龙 涛,高永峰,黄仁华,2,刘继恺, 2, 3
(1.西南科技大学生命科学与工程学院, 四川 绵阳 621010; 2. 西南科技大学核废物与环境安全国防重点实验室, 四川 绵阳 621010;3. 核废物与环境安全省部共建协同创新中心, 四川 绵阳 621010)
【研究意义】镉(Cd)位于元素周期表第五周期ⅡB族,价电子构型4d105S2,主要为+2价和0价。单质Cd本身无毒,但其化合物存在毒性及腐蚀性,在植物中会产生累积性毒害[1-2]。烟草属于Cd易富集植物,其吸收的Cd主要积累于根、叶中[3]。Cd不仅会抑制烟草的生长发育、影响烟叶品质,还对吸烟者的健康构成潜在的威胁[4]。因此,对相关基因进行克隆和功能鉴定对于阐明烟草Cd吸收积累的分子机制,以及利用基因工程手段提高烟叶品质显得十分必要。虽然NRAMP基因已在多个植物物种中被鉴定,但有关烟草NRAMP基因的研究还很缺乏。NtNRAMP5是目前唯一被克隆的烟草NRAMP基因,其编码的蛋白定位于质膜,具转运有Mn和Cd的能力[5]。【前人研究进展】过量的Cd会抑制植物的生长发育,多数表现为植株矮小、叶片失绿、生长缓慢、生物量下降等。且随着Cd浓度的升高,植物叶片内的叶绿素含量和叶绿素a/b的比值均呈现出下降趋势[6]。同时,Cd可使线粒体的膜结构发生变化,内部结构丧失,影响内膜上的氧化磷酸化,从而抑制小麦的呼吸作用[7]。此外,Cd还会影响植物根部细胞水和营养物质的吸收,干扰钙(Ca)、镁(Mg)、钾(K)和磷(P)的吸附[8]。丙二醛(MDA)是植物在逆境条件下发生膜脂过氧化作用的产物。研究发现,随着Cd2+处理浓度的升高,桉树[9]、火炬树[10]中MDA的含量也逐渐上升,导致膜脂过氧化加剧,说明Cd会使植物产生氧化逆境。Cd进入植物的途径很多,主要经皮层组织进入植物根部,再通过质外体或共质体到达木质部,进而运输到植物其他部位[11]。金属转运蛋白是一类膜定位蛋白,在金属离子吸收与转运过程中扮演着重要角色。目前人们已鉴定到多个参与Cd运输的金属转运蛋白,如P1B-ATPase家族的TaHMA2[12],CDF家族的MTP1[10]和ZIP家族的AtIRT1、OsIRT1、OsIRT2和Tcirt1-G等[13-16]。自然抗性相关巨噬细胞蛋白(Natural resistance associated macrophage proteins,NRAMPs)是一类参与金属离子运输的跨膜转运蛋白,首先在动物中被发现且广泛存在于植物中。NRAMP蛋白不仅在Mn、Zn和Fe等微量元素的吸收分配中发挥作用,还参与了植物对Cd等毒性重金属的吸收和转运[17]。例如,在拟南芥中,AtNRAMP6定位于侧根和幼嫩叶片细胞的高尔基体或反面高尔基网络上,是Cd和Fe的转运蛋白[18-19]。在水稻NRAMP基因家族中,OsNRAMP1定位于质膜,负责Cd和Mn等金属离子的吸收和转运[20-21]。OsNRAMP5定位于质膜,是Mn和Cd的主效转运蛋白[22]。OsNRAMP6定位于质膜,在酵母实验中被证明具有Cd转运功能[23]。【本研究切入点】本研究前期通过生物信息学的方法发现烟草基因组中存在9个NtNRAMP基因,本研究对其中一个成员NtNRAMP3.1基因进行了克隆并分析了其组织表达和对不同重金属的应答模式,同时通过将其在酵母细胞中异源表达,对其Cd转运能力进行了鉴定。【拟解决的关键问题】本研究结果将为深入了解烟草NtNRAMP基因家族在植物金属离子吸收转运中的功能,以及利用现代生物技术培育Cd低积累的烟草品种提供理论依据。
1 材料与方法
1.1 材料与胁迫处理
供试植物材料烟草‘K326’由四川省农业科学院经济作物研究所提供。酵母菌株BY4741购自Euroscarf网站(http://www.euroscarf.de)。
将经10% NaClO清洗的无菌烟草种子分别播种于以下几种固体培养基上垂直培养:1/2 MS(对照);不含MnSO4的1/2 MS(缺Mn);1/2 MS + 500 μmol/L MnSO4(过量Mn);不含ZnSO4的1/2 MS(缺Zn);1/2 MS + 100 μmol/L ZnSO4(过量Zn);不含FeSO4的1/2 MS(缺Fe);1/2 MS + 500 μmol/L FeSO4(过量Fe);1/2 MS + 50 μmol/L CdCl2(Cd处理)。培养1个月后分别对烟草幼苗的叶和根进行取样,样品经液氮速冻后置于-70 ℃储存备用。
1.2 生物信息学分析
利用ClustalW软件对拟南芥和水稻的自然抗性相关巨噬细胞蛋白(Natural resistance associated macrophage protein,NRAMP)与NtNRAMP3.1的氨基酸序列进行比对。使用MEGA 6.0软件中的最大释然法并基于1000次重复抽样检验构建NtNRAMP3.1和其他NRAMP蛋白的进化树[24]。
利用TMHMM Server V.2.0预测NtNRAMP3.1蛋白的跨膜结构域(Transmembrane domians,TMs),并使用TMRPres2D展现其拓扑结构[25]。
1.3 烟草NtNRAMP3.1基因的表达模式分析
总RNA的提取和反转录参见Liu等[26]的方法。以NtL25(基因编号:L18908.1) 和Ntubc2(基因编号:AB026056.1)作为内参基因,采用TransStart Green qPCR SuperMix在Bio-Rad公司的CFX96 Real-time System进行实时荧光定量PCR(qRT-PCR),使用的基因特异引物见表1。

表1 使用的引物及其序列
1.4 烟草NtNRAMP3.1基因的克隆及其酵母表达载体的构建
根据SGN网站(https://solgenomics.net/)的NtNRAMP3.1基因(基因编号:nitab4.5_0002568g0010.1)序列,设计带有KpnI和EcoR I双酶切位点的特异性引物NtNRAMP3.1-F和NtNRAMP3.1-R(引物序列见表1)。以烟草幼苗cDNA为模板进行PCR扩增。PCR程序:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,34个循环;72 ℃延伸5 min。将扩增产物用1.0%琼脂糖凝胶电泳检测后,利用TIANGEN公司的通用型DNA纯化回收试剂盒对目的条带进行回收。通过酶切连接的方法将目的片段插入到pYES2载体的KpnI和EcoR I位点,并将连接产物转化至DH5α大肠杆菌感受态细胞,阳性克隆送华大基因科技股份有限公司测序。
1.5 酵母转化及表型分析
1.5.1 酵母转化 利用PEG/LiAC酵母转化法分别将pYES2和pYES2+NtNRAMP3.1质粒转入酵母菌株BY4741中[27]。将转化后的酵母涂布于SD/-ura(Dex)固体培养基上,置于30 ℃培养3~4 d。
1.5.2 点板分析 挑取酵母单克隆到SD/-ura (Dex)液体培养基,于30 ℃,200 r/min培养2 d。酵母菌经4000 r/min,离心5 min后,倒掉上层培养基,用无菌去离子水重悬菌体使菌液的OD600=0.2。依次将酵母菌液稀释成5个梯度,每个梯度稀释10倍。最后各取2 μL点板,置于30 ℃,培养2~4 d并拍照记录。使用的对照组培养基为SD/-ura(Dex),实验组为SD/-ura(Gal+Raff)+ 40/60 μmol/L CdCl2。
1.5.3 生长曲线测定 分别将含有pYES2和pYES2+NtNRAMP3.1的酵母菌加入20 mL液体培养基中,使其OD600在0.05左右。将酵母菌置于30 ℃,200 r/min培养,分别在0、2、5、10、12、24、28、32、36、48、54、60 h测定菌液的OD600。使用的对照组培养基为SD/-ura(Dex),实验组为SD/-ura(Gal+Raff)+ 60 μmol/L CdCl2。
1.5.4 Cd含量的测定 首先将转基因酵母菌接种于SD/-ura(Gal+Raff)液体培养基中培养9 h左右,使其OD600在0.1左右。然后向培养液中加入CdCl2使Cd2+的终浓度为20 μmol/L。酵母菌在30 ℃,200 r/min培养24 h后离心收集菌体。收集的菌体先用100 μmol/L 的EDTA洗1遍,再用无菌去离子水洗3遍,最后置于70 ℃烘干至恒重。
将干燥后的菌体称重后,分别加入4 mL的HNO3并置于180 ℃消解。利用原子吸收光谱仪(AA700, 美国PE公司)测定样品中Cd含量。
2 结果与分析
2.1 烟草NtNRAMP3.1基因的克隆及序列分析
以烟草cDNA为模板,用特异性引物进行PCR扩增,获得与预期条带大小一致的扩增条带(图1)。测序结果显示,扩增得到的核酸片段序列与预期序列(nitab4.5_0002568g0010.1)一致,由此NtNRAMP3.1基因克隆成功。序列分析表明,NtNRAMP3.1基因全长1542 bp,编码一个大小为513个氨基酸,具有11个跨膜结构域的蛋白,该蛋白的N端和C端分别位于胞外和胞质内(图2)。通过构建烟草NtNRAMP3.1与拟南芥和水稻NRAMP蛋白的进化树发现,烟草NtNRAMP3.1属于NRAMP家族的第一亚组,与拟南芥AtNRAMP3和AtNRAMP4的亲缘关系最近(图3)。氨基酸序列比对(图4)显示,除了OsNRAMP8,其余第一亚组成员均含有NRAMP家族的保守结构域CTM(Consensus Transport Motif),但在个别位点存在差异,其中NtNRAMP3.1在CTM最后一位的氨基酸为组氨酸(H),其余成员的为天冬酰胺(N)或天冬氨酸(D)。
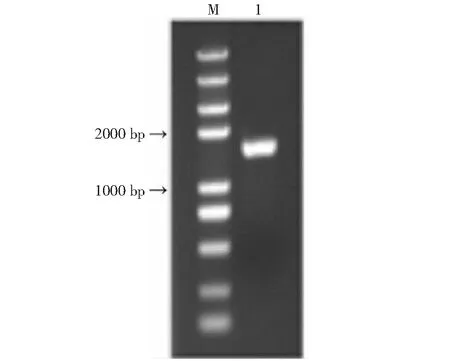
M: Trans2K Plus II DNA maker; 1: NtNRAMP3.1图1 烟草NtNRAMP3.1基因PCR扩增电泳Fig.1 Electrophoresis of PCR amplification product of NtNRAMP3.1 gene from tobacco
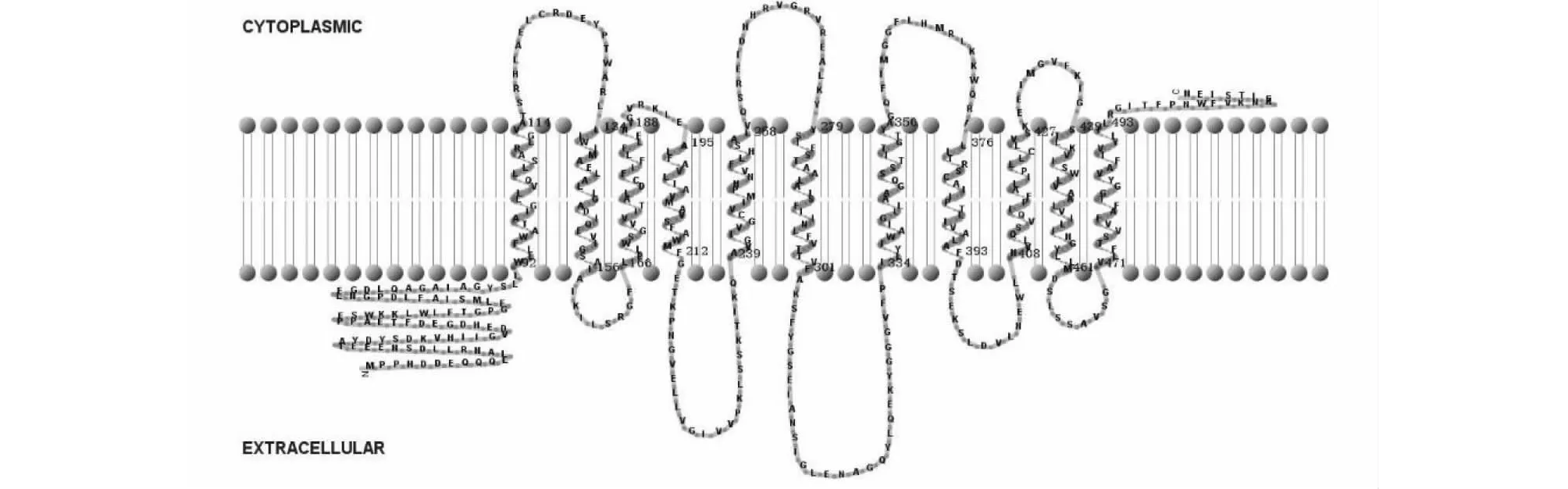
图2 NtNRAMP3.1蛋白的跨膜结构Fig.2 Transmembrane structure of NtNRAMP3.1
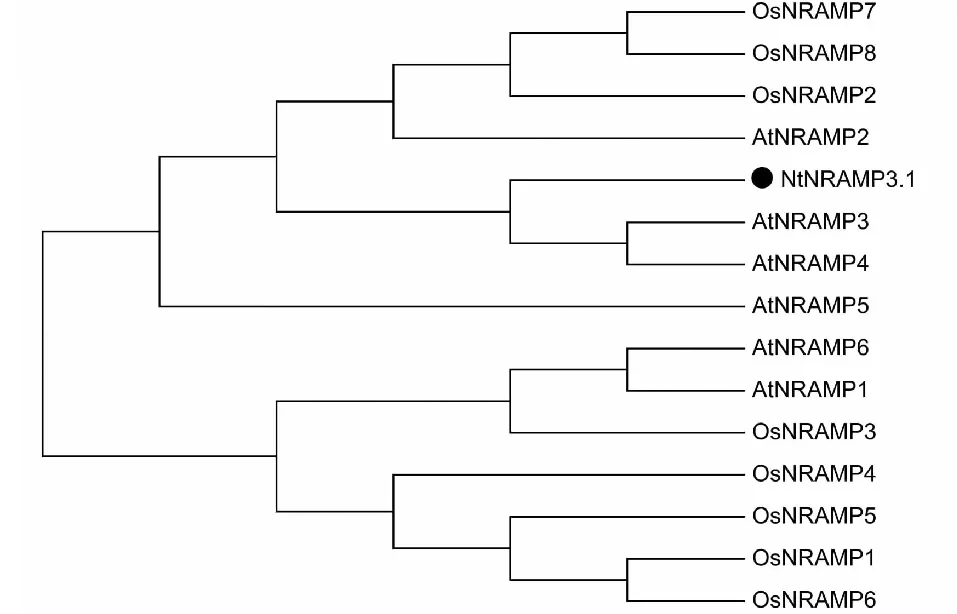
图3 烟草NtNRAMP3.1基因系统进化树Fig.3 Phylogenetic tree of NtNRAMP3.1 gene
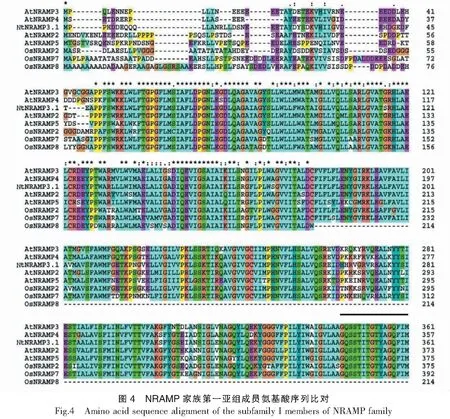
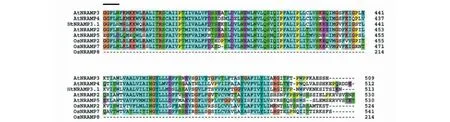
黑色直线表示CTM结构域;相应基因的登录号:OsNramp1 (Os07g15460), OsNramp2 (Os03g11010), OsNramp3 (Os06g46310), OsNramp4 (Os02g03900), OsNramp5 (Os07g15370), OsNramp6 (Os01g31870), OsNramp7 (Os12g39180), OsNramp8 (Os03g41070), AtNramp1 (At1g80830), AtNramp2 (At1g47240), AtNramp3 (At2g23150), AtNramp4 (At5g67330), AtNramp5 (At4g18790), AtNramp6 (Atlg15960)Black line denotes the CTM motif;Accession numbers for the corresponding genes are OsNramp1 (Os07g15460), OsNramp2 (Os03g11010), OsNramp3 (Os06g46310), OsNramp4 (Os02g03900), OsNramp5 (Os07g15370), OsNramp6 (Os01g31870), OsNramp7 (Os12g39180), OsNramp8 (Os03g41070), AtNramp1 (At1g80830), AtNramp2 (At1g47240), AtNramp3 (At2g23150), AtNramp4 (At5g67330), AtNramp5 (At4g18790), AtNramp6 (Atlg15960)续图4Continued fig.4
2.2 烟草NtNRAMP3.1基因对不同重金属胁迫的应答模式
用不同重金属离子处理烟草植株,通过对NtNRAMP3.1基因在根、叶组织中的表达情况进行qRT-PCR分析(图5)发现,在正常生长和重金属胁迫处理的烟草幼苗中,NtNRAMP3.1基因在叶中的表达量均高于根,但是其对不同重金属胁迫表现出不同的应答模式。在烟草的根中,Cd、过量Mn和缺Fe处理组的NtNRAMP3.1基因相对表达量高于对照组,其中Cd处理的相对表达量最高,是对照组表达量的3.19倍,而其余处理(缺Mn、缺Zn、过量Zn和Fe)则显著抑制NtNRAMP3.1基因的表达。在烟草的叶中,除Fe处理组(过量Fe和缺Fe)外,其余处理中NtNRAMP3.1基因的表达量均高于对照组,其中过量Mn处理中相对表达量最高,为对照组的2.05倍。统计分析表明,除Zn处理组(过量Zn和缺Zn)外,其余各处理组中NtNRAMP3.1基因的表达量与对照组均存在极显著性差异。

用独立样本t检验进行显著性分析,*表示同一组织处理组与对照的显著性差异(P<0.05),**表示同一组织处理组与对照的极显著性差异(P<0.01)Independent sample t test is used for significance analysis. The mark * represents the significant difference (P<0.05) between heavy metal treatment groups and control on each tissue. The mark ** represents the highly significant difference (P < 0.01) between heavy metal treatment groups and control on each tissue图5 NtNRAMP3.1基因在不同重金属处理下的表达Fig.5 Expression pattern of NtNRAMP3.1 gene under different heavy metal treatments
2.3 烟草NtNRAMP3.1的表达增强了酵母对Cd的敏感性
利用酵母点板的方法研究了转基因酵母菌在含有不同浓度CdCl2培养基上的生长情况。结果(图6)显示,含有空载体和目的基因的酵母菌在不含CdCl2的培养基(对照)上的生长情况基本一致,CdCl2处理均可以抑制酵母菌的生长,但是对含有NtNRAMP3.1的酵母菌的抑制作用更为显著,其在含有60 μmol/L CdCl2的培养基上几乎不能生长。为了进一步研究NtNRAMP3.1对酵母Cd敏感性的影响,在不同时间点分别测定了转空载或NtNRAMP3.1的酵母菌在不含和含有60 μmol/L CdCl2的液体培养基中的OD600值,并绘制生长曲线,得到的结果和点板实验的一致。从第2小时开始,CdCl2处理显著抑制了酵母菌的生长(图7),在第12小时,含有空载体和目的基因的酵母菌生长情况出现差异,到第24小时,Cd对含有NtNRAMP3.1基因的酵母菌的抑制作用与含有空载的酵母相比变得极显著。上述结果表明烟草NtNRAMP3.1基因的表达增强了酵母对Cd的敏感性。

图6 转基因酵母的生长情况Fig.6 The growth of transgenic yeast
2.4 烟草NtNRAMP3.1对酵母Cd吸收的影响
为了探究NtNRAMP3.1基因增强酵母对Cd的敏感性的原因,分别测定了20 μmol/L Cd处理24 h后,转空载和NtNRAMP3.1基因酵母中的Cd含量(图8),转NtNRAMP3.1基因酵母中Cd的浓度明显高于转空载的酵母,t检验显示两者的Cd浓度存在极显著性差异,表明烟草NtNRAMP3.1基因增强了酵母对Cd的吸收能力。
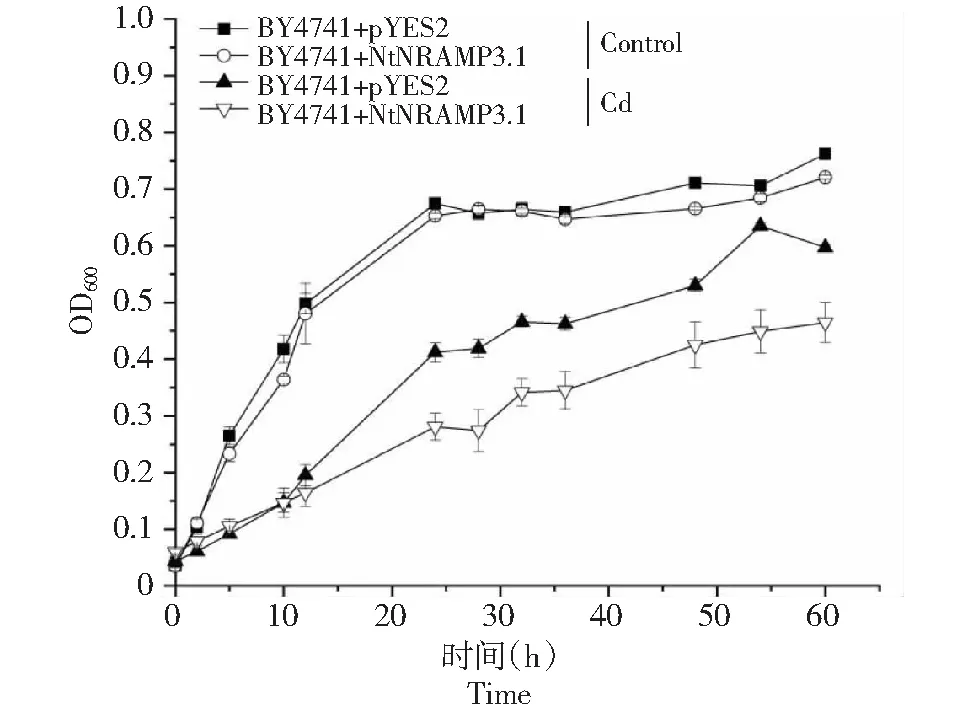
图7 生长曲线Fig.7 Growth curve
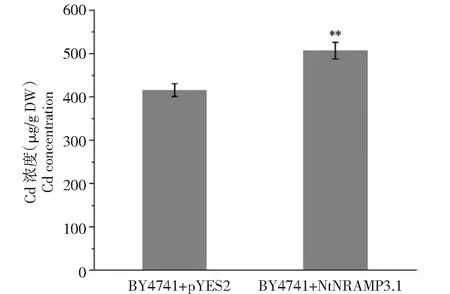
用独立样本t检验进行显著性分析,**表示对照与转NtNRAMP3.1基因酵母中Cd积累量的极显著性差异(P<0.01)Independent sample t test is used for significance analysis.The mark ** represents the highly significant difference (P<0.01) of Cd accumulation between control and NtNRAMP3.1 transgenic yeast图8 酵母对Cd的吸收Fig.8 Cd uptake in yeast
3 讨 论
虽然NRAMP基因家族已在多个植物物种里被鉴定和功能研究,但是关于烟草NRAMP基因的研究还很少,目前仅初步探究了NtNRAMP5的亚细胞定位和重金属转运底物。本研究通过对克隆到的NtNRAMP3.1基因进行生物信息学分析发现,虽然烟草NtNRAMP3.1基因具有NRAMP家族的典型特征[28],但其编码蛋白的CTM结构域的最后一位氨基酸与其他拟南芥和水稻NRAMP第一亚家族成员的具有差异(NtNRAMP3.1是H,其余的为N或D)。之前的研究发现拟南芥AtNRAMP4第413位的苯丙氨酸突变为异亮氨酸(F413I)会影响其转运Cd的能力,序列分析发现这一位点正好在一个保守基序内[29]。CTM是NRAMP蛋白家族的保守结构域,可能参与了与ATP耦合亚基的相互作用[17],因此,上述最后一个氨基酸的差异是否影响烟草NtNRAMP3.1蛋白的金属转运能力还有待进一步研究。
进化分析结果表明,烟草NtNRAMP3.1蛋白属于NRAMP家族的第一亚家族,和拟南芥AtNRAMP3和AtNRAMP4的亲缘关系最近。拟南芥AtNRAMP3和AtNRAMP4是定位于液泡膜的Cd、Fe和Mn的转运蛋白[30]。在种子萌发过程中,这2个蛋白可将液泡中的Fe向外转运利用;在成年植株中,它们可将Mn从液泡中转运到光合组织参与光合作用[31-32]。本研究发现NtNRAMP3.1可以将胞外的Cd转运到胞内,但其是否具有转运Fe和Mn的功能还有待进一步探究。另外,GUS活性分析显示Fe缺乏可同时显著提高地上和地下部中AtNRAMP3和AtNRAMP4基因启动子的活性[31, 33]。本研究发现缺Fe处理可显著提高NtNRAMP3.1基因在根中的表达,但抑制了其在地上部分表达;过量的Fe处理可同时抑止NtNRAMP3.1基因在地上和地下部的表达。可见,在转录水平上,NtNRAMP3.1基因对Fe的响应与AtNRAMP3和AtNRAMP4具有一定差异。此外,NtNRAMP3.1基因的表达还受到Mn处理的调控,虽然其内在机制目前还不清楚。
将目的基因转化到野生型或突变体酵母中并进行表型观察是快速鉴定重金属转运蛋白金属底物的有效方法。本研究利用该方法发现烟草NtNRAMP3.1蛋白是Cd的转运蛋白,异源表达NtNRAMP3.1基因可增强酵母对Cd的敏感性。水稻OsNRAMP1被证明是Cd的转运蛋白,经Cd处理的转OsNRAMP1基因的酵母中的Cd含量是对照细胞中的1.4倍[34]。为了进一步探究烟草NtNRAMP3.1蛋白增强酵母Cd敏感性的原因,我们检测了酵母细胞中Cd的含量,发现含有烟草NtNRAMP3.1的酵母细胞中Cd积累量显著高于对照组,暗示烟草NtNRAMP3.1是在Cd的流入(influx)而非流出(efflux)中发挥作用。此外,我们还发现Cd处理可显著增加NtNRAMP3.1基因在烟草地上和地下部的表达。这些结果暗示烟草NtNRAMP3.1可能在烟草Cd吸收转运中具有重要功能。
4 结 论
本研究从烟草中克隆到了NRAMP的同源基因NtNRAMP3.1,该基因具有NRAMP基因家族的典型结构。NtNRAMP3.1基因的表达具有组织特异性,且受Cd诱导;在酵母中异源表达NtNRAMP3.1可增加酵母对Cd的敏感性,这些结果暗示NtNRAMP3.1是Cd的转运蛋白。此外,NtNRAMP3.1基因的表达还受到Mn、Zn和Fe的调控,但其中的分子机制目前还不清楚,有待进一步探索。本研究结果可为深入了解烟草NtNRAMP基因家族在金属离子吸收转运中的功能,以及利用现代生物技术培育Cd低积累的烟草品种提供理论依据。
