丁烯基多杀菌素高产菌株的选育和改造策略
2022-03-03王靖楠庞建秦磊郭超吕波李春王超
王靖楠,庞建,秦磊,郭超,吕波,李春,,王超
(1 北京理工大学化学与化工学院生物化工研究所医药分子科学与制剂工程工信部重点实验室,北京 100081; 2 清华大学化学工程系生物化工研究所,北京 100084; 3 国家粮食和物资储备局科学研究院粮油加工研究所,北京 100037)
引 言
虫害对农作物生产及粮食贮存危害极大,近年我国虫害发病率逐年上升,对农业生产和粮食安全造成严重威胁。目前我国主要通过化学农药控制虫害,难以满足绿色农业要求,损害环境和人类健康,农药减量增效势在必行,开发绿色安全高效的新型生物杀虫剂成为保障我国农业安全的迫切需求。
多杀菌素类生物杀虫剂杀虫谱广且残留低,在自然环境中主要被光降解,其在土壤、叶面、水中光降解半衰期分别为10 d、1.6 d、小于1 d[1]。丁烯基多杀菌素可杀灭多杀菌素难以控制的苹果蠹蛾、烟青虫、马铃薯甲虫等害虫,对靶标昆虫表现出摄食和触杀毒性[2],在生物农药领域应用前景广阔,但其产量达不到工业生产要求。
丁烯基多杀菌素与多杀菌素结构相似,其生产菌同属于糖多孢菌属,具有相近的亲缘关系,本文借鉴了多杀菌素高产菌株的选育策略,从诱变选育及基因工程育种方面介绍了当前可用于丁烯基多杀菌素高产菌株选育的方法。
1 丁烯基多杀菌素
1.1 丁烯基多杀菌素结构及命名
丁烯基多杀菌素主要由三部分构成,糖苷配基和两侧的糖基,糖基一般为福乐糖胺基团和鼠李糖基团,由于须糖多孢菌糖基转移酶的杂泛性,使得丁烯基多杀菌素的C17位还可连接除福乐糖胺及其异构体的其他中性基团[3]。丁烯基多杀菌素与多杀菌素结构的主要区别为:①内酯环可以是十四元大环;②C8 可被羟基化;③C17 可连接除福乐糖胺的其他中性糖;④C21 是丁烯基[3]。乙基多杀菌素(spinetoram)由多杀菌素(主要成分为spinosyn A 和spinosyn D,一般将二者合称为spinosad)化学半合成而来。上述结构式如图1所示。
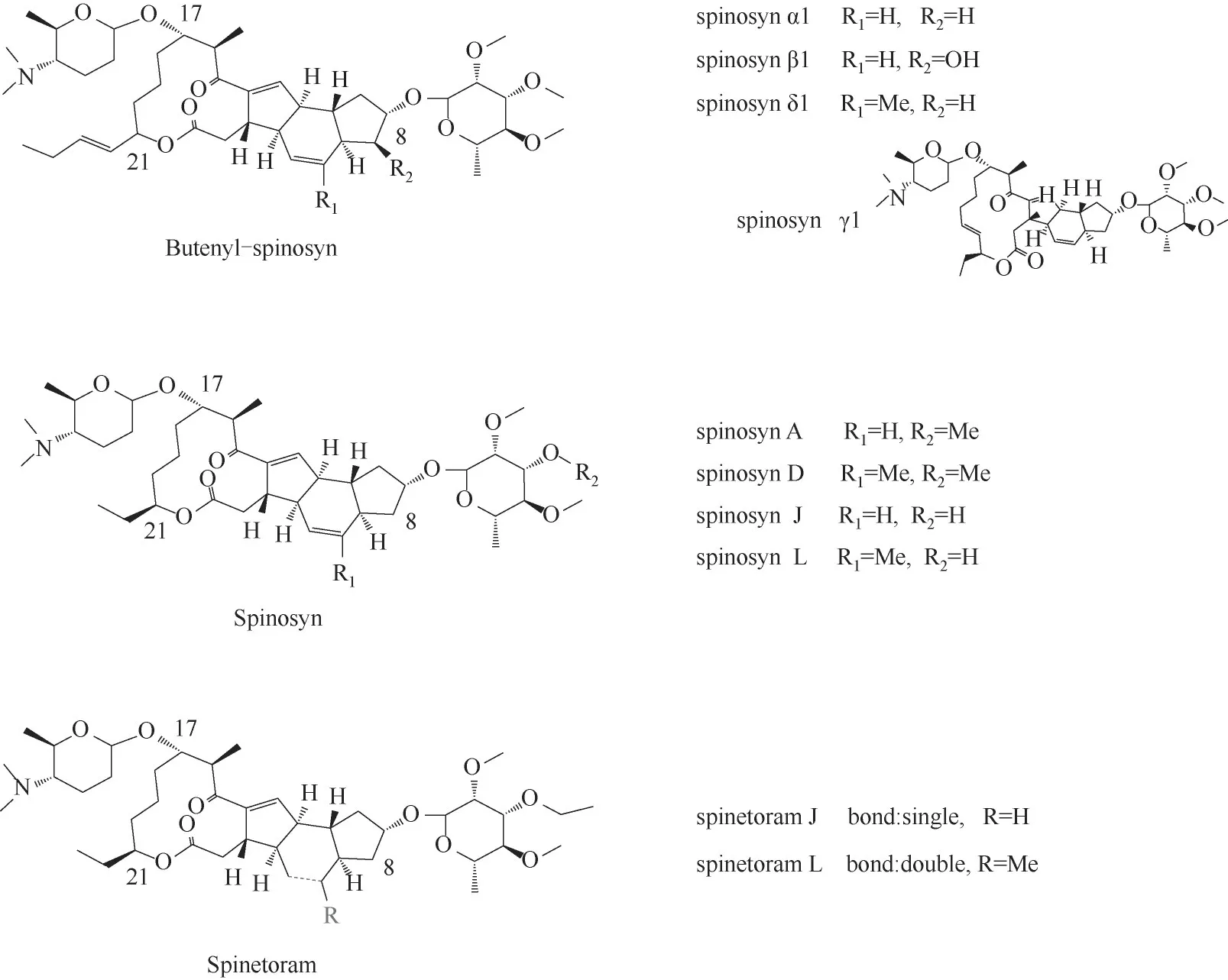
图1 丁烯基多杀菌素、多杀菌素、乙基多杀菌素的化学结构Fig.1 Chemical structure of butenyl-spinosyn,spinosyn and spinetoram
1.2 丁烯基多杀菌素生产菌株
1990 年研究者从美国印第安的土壤样本中筛选获得了菌株NRRL30141,其发酵产物中含30多种不同结构的丁烯基多杀菌素,该菌株在电镜下呈现明显的毛刺特征,被命名为须糖多孢菌[3],分类学上属于:细菌界,放线菌门,放线菌纲,假诺卡氏菌目,假诺卡氏菌科,糖多孢菌属[4]。郭超等[5]从中国浙江土壤中筛选到的SaccharopolysporaASAGF 58 可产丁烯基多杀菌素,该菌株具有生长速度快、营养需求简单且产孢丰富的特点。
1.3 杀虫机理
美国密歇根州立大学的节肢动物抗药性数据库(APRD)数据表明,30 种昆虫已对多杀菌素产生抗性,6 种昆虫对乙基多杀菌素产生抗性[6]。研究表明,多杀菌素通过与烟碱型乙酰胆碱受体(nAChRs)和γ-氨基丁酸受体(GABARs)相互作用引起昆虫神经系统快速兴奋,昆虫因肌肉震颤疲劳而死;关于GABARs 的机理尚不清晰,可能是多杀菌素与其结合影响了氯离子通道[7]。现已在注释的昆虫基因组中发现了十多种nAChRs 亚基(图2),这些亚基可以协同组装成具有不同功能的同五聚体或异五聚体,不同的杀虫剂对于亚基的结合选择或结合位点不同,因此也造成了不同的杀虫效果[8]。由于杀虫剂过度使用,越来越多有害昆虫对其产生了抗药性,通过提高使用间隔期及交替使用无交叉抗性杀虫剂可延缓抗药性产生[9]。
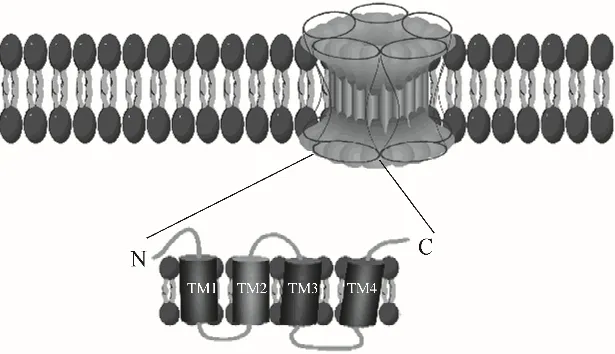
图2 nAChRs示意图[8]Fig.2 Schematic diagram of nAChRs[8]
大部分研究认为多杀菌素类物质只对部分昆虫具有毒性,对脊椎动物几乎无影响。然而近期有研究表明:多杀菌素可对鼠、猴等哺乳动物产生细胞毒性[10],乙基多杀菌素可抑制人肝细胞的增殖并诱导DNA 氧化损伤[11],目前尚未见丁烯基多杀菌素对哺乳动物有毒性的报道。
2 诱变选育高产菌株
性能良好的菌株是实现工业化生产的前提,为提高多杀菌素及其结构类似物生产菌的性能,大量研究人员通过紫外(UV)诱变、60Co 辐射诱变等物理诱变方式及N-甲基-N′-硝基-N-亚硝基胍(MNNG)诱变、亚硝基胍(NTG)诱变、甲基磺酸乙酯(EMS)诱变等化学诱变方式使菌株基因组产生大量的突变位点,一些新型诱变技术也被开发,如:常压室温等离子体(ARTP)诱变、多功能等离子体(MPMS)诱变、N+离子注入诱变、航空搭载育种、转座诱变等。单一诱变方式的基因突变类型较少,增加突变概率的复合诱变方式可以很好地解决这一问题。此外,通过原生质体融合使基因组重排来富集正向突变成效显著(表1)。
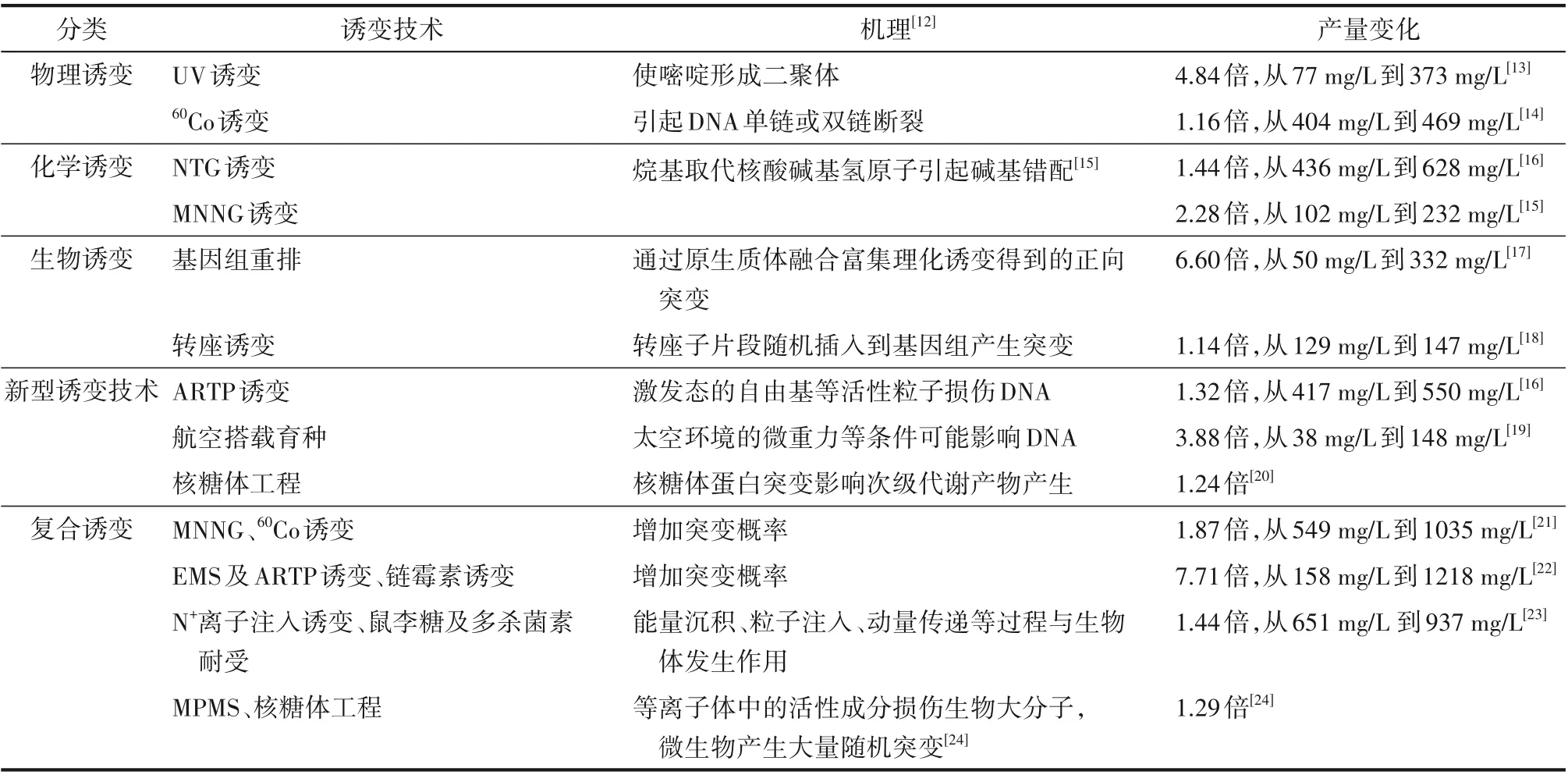
表1 多杀菌素高产菌株的诱变选育方法Table 1 Mutation breeding method to high-yield strains of spinosyn
从基因组层面来看,诱变会为菌株基因带来大量突变,包括插入、缺失和单核苷酸变异[25],这些非理性变异经过理性筛选即可能得到目标性状菌株。有研究者为探究诱变刺糖多孢菌提产多杀菌素的分子机制,将诱变得到的高产菌株与出发菌株做比较组学分析,均发现高产菌株的碳代谢发生显著变化。Zhang 等[26]通过转录组学分析发现高产菌株糖酵解途径增强,丙酮酸脱氢酶表达量降低,脂肪酸β-氧化途径、酮酰基合成途径和酰基转运途径上调。Zhao等[27]通过代谢组学分析发现高产菌株初级代谢明显加强,乙酰辅酶A 显著积累。Xia 等[28]通过蛋白质组学分析发现诱变高产菌株初级代谢相关蛋白质表达量下降,与聚酮前体合成相关的蛋白质表达量上升。以上研究均证明了诱变产生的高产菌株具有大量的乙酰辅酶A 积累,为多杀菌素的合成提供足够数量的酰基前体。
然而传统诱变选育方法只以目标产物产量为筛选目标,筛选工作量大。常规的化学检测法(高效液相色谱)[29]难以满足庞大的筛选工作。研究者建立了以蚊子幼虫致死率为靶标的生物测定法[16],结合96孔板发酵培养实现了高通量筛选;利用多杀菌素作为免疫原进行抗体制备,建立了基于ELISA的高通量筛选技术[30-31],但检测结果易受其前体糖苷配基的干扰产生假阳性。
核糖体工程基于突变菌株的抗性筛选标记而建立,降低了筛选压力,其原理为:核糖体蛋白编码基因的一些点突变可以使菌株增强对某些抗生素的抗性,这些抗生素也可能会使得核糖体蛋白发生突变,从而影响次级代谢[32]。然而核糖体工程选育的正向突变率极低,Zhang等[33]设计了一种即插即用的激活次级沉默基因簇方法:通过转入带有目标突变的核糖体蛋白序列的质粒来实现抗性筛选的最终目的,极大地提高了抗性筛选效率。
当前已报道用于须糖多孢菌的诱变方法有:NTG 诱变[29]、核糖体工程(链霉素筛选[32]、巴龙霉素筛选[34]),分别使丁烯基多杀菌素产量提升至1.87倍、2.20倍、1.80倍。未来研究者可借鉴刺糖多孢菌诱变提产多杀菌素的经验,使用更加多元的诱变方法得到性状优良的须糖多孢菌。
3 基因工程改造生产菌株
丁烯基多杀菌素与多杀菌素合成途径相似,涉及23 个基因,其相关序列具有94%的同源性,主要区别在于busA比spnA多5244 bp(图3),其负责在C21 尾部形成“丁烯基”而非乙基[35]。丁烯基多杀菌素生物合成途径的19个基因都位于一个79 kb基因簇中:busA~E编码聚酮合酶(PKS)形成大环内酯结构,busF、busJ、busL、busM使大环内酯分子形成交联桥,busG、busK、busI、busH用于鼠李糖的添加及甲基化,busO、busN、busQ、busR、busS、busP用于福乐糖胺基团的合成和添加;鼠李糖生物合成的4 个基因(gtt、gdh、epi、kre)分布于其他三个不同区域[36],生物合成途径如图4所示。当前须糖多孢菌的基因工程改造研究较少,为提升丁烯基多杀菌素产量,可借鉴多杀菌素研究经验,未来可用的基因工程改造策略主要有:代谢流调控、途径基因调控、转录调控和异源生物合成。
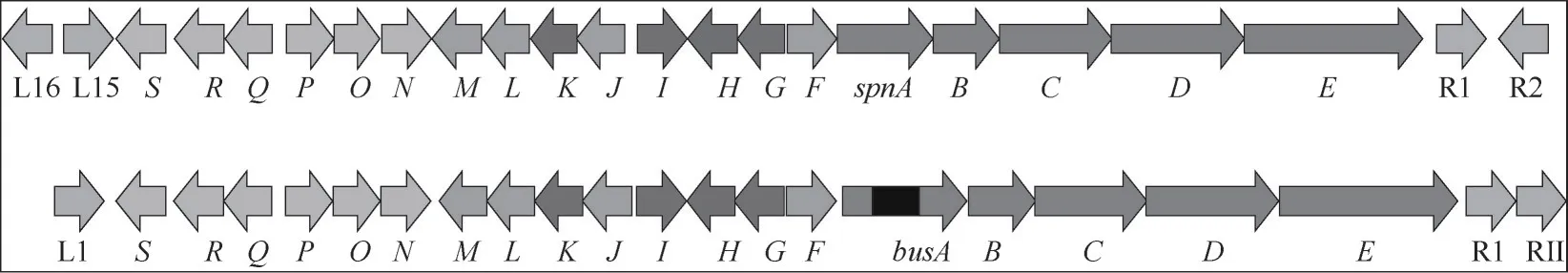
图3 多杀菌素(上)和丁烯基多杀菌素(下)生物合成基因簇对比简图Fig.3 Comparison of spinosyn(up)and butenyl-spinosyn(down)biosynthetic gene clusters
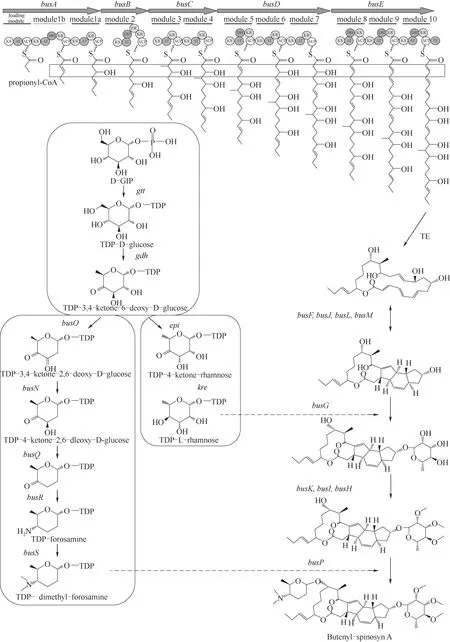
图4 丁烯基多杀菌素生物合成途径Fig.4 Biosynthesis pathway of butenyl-spinosyn
3.1 代谢流调控
多杀菌素及其结构类似物的生物合成由两部分构成,即聚酮链合成和糖基修饰,聚酮链以丙酸为起始,由丙酰辅酶A、丙二酰辅酶A 等作为直接前体合成聚酮链;侧链的鼠李糖基团和福乐糖胺基团由共同前体葡萄糖1 磷酸经多步反应形成(图5)。调控代谢流可使前体更多地流向目标产物合成。
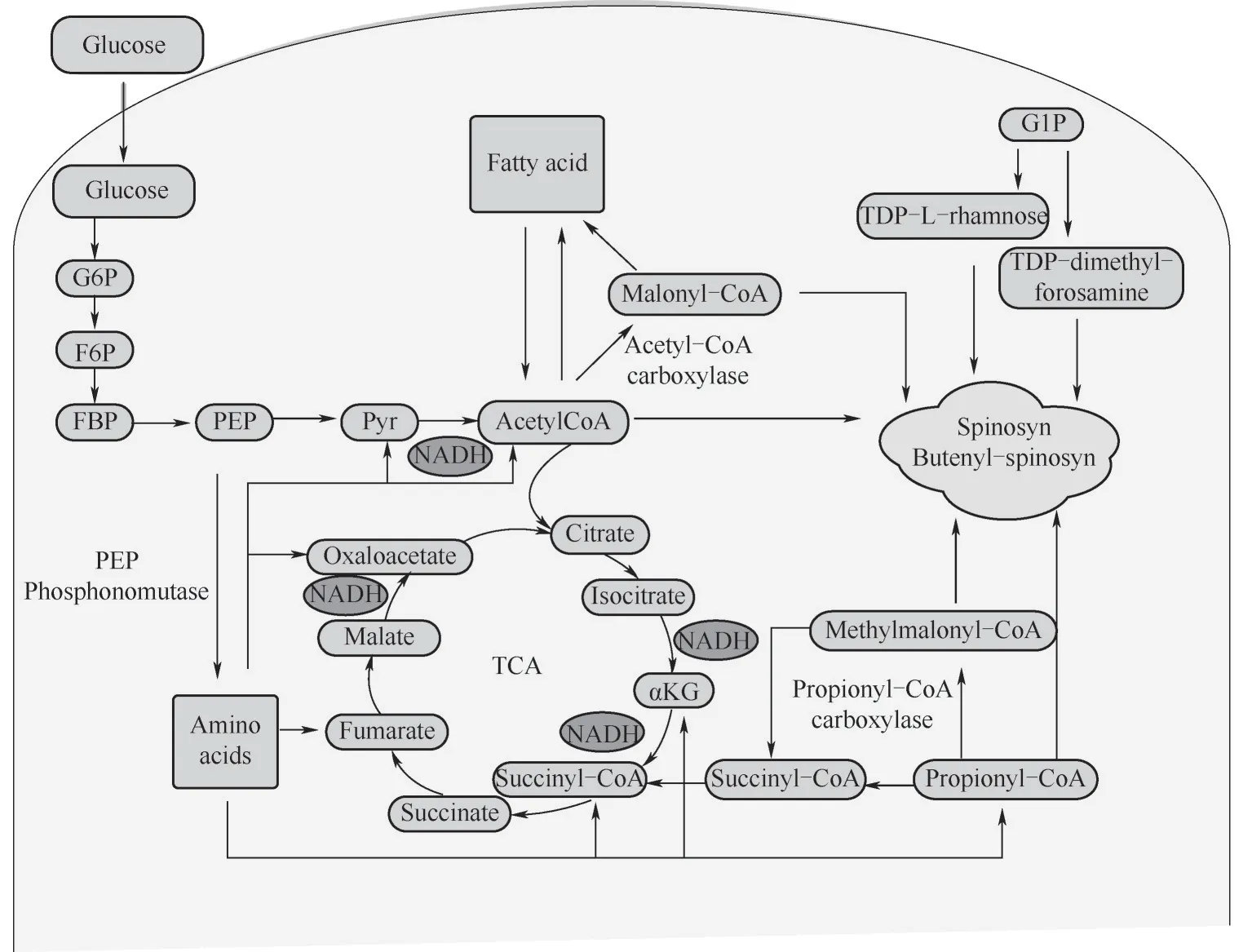
图5 多杀菌素及丁烯基多杀菌素代谢网络Fig.5 Metabolic network of spinosyn and butenyl-spinosyn
有研究表明诱变得到的高产菌株相比于野生菌株具有更高的初级代谢水平,这说明提高初级代谢可能增强次级代谢[37],乙酰辅酶A 这一初级代谢物对于多杀菌素及其结构类似物的合成至关重要[38],可通过一系列代谢调控策略提高乙酰辅酶A含量。Liu 等[39]通过分析转录组数据敲除了PEP(磷酸烯醇式丙酮酸)膦酰基转移酶基因使多杀菌素产量提高2倍,该基因的敲除导致丙酮酸积累,进而增加多杀菌素生物合成前体;该课题组[40]还过表达了可能影响乙酰辅酶A 合酶活性的脱乙酰化基因acuC,多杀菌素产量提升近2倍。Huang 等[41]过表达了脂肪酸β 氧化相关的乙酰辅酶A 合成酶基因fadD1及脱氢酶基因fadE,增加了乙酰辅酶A 含量,使多杀菌素产量提升50%。
夏立秋团队在刺糖多孢菌中过表达了环腺苷酸受体蛋白编码基因crp,破坏了亮氨酰氨肽酶编码基因PepA,阻断了磷酸甘露酶编码基因manB,敲除了谷氨酰胺合成酶编码基因glnA,这些基因影响碳氮代谢流向,多杀菌素产量分别提高28%、22%、80%和70%[42-45]。在须糖多孢菌的研究中,夏立秋等敲除参与核糖及氨基酸代谢的GDP-岩藻糖合成酶基因fcl,丁烯基多杀菌素产量提升30%[46];过表达铁储存调节基因bfr,使菌体对于铁的利用度增强、菌密度增高、酰基辅酶A含量增加,丁烯基多杀菌素产量提升3 倍[47]。此外还使用精简基因组的策略,建立latour 系统敲除旁路杂合NRPS-T1PKS 基因簇(20 kb),使底物最大化流向目标产物,丁烯基多杀菌素总产量提升4.72倍[48]。
数据模拟预测细胞信息是一种前景广阔的方法。Wang 等[49]基于基因组信息、文献资料及实验数据建立了刺糖多孢菌基因组尺度代谢网络重构(GSMR)模型,经模型计算选择了转氢酶作为潜在目标,过表达转氢酶基因PntAB使得多杀菌素产量提高86%,这可能是由于转氢酶保持了细胞还原力(NADPH/NADH)的平衡。
由此可见,乙酰辅酶A 这一前体物质对于丁烯基多杀菌素的合成至关重要,后续研究可有目标地提高这一前体物质积累,可测定乙酰辅酶A 在发酵期的变化情况,从而加强对菌株代谢特性的了解;多数次级代谢产物提产的菌株被证明碳氮代谢流的流向发生改变,改变培养基成分或构建基因工程菌来引导代谢流向丁烯基多杀菌素合成是必要的;大数据预测及模拟已渗透到基础研究的方方面面,其可大大降低实验人员的工作量,为研究者提供可参考的预测,减少试错工作,提高研究效率。
3.2 途径基因调控
多杀菌素及其结构类似物合成步骤较多,途径基因表达不足是多杀菌素产量低的主要原因。张晓琳等[50]将多杀菌素合成基因簇上的19 个基因按照转录方向分为9 个转录子,分别以转录子内的一个基因为代表分析了高产菌株和低产菌株的各转录子表达水平,发现结构基因的表达量均有上升,尤其是spnM、spnJ-K-L、spnG-H、spnF和spnA-B-CD-E转录子有了很大幅度的上升,这表明过表达途径基因可提高多杀菌素产量,且聚酮合酶基因(busA~E)、交联桥基因(busJ、busF、busL、busM)、鼠李糖添加及甲基化基因(busG、busH、busI、busK)可能是限速步骤。
目前关于多杀菌素的研究表明:提高鼠李糖合成相关酶、糖基转移酶和糖基甲基化酶可大大提升多杀菌素的产量,研究者过表达了gtt、gdh、kre、spnS、spnQ、spnN、spnO、spnP、spnR和spnK基因提产3.9倍[51],过表达除spnA~E外的其他相关编码基因提产2.9倍[52],过表达gtt和gdh基因提产近2倍[53],过表达S-腺苷蛋氨酸合成酶基因metK1提产53%[24]。
Rang 等[54]对比了须糖多孢菌与刺糖多孢菌的蛋白组学和代谢组学后,发现参与丁烯基多杀菌素生物合成的蛋白质总体丰度很低,通过过表达鼠李糖合成相关基因(gtt,gdh,epi,kre)和蛋氨酸腺苷转移酶基因metK,使丁烯基多杀菌素产量分别提高2.7倍和3.0倍。后续可借鉴多杀菌素的研究经验过表达其他途径基因,尤其是聚酮合成基因,它是丁烯基多杀菌素合成的基础。
3.3 转录调控
基因的表达水平会受转录因子调控,包括途径特异性转录调控因子和全局转录调控因子,目前还未发现特异性调控多杀菌素及其结构类似物生物合成的基因。
当前已报道的丁烯基多杀菌素相关研究大多集中在转录因子工程方面,虽无特异性调控因子,但经过组学分析均发现全局转录因子的调节改变了菌株代谢流分布。夏立秋课题组[55-61]近年来在须糖多孢菌中调控了多个全局转录因子并得到了较好结果(表2)。
3.4 异源生物合成
须糖多孢菌生长缓慢、遗传背景不够清晰,基因工程策略受限于低的外源基因转化效率和基因编辑效率,采用合适的异源宿主来生产多杀菌素及其结构类似物可以避开这一瓶颈,同样属于放线菌的链霉菌被认为是异源生产天然次级代谢产物的理想宿主。链霉菌中含有许多合成次生代谢物的途径,因此它们拥有合成目标天然产物的必需元素,对生物活性天然产物也有很强的耐受性,此外,很多可用的基因编辑系统在链霉菌中被成功开发,这使得在链霉菌中合成目标天然产物成为可能[62-63]。
Song 等[64]创建了RedEx 方法实现将busA中相比于spnA多余的5.3 kb 基因无缝插入spnA,经基因簇优化在Streptomyces. albusJ1074 异源表达后得到了2.36 mg/L 丁烯基多杀菌素A,这也证明了多杀菌素的生物合成途径也能用于丁烯基多杀菌素的合成。
当前研究者已成功在Streptomyces albusJ1074、Streptomyces coelicolorM145、Streptomyces lividansTK24和Saccharopolyspora erythraea中实现了多杀菌素的异源合成(表3)。其中,Song 等[67]创造性地将23 个生物合成基因分成7 个操纵子,分别利用组成型启动子表达,最终实现了多杀菌素异源合成;Huang等[69]采用同为糖多孢菌属的Sa.erythraea作为异源表达宿主,将红霉素合成途径PKS 替换为了多杀菌素合成途径的PKS,最终实现了多杀菌素高产,这可能归功于选择了与原生产菌株亲缘关系较近的宿主。
由此可见,选择合适的异源表达宿主及快捷高效的长片段基因克隆方法对目标产物的合成至关重要。
4 展 望
丁烯基多杀菌素这一绿色生物农药具有广阔的应用前景,尚需选育高产菌株提升其产量。然而当前研究还存在以下问题:传统的诱变方法具有一定的随机性,当前筛选通量难以满足庞大的筛选工作;精准的基因工程方法受限于低的遗传操作效率;大型次级基因簇在实验室环境下表达较弱。
针对以上问题,开发适用的高通量筛选方法,建立自动化筛选平台,可大幅度减少工作量、缩短获得高产菌株进程;探索须糖多孢菌基因转化及编辑低效的原因,选择并优化基因编辑方法,对底盘宿主进行改造,开发内源基因编辑系统,缩短基因操作周期,加速基因工程育种;现有实验室培养条件无法再现原生态环境条件,大多数次级代谢产物的生物合成基因簇表达较弱,且这些基因簇一般较大,可通过共培养及激活分子增加培养环境适合度、调节全局或特异性调节因子的表达、重构途径基因簇及异源表达等策略激活大基因簇[70],实现次级代谢产物产量的大幅提升。
转录组学、蛋白质组学、代谢组学等的发展为揭示须糖多孢菌低产丁烯基多杀菌素的原因带来了大量信息,如何快速抓取有效信息成为一大难题。在合成生物学和计算机模拟的指导下,研究者已经在提高多杀菌素产量及发现新化合物上取得了较大的进步,如基于人工智能的定量构效关系直接导致了乙基多杀菌素的发现,计算机辅助模拟与设计推动了一系列模拟物的发现与构建[71],但当前大多数实验室的工作效率难以匹配庞大的数据信息,大数据分析及全自动化工作平台成为引领研究方向的必要组成部分。
