原代黄素化卵泡颗粒细胞氧化应激模型的建立与评价
2022-03-01邢鹏袁博王娜李澎涛孟娜娜
邢鹏,袁博,王娜,李澎涛,孟娜娜
颗粒细胞作为卵泡的基本组成单位,在调控卵泡生长[1]、排卵和诱导窦卵泡凋亡[2]中起着关键性作用。由于颗粒细胞代谢旺盛致代谢产物的堆积,以及不良生活方式,如熬夜、饮酒等,都会导致氧化和抗氧化系统的失衡,形成氧化应激损伤[3]。氧化应激诱导脂质过氧化,从结构和功能上改变蛋白质和DNA功能,并促进细胞凋亡。颗粒细胞的氧化应激与女性生殖系统多种疾病有关,如多囊卵巢综合征(polycystic ovary syndrome,PCOS)[4]、子宫内膜异位症(endometriosis,EMT)[5]和原发性卵巢功能不全(premature ovarian insufficiency,POI)[6]等。由于人卵巢原代颗粒细胞获取方法困难、培养条件苛刻及传代培养时间长等问题,较难构建稳定的细胞模型。既往,有学者通过不同浓度过氧化氢(H2O2)处理人卵巢颗粒肿瘤细胞(COV434)建立了氧化应激模型[7],但是由于肿瘤细胞固有的特性,其实验结论并不能完全反映生理细胞的特性。因此,构建稳定的原代黄素化卵泡颗粒细胞氧化应激细胞模型,是进一步开展卵巢氧化应激研究及筛选抗氧化药物所需要的[8-9]。本研究通过H2O2诱导,探讨是否可以建立稳定的人原代黄素化卵泡颗粒细胞氧化应激模型。
1 材料与方法
1.1 主要试剂
3% H2O2于美国Sigma,DMEM/F12培养液、胎牛血清购自美国Gibco,红细胞裂解液、Percoll细胞分离液、碘化丙啶试剂盒均购自北京Solarbio,CCK-8试剂盒购于日本同仁,丙二醛、总超氧化物歧化酶测定试剂盒购自南京建成生物工程研究所,雌二醇(estradiol,E2) ELISA试剂盒购自武汉Elabscience。
1.2 颗粒细胞收集
收集2019年10月至12月于保定市妇幼保健院生殖医学科,行体外受精-胚胎移植患者取卵后废弃的卵泡液。本研究获得保定市妇幼保健院伦理委员会批准,所有参与研究的患者均知情同意并签署知情同意书。
1.2.1 纳入与排除标准 选择年龄<35岁的输卵管性不孕或男方精子因素不孕患者,同时排除:① 卵巢低反应[10];② PCOS;③ EMT;④ 各种类型的卵巢肿物[11]的患者。
1.2.2 细胞分离与培养 将收集到的卵泡液置入50 mL离心管,400 g离心10 min弃上清,沉淀用磷酸缓冲盐溶液(phosphate buffer saline,PBS)重悬,缓慢加入50% Percoll单层密度梯度离心液上层,400 g离心25 min。离心后,液体共分四层,从下到上依次为:红细胞层,透明Percoll液层、白色絮状颗粒细胞层、淡黄色上清液层。收集颗粒细胞层,红细胞裂解液裂解红细胞,沉淀用PBS重悬,加入等体积0.25%胰蛋白酶+EDTA,37℃消化10 min。400 g离心5 min,弃去上清,将细胞接种于培养液[含15%胎牛血清(fetal bovine serum,FBS)]、1%青-链霉素的DMEM/F12培养液,置入37℃ 5% CO2的培养箱(以下简称培养箱)中上层。培养24 h后观察细胞贴壁情况[12]。培养5~6天细胞汇合度达到80%以上,开始建立氧化应激损伤模型,所有实验均重复3次。
1.3 颗粒细胞氧化损伤模型的建立
1.3.1 采用最大半数抑制浓度(half maximal inhibitory concentration,IC50)来建立颗粒细胞氧化损伤模型。
1.3.2 取1.2.2培养后的颗粒细胞,经消化、计数后,以105/mL的浓度,每孔100 μL,均匀接种于96孔板,每组设6个复孔。培养24 h后细胞贴壁,吸去孔内培养液,加入用无血清培养液倍数稀释的H2O2(5 μmol/L、10 μmol/L、20 μmol/L、40 μmol/L、80 μmol/L、160 μmol/L、320 μmol/L)100 μL,以无血清培养液为阴性对照组,以PBS为空白组。放入培养箱培养12 h后,吸去培养液,每孔加入新培养液100 μL和CCK-8 10 μL, 继续培养4 h。在波长为450 nm酶标仪上测定吸光度(Optical Density,OD)值,计算细胞存活率。
1.3.3 利用GraphPad Prism 5.0软件计算IC50。
1.4 颗粒细胞氧化损伤模型的验证
1.4.1 实验分组 以IC50浓度的H2O2处理汇合后的颗粒细胞12 h,作为模型组;以未加H2O2的颗粒细胞,作为对照组。
1.4.2 采用硫代巴比妥酸(thiobarbituric acid,TBA)法测定丙二醛(malondialdehyde,MDA)含量和WST-1法测定超氧化物歧化酶(superoxide dismutase,SOD)水平 收集实验后细胞经超声波细胞粉碎机破碎,漩涡混匀。按照BCA(bicinchoninic acid)蛋白浓度测定试剂盒说明书测定细胞匀浆液中蛋白浓度。按MDA和SOD试剂盒操作,应用酶标仪分别在532 nm处测定ODMDA值和450 nm处测定ODSOD值,并计算MDA含量和SOD水平。
1.4.3 竞争ELISA法测定E2分泌量 分组实验结束后,更换新鲜的含浓度为12 ng/mL的r-FSH(Gonal-F)的培养液,继续培养24 h。1 500 g离心10 min,取上清液。按E2试剂盒操作,应用酶标仪在450 nm处测定ODE2值,用标准曲线计算培养液中E2的浓度。
1.4.4 流式细胞仪分析细胞周期 收集两组颗粒细胞,经胰酶消化后收集单个细胞,用预冷的PBS洗涤。75%酒精4℃固定4 h,500 g离心10 min,去上清。预冷PBS洗涤后,每管加入400 μL PI(50 μg/mL),100 μL RNase(100 μg/mL)轻柔旋涡混均后,4℃避光孵育30 min。流式细胞仪检测,利用ModFit LT 3.1软件分析细胞周期分布。
1.5 统计学分析
2 结果
2.1 细胞生存曲线
随着H2O2浓度的增加,人卵泡颗粒细胞的存活率呈对数下降。根据不同浓度H2O2与颗粒细胞的存活率,绘制细胞生存曲线(见下页图1)。所得IC50值为65.72 μmol/L,95%CI(60.98-70.84)。使用IC50浓度H2O2=65 μmol/L,建立颗粒细胞氧化损伤模型。
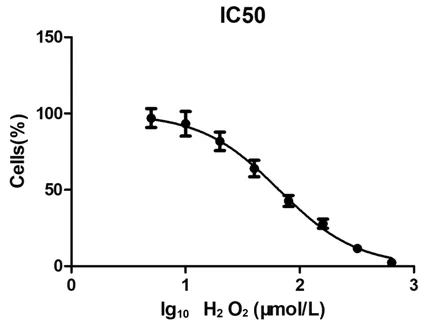
图1 细胞生存曲线
2.2 两组颗粒细胞形态的光镜观察结果
图2A所示为模型组,可见卵泡颗粒细胞的细胞核核仁不明显,细胞的体积变形等早期凋亡形态,及凋亡小体和细胞膜发泡现象等凋亡晚期的形态。图2B所示为对照组,可见卵泡颗粒细胞呈多突状生长,细胞间有伪足相连,细胞核圆形、较大,核仁明显,胞浆内可见丰富的颗粒。
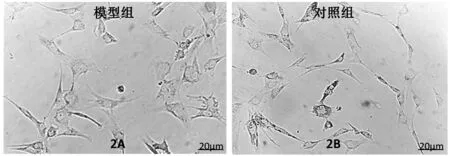
图2 光镜下两组颗粒细胞的形态特点(20 μm)
2.3 两组颗粒细胞MDA含量、SOD水平及E2分泌量比较
与对照组相比,模型组细胞MDA含量升高,SOD水平降低,E2分泌量降低,差异均有统计学意义(P<0.05),详见表1。
表1 两组颗粒细胞存活率、MDA含量及SOD水平的比较
2.4 两组颗粒细胞细胞周期的比较
与对照组相比,模型组的凋亡峰(sub G1)明显增高[模型组vs对照组:(30.48±4.19) vs (7.14±3.84),t=12.321,P<0.001],而G1期[模型组vs对照组:(35.99±3.45) vs (47.06±6.09),t=4.742,P<0.001]和G2期[模型组vs对照组:(9.12±3.95) vs (17.81±4.82),t=4.178,P=0.001]细胞数量均明显降低,S期两组细胞数量无差异[模型组vs对照组:(24.40±4.01) vs (27.99±3.62),t=1.996,P=0.063],见图3。
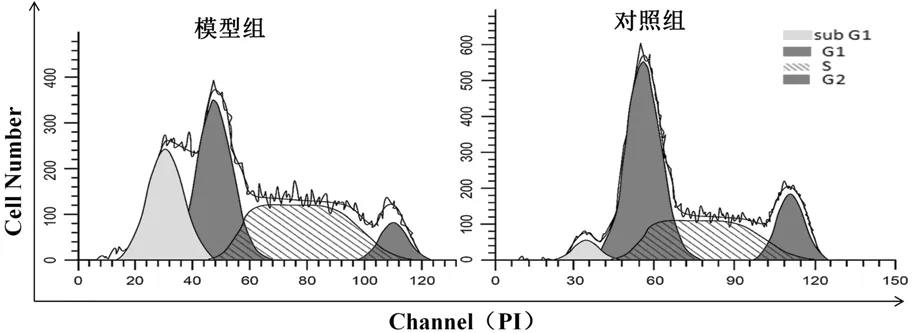
图3 两组颗粒细胞的细胞周期
3 讨论
原代颗粒细胞来源于接受体外受精/卵胞浆内单精子显微注射技术治疗的患者,这些细胞在超生理剂量的促卵泡生成素(follicle stimulating hormone,FSH)和人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)的刺激下,通常在获得时已经黄素化,它们在体外的寿命有限,且新鲜制备的细胞缺乏对hCG一致性的反应,在短期培养细胞中亦对FSH缺乏反应性,因此,利用人类颗粒细胞的原代培养物进行研究比较困难[13]。有研究发现,通过长期培养的颗粒细胞能够重建对FSH刺激的反应性,在FSH和hCG共同处理下,E2和孕酮的分泌量明显增加[14]。本实验经过多轮尝试与摸索,并查阅大量其他人的基础实验结果,通过观察细胞的融合生长状态和测定细胞的孕酮分泌功能的恢复情况,我们通过增加铺板密度和延长培养时间至6天左右,这样既能保证颗粒细胞的生长汇合,又能使经过过度刺激的黄素化-颗粒细胞恢复内分泌功能。
H2O2属强氧化剂,一定浓度下可对细胞造成氧化应激和氧化损伤,已经有多种H2O2诱导的细胞氧化应激模型建立成功[15-16]。本研究通过给予不同浓度H2O2作用颗粒细胞12 h后,计算IC50浓度建立颗粒细胞氧化应激模型。活性氧攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化反应,氧化终产物为高活性的醛基化合物MDA[17]。SOD是一种抗氧化金属酶,它能够催化超氧阴离子自由基歧化生成氧和H2O2,体内的过氧化氢酶将其分解为水,从而保护细胞免受氧化应激。膜损伤的最终结果将导致细胞凋亡、坏死,进而导致颗粒细胞的分泌功能受损[18]。
本研究结果显示,H2O2作用12 h后,MDA含量上升、SOD水平下降,说明颗粒细胞氧化损伤程度增高,而细胞修复损伤的能力下降。经过FSH刺激后,卵泡颗粒细胞分泌E2的量明显较对照组下降,说明细胞的内分泌功能受损。细胞周期分析显示:凋亡的sub G1峰升高,而G1/G0期和G2/M期均下降,说明随着细胞凋亡峰的增高,DNA发生损伤,细胞周期将不能通过DNA损伤监测点[19],从而不能进入下一分裂时相,因此G1期、G2期均被延迟。以上指标表明H2O2诱导的人黄素化卵泡颗粒细胞的应激损伤模型建模成功,这与其他学者的研究基本一致[20-21]。
综上所述,65 μmol/L H2O2处理人卵泡颗粒细胞12 h,细胞氧化应激损伤水平升高,内分泌功能下降,细胞凋亡增加而分裂减少。因此,建立了稳定的颗粒细胞氧化应激损伤模型,为进一步开展颗粒细胞抗氧化研究提供了细胞模型。
