牦牛酥油贮藏期间脂肪酸和健康评估指数变化
2022-02-25杨静梁琪宋雪梅张炎
杨静,梁琪*,宋雪梅,张炎
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070)2(甘肃省功能乳品工程实验室,甘肃 兰州,730070)
乳脂作为某些生物活性脂肪酸天然且唯一的来源,其潜在的益处成为近些年来研究的重点。过去,人们常常将乳脂中的饱和脂肪酸(saturated fatty acids,SFA)与心血管疾病、糖尿病等的发生联系在一起,但近些年的科学研究并不能证明这一点。最近的研究表明,乳制品中饱和脂肪酸与心血管疾病风险之间没有关系[1],甚至有证据表明在典型的饮食模式下食用高脂肪乳制品与这种风险呈负相关[2]。另外,乳脂是人类饮食中共轭亚油酸(conjugated linoleic acid,CLA)和饱和支链脂肪酸(saturated branched chain fatty acids,SBCFA)的主要膳食来源,这些脂肪酸在动物和人类模型中显示出有益的生物学效用,包括阻碍动脉粥样硬化的进程,调节免疫系统等[3]。为评估乳脂对人体健康的影响,现国际上多采用动脉粥样硬化指数(atherogenic index,AI)、血栓形成指数(thrombopoiesis index,TI)、促健康指数(health promotion index,HPI)和低胆固醇血症/高胆固醇血症比率(hypocholesterolemia/hypercholesterolemia ratio,HH)等进行健康评估[4-5],近几年,该评估方法也逐渐被引入到国内。乳脂脂肪酸的组成与多种因素有关。有研究表明,在喜玛拉雅山放牧的牦牛,与以谷物为基础的饲料喂养的奶牛相比,高山牧场放牧的奶牛所产生的乳脂中具有更健康的脂肪酸成分[6]。牦牛酥油作为高原人民主要的食物,其贮藏期可达一年之久。MÉNDEZ-CID等[7]研究发现牛奶黄油在4 ℃贮藏9个月的过程中,C18∶3 n-3、C20∶5 n-3、C22∶2 n-6的含量显著降低,油酸含量为0.95%~1.09%。ERKAYA等[8]研究得出普通牛乳制成的黄油在4 ℃的条件下贮藏60 d,CLA含量在0.71%~0.99%。O′CALLAGHAN等[4]将放牧奶牛所产生的黄油在5 ℃贮藏6个月后发现在这期间其品质相对稳定,并且新鲜黄油的AI和TI分别为3.40±0.38和4.06±0.24。杨静等[9]研究发现,牦牛乳脂中的多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)可作为抗氧因子保护乳脂不被迅速氧化。
贮藏过程中青藏高原牦牛酥油的脂肪酸变化及其营养状况和健康指数评估情况在贮藏过程中的表征至今未见文献报道。本实验分别以青海省海北藏族自治州祁连县和甘肃省甘南藏族自治州的牦牛乳酥油为研究对象,分别测定其在贮藏期5个月内(0个月、1个月、2个月、3个月、4个月、5个月)的脂肪酸组成和含量,探讨酥油脂肪酸在贮藏期内的变化规律及健康指数,为今后牦牛酥油的健康评估奠定基础。
1 材料与方法
1.1 材料与试剂
牦牛酥油分别于2019年7月中旬采自青海省海北藏族自治州祁连县和甘肃省甘南藏族自治州合作市(海拔均在3 000 m左右)。全程冷链运输直至于4 ℃下分别贮藏0、1、2、3、4、5个月,进行脂肪酸分析。
氯仿、甲醇,甘肃易飞仪器科技有限公司;盐酸、乙醚,色谱纯,国药集团化学试剂有限公司;三氟化硼-甲醇溶液,美国Aldrich公司。以上试剂除注明外均为分析纯。
1.2 仪器与设备
GC-MS(6890 N-5973),美国安捷伦科技有限公司;电热恒温水浴锅(HWS26),上海一恒科学仪器有限公司;旋转蒸发仪(RE52-98)、循环水真空泵(SHZ-III),上海亚荣生化仪器厂。
1.3 实验方法
1.3.1 酥油脂肪酸的测定
酥油样品前处理及脂肪酸甲酯化操作步骤按照巨玉佳等[10]的方法,并稍作改进,具体操作步骤如下:
(1)取样,112.5 mL氯仿和37.5 mL甲醇混合液溶解样品,均质,过滤后加入25 mL饱和NaCl溶液,摇匀,放置5 min,出现三氯甲烷相,回收有机相,取下层液,无水硫酸钠脱水,静置,用氯仿-甲醇溶液(体积比3∶1)洗涤无水硫酸钠,抽滤。在40 ℃下旋转蒸发浓缩。
(2)将上步所得的全部溶液加入100 mL 2 mol/L的NaOH-甲醇溶液,在50 ℃水浴15 min,立即加入100 mL 2 mol/L的HCl溶液,将其转入分液漏斗,加入50 mL乙醚,静置,得上层有机溶剂。
(3)取上步所得有机相加入5 mL三氟化硼-甲醇溶液,在60 ℃水浴1 h,冷却后用10 mL乙醚萃取2次,合并萃取液加10 mL蒸馏水再进行2次萃取,取上清液,浓缩后待GC-MS分析。
1.3.2 GC-MS参数
气相色谱条件:气相色谱6 890 N;弹性石英毛细管柱为SE-54(30 m×0.25 mm,0.25 μm);气化室温度250 ℃,程序升温:80~290 ℃,升温程序:80 ℃保持1 min, 以8 ℃/min升至280 ℃,保持30 min;载气:He;载气流量:1.2 mL/min;压力2.4 kPa;线速度:40 cm/s;容积延迟:3 min;进样量:1 μL;分流比:50∶1。
质谱条件:质谱为5 973 N四级杆质谱仪;离子源:电子轰击离子源;离子源温度:230 ℃;传输线温度:150 ℃;离子源电离能:70 eV;质量扫描范围m/z:33~660。
数据分析:各组分经过GC-MS分析,各峰对应的质谱图与数据库对照检索,确定化合物类型,用面积归一化法确定各脂肪酸成分的相对含量。
1.4 健康评估指数

(1)

(2)
(3)
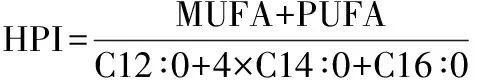
(4)
1.5 数据分析
本实验中所有数据均采用 Excel 和Origin 2019进行处理,各项指标的结果均采用3次重复平均值标准误差(SE)表示,用 SPSS 22.0 进行显著性和相关性分析。
2 结果与分析
2.1 牦牛酥油脂肪酸组成和含量分析
贮藏期间牦牛酥油脂肪酸种类和相对含量处于动态变化的状态。在新鲜海北酥油中共检测出37种脂肪酸,贮藏期结束后共检测出30种脂肪酸(图1);在新鲜甘南酥油共检测出脂肪酸34种,在5个月时共检出脂肪酸32种(图2)。在牦牛酥油中,棕榈酸、油酸、硬脂酸在0~5个月中均以优势脂肪酸存在于整个贮藏期。其中,棕榈酸、油酸、硬脂酸在新鲜海北酥油中的相对含量分别为(31.98±0.13)%、(17.63±0.13)%、(18.41±0.02)%,在甘南新鲜酥油中的相对含量分别为(26.38±1.08)%、(15.80±1.66)%、(17.49±0.16)%。随着贮藏时间的延长,棕榈酸和硬脂酸相对含量没有显著变化(P>0.05),油酸相对含量显著下降(P<0.05),青海和甘南酥油下降率分别为26.5%和22%,这是因为SFA的氧化稳定性要比不饱和脂肪酸(unsaturated fatty acids,UFA)高。由于氧化反应的发生,酥油在贮藏过程发生脂肪酸降解,导致短链醛、酮、醇的生成,脂肪酸与自由基发生反应,通过自氧化反应降解,产生醛和酮作为二次挥发性产物[12],导致脂肪酸含量减少;同时,脂肪酶的脂解反应和脂肪的氢化反应会造成一些脂肪酸相对含量增加[12],氢化通常与微生物的脂质代谢有关,酥油在贮藏过程中,微生物的种类和数量不断变化,其代谢产物也发生着变化,以上2个原因是造成酥油在贮藏过程中各种脂肪酸含量和种类变化幅度较大的主要原因。
ERKAYA等[8]研究了4 ℃ 60 d贮藏期间的黄油,发现其油酸含量贮藏结束时显著下降(P<0.05),本实验中牦牛酥油中油酸的相对含量在贮藏过程中也呈显著下降趋势(P<0.05)。牦牛酥油在5个月时与新鲜酥油相比,其亚油酸的相对含量显著降低(P<0.05),海北酥油亚油酸含量从(0.84±0.02)%降至(0.72±0.03)%,甘南酥油从(1.52±0.00) %降至(1.01±0.01)%。油酸和亚油酸是改善人体健康的脂肪酸,2种脂肪酸相对含量在贮藏期结束后均显著下降,是因为油酸和亚油酸对自氧化的敏感性较高,容易发生氧化反应。两地区酥油中均检测出了反10-C18∶1,在海北和甘南新鲜酥油中其相对含量较高,分别为(8.24±0.17)%、(10.67±0.01)%,该脂肪酸与牦牛日粮相关,如果日粮中油脂含量较高,反10-C18∶1含量增加,反11-C18∶1含量相对减少,这是因为反10-C18∶1会改变反刍动物的生物加氢过程,导致瘤胃中产生更多的反10-C18∶1,之后通过乳腺进入乳脂中[13]。在2种牦牛酥油中均检出了二十二碳五烯酸(docosapentenoic acid,DPA),随着贮藏期的延长DPA的相对含量均显著减少(P<0.05),海北酥油中DPA含量从(0.19±0.02)%降低至(0.12±0.01)%,甘南酥油从(0.12±0.00)%降低至(0.10±0.00)%。DPA能够增加组织中二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)的含量,并且是大量脂质介体的前体物质。有研究表明,DPA不仅促进炎症的消退,而且与其他n-3 PUFA一样,可改善心脏代谢风险标志物,对老年人的神经具有保护作用[14]。花生四烯酸(arachidonic acid,AA)在两地区酥油中均检出,且在贮藏过程中相对含量显著减少(P<0.05),这与MÉNDEZ-CID等[15]的研究结果一致。牦牛酥油脂肪酸种类和含量在不同的贮藏时期变化较大的原因除了以上提及的微生物和氧化反应的影响外,还受其自身所含有的酶的影响,酥油在贮藏各阶段中酶的种类和数量也在不断变化,参与了脂肪酸的动态变化[16]。
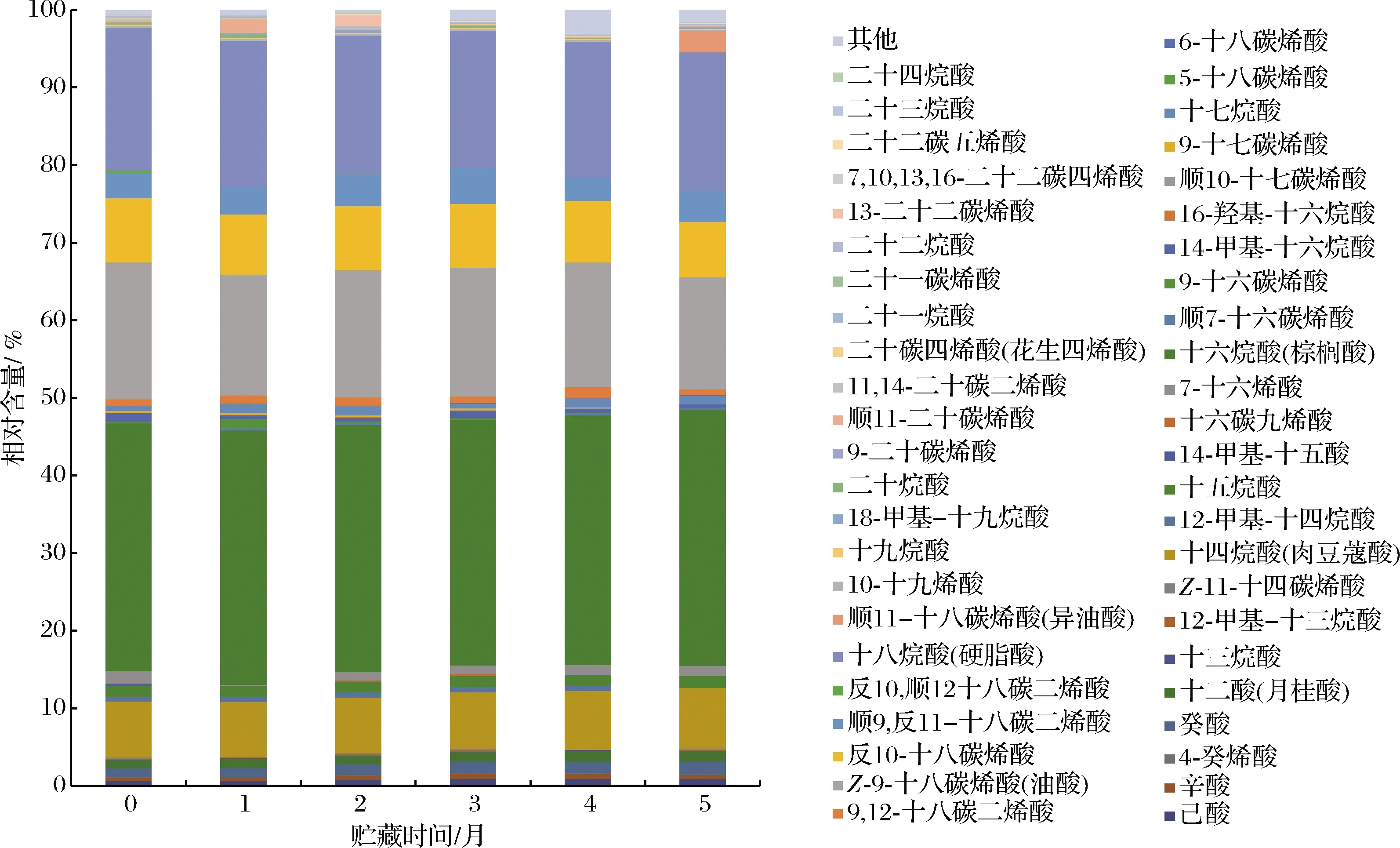
图1 海北酥油贮藏期间脂肪酸组成与相对含量Fig.1 Fatty acid composition and relative content of Haibei ghee during storage
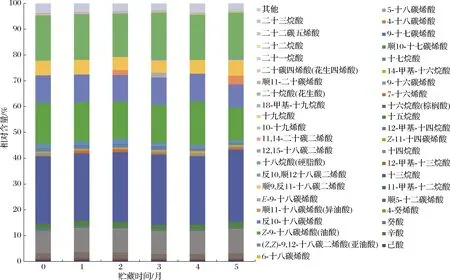
图2 甘南酥油贮藏期间脂肪酸组成与相对含量Fig.2 Fatty acid composition and relative content of Gannan ghee during storage
2.2 牦牛酥油脂肪酸类别与含量分析
在整个贮藏期内,海北酥油检出短链脂肪酸(short chain fatty acids,SCFA)4种,中链脂肪酸(medium chain fatty acids,MCFA)15种,长链脂肪酸(long chain fatty acids,LCFA)28种,如图3所示,海北新鲜酥油中3种脂肪酸相对含量分别为(2.26±0.02)%、(45.79±0.12)%、(51.50±0.06)%;甘南酥油共检出4种SCFA,12种MCFA,26种LCFA,新鲜酥油中这3种脂肪酸的相对含量分别为(2.92±0.02)%、(39.70±1.16)%、(54.18±1.17)%;在贮藏期结束时,海北和甘南酥油相比新鲜酥油SCFA相对含量均显著增加(P<0.05),分别增加了0.87%和0.18%。在贮藏期间,海北酥油MCFA相对含量没有显著变化(P>0.05),甘南酥油显著增加(P<0.05),增加了2.39%。2种牦牛酥油LCFA相对含量在贮藏期间均显著减少(P<0.05),这是因为LCFA随着贮藏时间的延长,将降解为SCFA和MCFA。
SCFA和MCFA含量较高的乳脂具有更高的消化率,随着贮藏时间的延长,2种牦牛酥油SCFA相对含量显著增加(P<0.05),甘南酥油中MCFA相对含量也显著增加(P<0.05),这就说明酥油在贮藏期间其消化率增加。SCFA 在肠道内可作为肠道信使,揭示肠道微生物与宿主之间的互利关系,即SCFA对肠道和肠道微生物具有积极作用,可防止病原菌的过度生长[17]。但是SCFA在酥油品质方面有着另一个作用,即对风味的影响,它的增加会导致酥油风味劣变。乳脂中的细菌脂肪酶释放SCFA是导致乳制品出现酸败味的主要原因之一[18]。
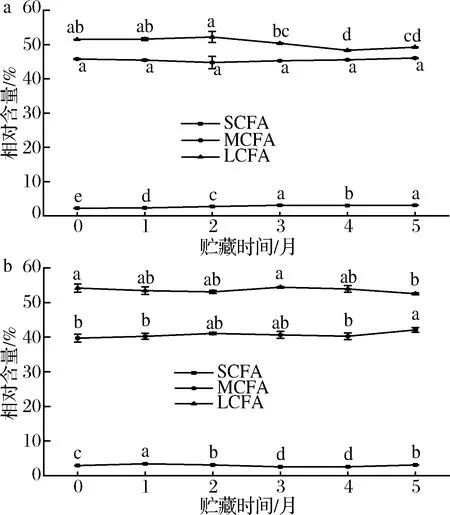
a-海北酥油;b-甘南酥油图3 海北酥油和甘南酥油贮藏期间长、中、短链脂肪酸变化Fig.3 Changes of long, medium and short chain fatty acids in Haibei ghee and Gannan ghee during storage 注:同一行数据,不同小写字母者表示差异显著(P<0.05), 相同小写字母者表示差异不显著(P>0.05)(下同)
在贮藏期内,海北酥油贮藏期内共检出SFA 22种,UFA 26种。如图4所示,新鲜酥油中SFA相对含量为(65.92±0.11)%,UFA相对含量为(33.62±0.05)%。甘南酥油在贮藏期内共检出19种SFA, 23种UFA,新鲜酥油中SFA相对含量为(60.59±1.54)%,UFA相对含量为(36.22±1.58)%。在0~5个月的贮藏期内两地区酥油的SFA均显著升高(P<0.05),海北与甘南分别增加了1.09%和2.41%,且升高的转折点均在4个月,海北酥油UFA显著降低(P<0.05),降低了2.19%,甘南酥油UFA变化不显著(P>0.05)。
SFA如C12∶0、C14∶0、C16∶0被认为是促使胆固醇升高的成分,它们与心血管疾病风险的增加有关,因此SFA的减少被认为是维持健康的积极因素[19]。2种酥油在贮藏期间SFA均显著增加(P>0.05)。AIGSTER等[20]指出,普通奶牛乳脂中SFA含量约在66%左右,本研究得出2种酥油SFA在贮藏期内均小于66%。乳脂中的SFA和UFA与动物日粮关系密切,采用鲜草自由放牧的动物其乳脂中UFA的含量更高,SFA含量更低[6],这是本实验中SFA含量相对其他乳源乳脂SFA相对含量低的主要原因。ABID等[21]在4 ℃ 60 d贮藏期内,发现黄油样品的UFA均呈下降趋势,SFA的含量呈上升趋势,与本实验结论一致。
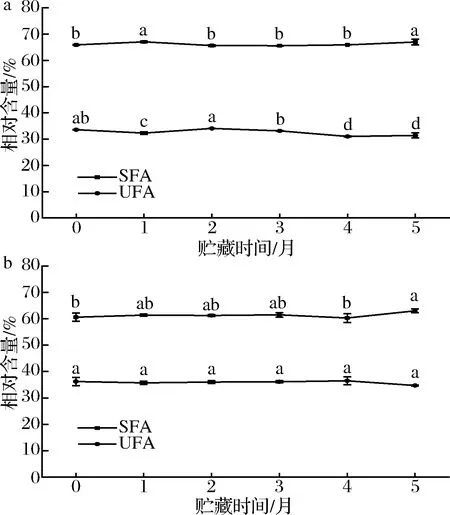
a-海北酥油;b-甘南酥油图4 海北酥油和甘南酥油贮藏期间饱和与不饱和脂肪酸变化Fig.4 Changes of saturated and unsaturated fatty acids in Haibei ghee and Gannan ghee during storage
在整个贮藏过程中,海北酥油共检出PUFA 8种,MUFA 18种。如图5所示,海北新鲜酥油中,PUFA相对含量为(5.01±0.03)%,奇数碳链脂肪酸(odd carbon fatty acids,OCFA)相对含量为(3.30±0.04)%,SBCFA相对含量为 (2.09±0.02)%。在贮藏过程中,甘南酥油共检出7种PUFA,16种MUFA。其中,PUFA相对含量为(7.64±0.12)%,OCFA相对含量为(4.17±0.03)%,SBCFA相对含量为(1.81±0.03)%。两地区新鲜酥油的MUFA和SBCFA相比5个月时显著降低(P<0.05),甘南地区的OCFA相比新鲜酥油在5个月时显著降低(P<0.05),降低了0.5%,但是PUFA没有显著变化(P>0.05)。海北酥油贮藏期内OCFA和PUFA没有显著变化(P>0.05)。
增加PUFA和SBCFA的摄入量与有益于人体健康,例如改善脑功能和降低痴呆风险,并且具有抗心血管疾病的作用[22]。MUFA可预防一些炎症性疾病[14]。通常情况下,乳脂中的PUFA含量小于脂肪酸总量的4%,MUFA接近20%。在本研究中,海北和甘南酥油PUFA相对含量均高于4%,分别为5.99%~4.62%和7.77%~6.60%,MUFA含量分别为28.61%~26.42%和29.51%~26.95%。即使在贮藏期结束时,牦牛酥油PUFA和MUFA含量仍显著高于普通牛乳乳脂水平。关于牦牛酥油PUFA和MUFA在贮藏期间的变化趋势与ERKAYA等[8]的研究结果一致。PUFA和MUFA含量在贮藏期内依旧处于高水平,说明牦牛酥油在贮藏期内其营养性也比普通牛乳乳脂高。OCFA是微生物在反刍动物瘤胃中合成的,因此,它在乳制品中的含量被认为是微生物活动的反映[23],其含量与反刍动物的日粮有关。
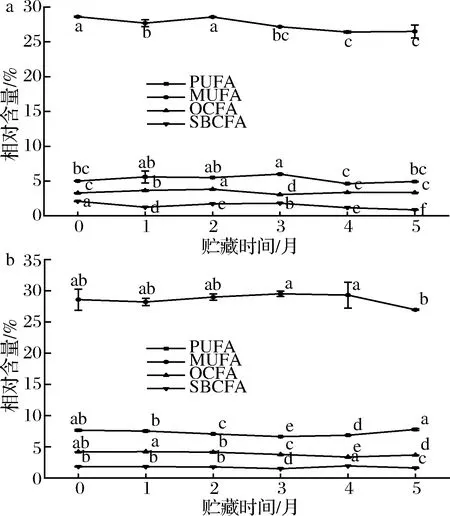
a-海北酥油;b-甘南酥油图5 海北酥油和甘南酥油贮藏期间功能性脂肪酸变化Fig.5 Changes of functional fatty acids in Haibei ghee and Gannan ghee during storage
2.3 牦牛酥油脂肪酸营养质量及健康指数分析
2.3.1 n-3、n-6和CLA含量分析
由表1和表2可知,两地区酥油在0~5个月贮藏期内n-3和n-6脂肪酸均显著降低(P<0.05),CLA均显著增加(P<0.05),海北酥油的CLA增加了0.43%,增加率为11.91%;甘南酥油的CLA增加了0.97%,增加率为17.05%。n-3和n-6系列脂肪酸作为人体必需脂肪酸其对人体健康的作用不容忽视,n-3和n-6的失衡会导致许多慢性炎症和心血管疾病的倾向发生[24]。在本研究中,检出的n-3脂肪酸和n-6脂肪酸分别有DPA,亚油酸和AA。n-3/n-6的建议值应为0.1,较高的n-3/n-6对控制许多慢性疾病的风险是有促进作用的[25]。在本研究中,海北酥油在贮藏期内n-3/n-6在0.15左右,甘南酥油在0.1左右。反刍动物乳制品是人类CLA的主要膳食来源,它是瘤胃微生物对亚油酸进行生物氢化作用产生的中间体,经过反刍动物消化道吸收后转为乳脂,主要由顺9,反11-C18∶2和反10,顺12-C18∶2构成。其中,顺9,反11- C18∶2主要来自乳腺Δ9-去饱和酶的内源合成[26],其占到总CLA的75%~90%,在本研究中,顺9,反11- C18∶2在海北新鲜酥油中占到总CLA的90.3%,甘南酥油CLA全部由顺9,反11- C18∶2构成。
CLA含量受多种因素影响,如遗传因素,反刍动物物种和反刍动物日粮情况等。CLA对人类健康的益处在近几年作为研究重点被深入挖掘,包括预防动脉粥样硬化、预防不同类型的癌症、抗氧化、高血压以及免疫功能的提升等。COLLOMB等[27]报道在山地和高原放牧的奶牛产的牛奶中CLA含量较高(1.86%~2.87%),而在低地放牧的奶牛产的牛奶中CLA含量较低(0.87%)。本研究中海北和甘南新鲜酥油中CLA的含量分别为3.61%和5.69%,显著高于COLLOMB等[27]的水平。在ERKAYA等[8]的研究中,黄油样品CLA在贮藏期间含量范围在0.78%~0.99%,显著低于本实验结果(海北:3.55%~4.67%,甘南:6.66%~5.06%),进一步说明牦牛酥油在贮藏期5个月时其营养性依旧较普通牛乳的乳脂高。
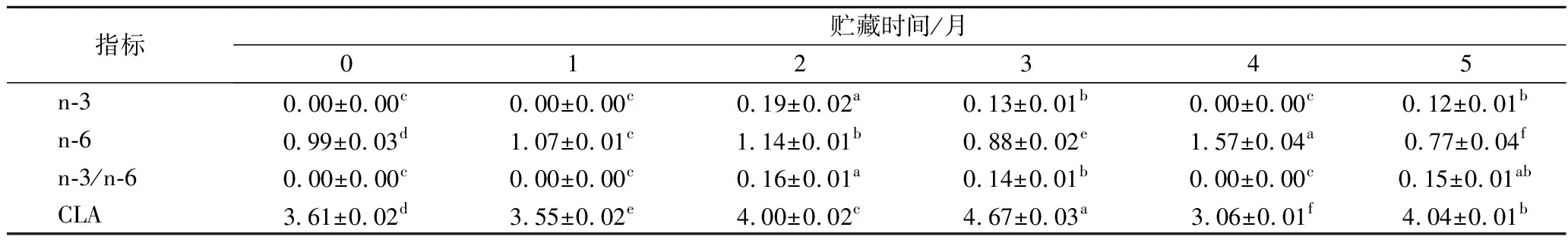
表1 海北酥油贮藏期间n-3、n-6和CLA相对含量变化 单位:%

表2 甘南酥油贮藏期间n-3、n-6和CLA相对含量变化 单位:%
2.3.2 AI和TI
ULBRICHT等[11]提出的AI和TI是心血管疾病的饮食风险指数。AI表明了具有促动脉粥样化特性的脂肪酸与具有抗动脉粥样化特性的脂肪酸之间的关系,反映了对板块聚集的抑制作用及酯化脂肪酸、胆固醇和磷脂的水平。TI表明的是促血栓形成的饱和脂肪酸和抗血栓形成的脂肪酸之间的关系,反映血液凝块形成的趋势[28]。AI和TI指数越低,越有利于消费者的健康。如图6所示,海北和甘南新鲜酥油AI分别为2.21±0.01和2.14±0.16,TI分别为4.00±0.01 和3.48±0.28,2种酥油的AI和TI在5个月时比0个月均显著升高(P<0.05),海北AI增长率为9.5%,TI增长率为4.75%,甘南酥油AI增长率为12.08%,TI增长率为12.36%。造成AI和TI显著升高的原因是UFA在贮藏过程中的氧化作用。
O′CALLAGHAN等[4]研究饲料饲养的牛所生产的新鲜黄油AI和TI指数分别为3.44±0.12、4.51±0.13,草地饲养的为3.40±0.38、4.06±0.24。本实验中所用牦牛酥油AI和TI指数即使在5个月时也显著低于O′CALLAGHAN等[4]。PENA-SERNA等[29]研究了奶牛酥油和水牛酥油的营养指标,其AI分别为2.76和3.00,高于牦牛酥油贮藏5个月时的水平。以上结论表明,虽然随着贮藏时间的延长,牦牛酥油AI和TI显著上升,但是在贮藏期5个月时,其AI和TI远低于其他乳源乳脂制成的黄油水平,进一步说明牦牛酥油对人体健康更为有利,且其在贮藏期5个月结束时,对人体健康依旧是有利的。
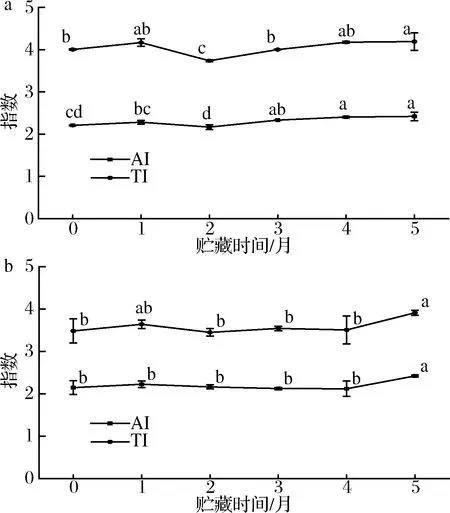
a-海北酥油;b-甘南酥油图6 海北酥油和甘南酥油贮藏期内AI和TI值变化Fig.6 Changes of AI and TI in Haibei ghee and Gannan ghee during storage
2.3.3 HPI和HH
HPI是用来表征乳脂脂肪酸中促进健康因子水平与抑制健康因子水平的指标。HH的定义为低胆固醇血症与高胆固醇血症的比率,其表征的是油酸、n-3 PUFA和n-6 PUFA脂肪酸之和与肉豆蔻酸和棕榈酸总和之比。HPI和HH越大,说明乳脂对人类健康的贡献越大[5]。如图7所示,两地区酥油相比新鲜酥油,5个月时的HPI和HH显著降低(P<0.05)。海北新鲜酥油HPI为0.51±0.00,在第5个月时为0.47±0.02,降低了0.04;甘南新鲜酥油HPI为0.56±0.04,第5个月时降为0.51±0.01,降低了0.05。在贮藏过程中,海北酥油HH从0.46±0.00降低到0.37±0.02,下降率为24.3%,甘南酥油从0.48±0.06降低到0.35±0.01,下降率为37.14%。甘南酥油比海北酥油在相同贮藏时间内HH的降低速度更快,这与甘南酥油中含有更多PUFA有关,PUFA使得甘南酥油的营养指数更高,但随着贮藏时间的延长,其HPI和HH的下降速度也更快(PUFA更易氧化)。
CHEN等[30]利用荷斯坦牛乳制成的黄油HPI值为在0.44,本实验中牦牛酥油HPI在5个月时的最低水平为0.47(海北酥油),由此看来牦牛酥油的促健康因子较荷斯坦多,更有利于人体健康,这一点从PUFA和CLA的相对含量可以得到证实,且贮藏5个月后牦牛酥油的HPI依旧较荷斯坦酥油高,说明随着贮藏期的延长牦牛酥油品质虽然有变化,但牦牛酥油对人体健康的贡献仍大于荷斯坦等其他乳源的新鲜乳脂,在5个月时,其功能脂肪酸含量及健康评估指数仍处于较高水平。

a-海北酥油;b-甘南酥油图7 海北酥油和甘南酥油贮藏期内HH和HPI值变化Fig.7 Changes of HH and HPI in Haibei ghee and Gannan ghee during storage
3 结论
本研究探讨了贮藏期0~5个月内青藏高原牦牛酥油脂肪酸变化及其健康指数评估情况,发现新鲜牦牛酥油相较其他乳源的乳脂制成的酥油来说,牦牛酥油营养性更高;在酥油贮藏过程中,脂肪酸呈现动态变化,贮藏期结束,DPA、CLA等功能性脂肪酸的含量仍处于较高水平;随着贮藏时间的延长,AI和TI显著升高,HPI和HH显著降低,但是在5个月时其AI和TI的数值显著低于其他新鲜乳脂的水平,HPI和HH显著高于其他新鲜乳脂的水平,说明牦牛酥油即使贮藏了5个月,其功能性脂肪酸及健康指数水平依旧高于水牛、荷斯坦等乳源的新鲜乳脂。本研究系统探讨了牦牛乳脂在贮藏过程中其脂肪酸变化及对人体健康的影响,可作为指导乳制品品质调控的重要依据。
