回顾分析:2011—2020年美国批准上市的抗感染药物
2022-02-19王玉丽张洪兵刘昌孝李虎玲喻雨
王玉丽 张洪兵 刘昌孝,* 李虎玲 喻雨
(1 天津大学化学与技术工程学院,系统生物工程教育部重点实验室,天津 300072;2 天津医药集团研究院有限公司,天津300171;3 天津药物研究院,释药技术与药代动力学重点实验室,天津 300462;4 天津医科大学研究生院,天津 300193)
面对感染性疾病的全球化问题,21世纪的全球卫生格局需要采取有效的行动。这10年间也有新的抗感染药物上市。全球卫生时代变得更加多元化,组织关键行动者尽力对有限项目和投资问题进行协调,世界卫生组织(WHO)在全球卫生和疾病治理中发挥着至关重要的作用。然而,由于其核心全球职能是建立,监测和执行国际规范和标准,并协调多个行为者以实现共同目标。全球卫生治理需要WHO发挥领导作用,有效落实WHO的核心全球职能,以确保所有卫生行动者发挥更好的效力,但缩小活动范围和从核心全球职能中重新分配预算可能会阻碍实现这一全球使命[1]。
WHO2020年1月17日表示,私人投资的下降和新抗生素开发的创新不足,正在削弱人类与耐药菌感染作斗争的努力。该报告显示,一是研发中的新抗生素不足。正在研发的60种产品,包括50种抗生素和10种生物制剂,在目前处于临床试验阶段的50种抗生素中,有32种针对WHO所列的优先病原体,但与现有抗生素相比,这些研发中的新药大多数效用有限,仅有两种能对抗具有多重耐药性的革兰阴性细菌,目前这些细菌传播迅速,需要紧急加以遏制,与现有的治疗方法相比改善甚微。二是针对关键的耐药细菌——革兰阴性细菌的新药研发很少。WHO总干事谭德塞说,耐药性的威胁从来没有像现在这样迫切,对解决方案的需求也从未像现在这样紧急。目前正在采取各种行动来减少耐药性,但还需要各个国家和制药业加紧努力,以可持续的资金和创新药物为抗感染性疾病做出贡献[2]。
1 新型抗病毒药物
2011—2020年的10年间,美国批准上市了多种新机制药物用于对抗病毒感染。2018年,CD4抗体ibalizumabuiyk获得批准,这是10多年来首个针对HIV的单克隆抗体的新治疗机制。此外,一种治疗巨细胞病毒(CMV)的新药letermovir于2017年获得批准(图1),是一种抑制DNA末端酶复合物的非核苷CMV抑制剂,其独特的作用机制带来较少的不良反应。2020年12月21日由Ridgeback生物治疗公司开发的单克隆抗体Ebanga(ansuvimabzykl)获得美国食品药品监督管理局(FDA)批准上市,该药用于治疗成人和儿童的埃博拉病毒(Ebola virus)感染,其结构式见图2。Ebanga:Ansuvimab (ansuvimabzykl, EBANGA™)是由Ridgeback Biotherapeutics开发的一种人单克隆抗体,可与扎伊尔埃博拉病毒(埃博拉病毒)上的糖蛋白结合,阻止其进入宿主细胞。根据 PALM阶段的结果,Ansuvimab最近在美国被批准用于治疗埃博拉病毒引起的成人和儿童患者感染,包括对埃博拉病毒感染 RT-PCR 呈阳性的母亲所生的新生儿Ⅱ/Ⅲ期试验[3-4]。该药最常见的不良反应是发热、心动过速、腹泻、呕吐、低血压、呼吸急促和寒战;这些也是埃博拉病毒感染者的常见症状[5]。
过去10年中,抗病毒药物带来的最大影响是丙型肝炎病毒(HCV)治疗获得重大进展。2011年,boceprevir被FDA批准用于治疗HCV,这是第一个NS3/4A丝氨酸蛋白酶抑制剂[6-7],可与聚乙二醇干扰素α和利巴韦林联合使用[8]。2013年,第一个NS5B聚合酶抑制剂sofosbuvir[9]获得批准,接着是NS5A抑制剂如达克拉他韦。莱迪帕韦(也是一种NS5A抑制剂)和索福布韦的联合治疗12周和24周的患者中,缓解率分别为94%和99%。另一种NS5A抑制剂velpatasvir于2016年获得批准[10],其他许多新的HCV NS3/4A蛋白酶抑制剂也都获得批准用于HCV治疗,包括simeprevir[11], paritaprevir[12], grazoprevir[13],glecaprevir[14]和voxilaprevir[15](图3)。
此类病毒性肝炎药物联合(双链,三联)应用治疗慢性HCV的大量临床报告发表,如sofosbuvir/velpatasvir/voxilaprevir 3药联合治疗受到十分的关注,也为治疗提供了更多选择[16-17]。如研究者对3种直接作用抗病毒药物(DAA)的固定剂量组合(索福布韦,维帕他韦和伏西普瑞韦)是第一个为治疗HCV感染而开发的泛基因型单片方案。涵盖的领域包括复合制剂的药动学、药效学、功效和安全性有利于进行合理评价。评估3种抗病毒药物中每种药物的药物吸收、分布、代谢和排泄的信息,为不同患者群体的Ⅱ/Ⅲ期临床试验中的抗病毒活性、安全性和药物相互作用的潜力提供了参考[18]。
瑞德西韦是一种核苷类似物的前体药物,通过RdRp有效地结合到新生RNA链中,从而导致病毒复制提前终止,对丝状病毒和冠状病毒等多种病毒科具有广谱抗病毒活性,半最大效应浓度(concentration for 50% of maximal effect, EC50)值范围为0.0035至0.75 μmol/L,体外试验已证实瑞德西韦对SARSCoV-2的有效抗病毒活性。瑞德西韦通过静脉给药,30~120 min输注[19-20],被批准用于治疗COVID-19,已在日本、澳大利亚、韩国、加拿大、以色列等多个国家注册批准用于治疗COVID-19患者,根据药物作用机制及目前已有研究结果表明,瑞德西韦对重型/危重型患者效果差,临床治疗时应尽早、及时应用。但其给药方式的局限,限制了临床早期用药,因此,研究更有效的口服抗病毒药物成为一种趋势,也是一种必然的发展结果[21-24]。
2 抗寄生虫药物
控制寄生虫病不仅需要预防,而且也需要对患者和感染者进行有效的药物的治疗。目前临床上可供选择治疗寄生虫病的药物十分有限。在现代环保压力之下,需要研发来源丰富、绿色环保、成本低廉、价格合理、低毒高效的抗寄生虫药物。目前各国专利性药物出现不多。2015年,3位科学家,屠呦呦,坎贝尔(William Campbell)和大村智(Satoshi Ōmura)在寄生虫病治疗药物领域获得诺贝尔奖具有里程碑式的意义(图4,来源:2015年网易公开图片)。在这10年间,2018年用于治疗河盲症的莫西菌素(moxidectin)[25]和用于治疗疟疾的tafenoquine[26]和中国于1979年完成青蒿琥酯合成和原料药生产,2010年获得该产品的片剂和注射用制剂批准上市是又一值得分享的重要成果。
2.1 大环内酯类抗生素莫西菌素
阿维菌素(avermectin)(图5)的研究史上,坎贝尔(William Campbell)和大村智(Satoshi Ōmura)发明了大环内脂类抗寄生虫抗生素,从根本上降低了河盲症和淋巴丝虫病的发病率。此后坎贝尔和大村智凭借其衍生物伊维菌素在对抗河盲症的治疗成功,这种治疗被称为“一些最具伤害性的寄生虫病的革命性疗法”,获奖成果为每年数百万感染相关疾病的人们提供了“强有力的治疗新方式”,在改善人类健康和减少患者病痛方面的意义无法估量。
WHO在盘尾丝虫病控制规划中提到,其主要策略是建立可持续的社区指导伊维菌素治疗,并酌情使用对环境友好的方法进行病媒控制。在非洲盘尾丝虫病控制规划的最后1年,超过1.19亿人接受了伊维菌素治疗,在许多国家中,与盘尾丝虫病相关的发病率大大降低。在2015年他俩与中国屠呦呦共同获得诺贝尔生理学或医学奖[27-29]。
伊维菌素(ivermectin)(图6)是由阿维链霉菌(Streptomyces avermitilis)发酵产生的半合成大环内酯类多组分抗生素。伊维菌素是20世纪70年代发现的一种抗寄生虫的化合物,主要含伊维菌素B1(B1a+B1b)不低于93%,其中B1a不得少于85%。伊维菌素B1即22,23-双氢阿维菌素B1。伊维菌素是阿维菌素的衍生物。阿维菌素的一个不饱和碳碳双键通过氢化还原,获得了伊维菌素,伊维菌素稳定性更好,而且生物利用度也更高。发掘出了伊维菌素,最终成就了一款高效低毒的抗寄生虫药。
莫西菌素(图7)又名莫昔克丁,它是一种链霉菌发酵产生的半合成单一成分的大环内酯类抗生素。大环内酯类抗寄生虫药分为两大类,阿维菌素类和米尔贝霉素(milbemycin)类。米尔贝霉素吸水链霉菌金泪亚种(Streptomyces hygroscopicussubsp.aureolacrimosus)产生的大环内酯类抗生素如图8。
莫西菌素与其他多组分大环内酯类抗寄生虫药(如伊维菌素、阿维菌素和米尔贝霉素)的不同之处,它以单一成分能维持更长时间的抗虫活性,具有广谱驱虫活性。作为新一代驱虫药物,莫西菌素能够高效地杀灭线虫和体表寄生虫,同时对动物有很好的安全性。它在用药剂量、剂型开发、耐药性和体内药物分布等方面优于伊维菌素。莫西菌素是一种驱虫剂,适用于治疗12岁及以上患者因Onchocerca volvulus引起的盘尾丝虫病[30-31]。
多拉菌素(doramectin)(图9),商品名为Dectomax,它是伊维菌素的衍生物,由阿维链霉菌新菌株发酵产生的大环内酯类抗生素,是广谱抗寄生虫药,获美国FDA批准兽药作使用[32]。
多拉菌素可用于治疗和控制动物的体内(例如:肺线虫或肠胃线虫)及体外寄生虫(例如:蜱或疕等)。多拉菌素是伊维菌素的衍生物,是广谱抗寄生虫药,治疗包括下列各物种:捻转血矛线虫(Haemonchus),Ostertagia,Trichostrongylus,Cooperia,Oesophagostomum等以及Dictyocaulus viviparus,Dermatobia hominis,微小扇头蜱(Boophilus microplus)及Psoroptes bovis等多种内外寄生虫。可供注射或以5 mg/mL溶液作外用药物使用。
2.2 南美锥虫病治疗药物nifurtimox
2020年8月6日Lampit(nifurtimox)获批,用于儿科患者(0~18岁),治疗由克氏锥虫(T.cruzi)引起的恰加斯病(南美锥虫病),其结构式如图10。硝呋莫司(nifurtimox)是由德国公司拜耳(BAYER)公司开发的一种新型的抗虫药,该药于2020年8月7日经FDA批准上市,用于治疗由克氏锥虫引起的恰加斯病(chagas disease)儿科患者[33]。硝呋莫司是一种硝基呋喃类药物,在锥虫细胞内被还原为硝基阴离子自由基,从而通过提高活性氧来发挥抗锥虫作用,作为一种新型可分割、易分散的片剂,该药很容易分散在水中,有助于可能吞咽困难或需要半片片剂的儿科患者的给药治疗。在一项入组330例有克氏锥虫感染血清证据的儿童患者的临床Ⅲ期CHICO研究中,患者分别接受60 d或30 d治疗方案,结果显示接受60 d治疗方案优于安慰剂对照,并且相比于30 d方案在血清学反应方面具有优越性,这一结果证实了硝呋莫司用于治疗恰加斯病儿科患者的安全性和有效性[34]。硝呋莫司在使用过程中存在的不良反应主要见于消化系统、中枢系统和营养系统,如:食欲不振、恶心、头痛、发热等[35]。
2.3 抗疟药
疟疾是由疟原虫引起的传染病,以间歇性寒颤、高热、出汗和脾肿大、贫血等为特征。化学药物预防和治疗是较常应用的措施。对高疟区的健康人群及外来人群可酌情选用。现在的常用药物是氯喹,但在耐氯喹疟疾流行区域,可用甲氟喹或用乙胺嘧啶或多西环素。
早在2013年,Renslo[36]在抗疟疗法的探索中认识到现代医学和小分子化疗的概念在抗疟药的发展过程中发挥了中心作用。在目前抗疟药物发现复兴的背景下回顾了这一历史,这是现代药物研发方法首次应用于这一问题。在过去的10年里已经取得了长足的进步,但是药物研发界的进一步创新需要实现时代预言。
2018年获得美国FDA批准上市的他菲诺喹(tafenoquine)(图11右)由疟疾风险投资公司和葛兰素史克公司(GSK)合作开发[37]。它是一种8-氨喹类抗疟药。
2018年他菲诺喹在美国和澳大利亚获准上市。其机制与葡萄糖-6-磷酸盐脱氢酶(G6PD)有关[38]。因此,他菲诺喹可能作为G6PD正常病的每周预防选择作用的药物应用。他菲诺喹可能出现严重不良反应。包括一些G6PD-正常患者报告的血红蛋白水平下降、甲基红蛋白无症状升高以及轻微的精神疾病患者不得使用。这些类型的基金会和合作对于解决被忽视的热带疾病至关重要,因为这些疾病缺乏重大的经济利益来激励投资进行新药研究、开发和商业化。这个改良型新药的问世,是否能圆这个梦,还值得探讨和发展。
进行一系列数据库搜索,以确定评估抗疟药物疗效的潜在临床试验,至少进行了28 d的随访。在筛选并确定了1946—2018年间发表的1221项试验,代表2339个治疗部门和323819名患者。在地方试验中,75.7%(787/1040)招募了恶性疟原虫(P.vivax)感染者,17.0%(177/1040)疟原虫感染者,6.9%(72/1040)和0.4%(4/1040)其他疟原虫感染者:57.2%(585/1022)的试验包括5岁以下儿童和5.3%(55/1036)包括孕妇。在非洲,过去20年中,对恶性疟原虫的研究有显著增加。WHO推荐的青霉素为基础的组合疗法单独或与组合药物评估在39.5%(705/1783)的恶性疟原虫治疗从10.5%(45/429)增加到78.0%(266/341)和22.9%(27/118)[39]。
在一项58个健康受试者的研究中,一些常见的副作用包括恶心(31%)、呕吐(12%)、腹泻(17%)、腹痛(9%)、头痛(29%)和头晕(19%)。1位患者出现视力减退的潜在影响,但能自发消退。该研究还发现17%患者放置EKG贴片处出现侵蚀。当与氯喹联用时,还发现QTc延长的副作用[40-42]。
耐受性试验是第2b期的研究氯喹和他菲诺喹组合的安全性和耐性,剂量从50~600 mg不等,用于治疗恶性疟原虫[43]。这项研究对329名患者进行了登记,其中69%的患者报告了不良事件。值得注意的是,本研究中有3名患者患有G6PD缺陷,没有一名患者经历过溶血。虽然这些结果是积极的,但需要更多的研究,在G6PD缺乏患者中使用他菲诺喹才能去除溶血作为潜在的威胁。调查人员未发现他菲诺喹与QTc延长有关,QTc的延长定义为超过500 ms。虽然这些不良反应可能归因于药物的使用,但其中一些也是正在治疗的疾病症状,因为疟疾感染可导致头痛、发烧以及呕吐[44-45]。
他菲诺喹是喹诺林环的结构修饰产物,其半衰期长达17 d,而原化合物的半衰时间为4~7 h。建议的疗程是200 mg每3 d给药一次,然后每周(半衰期的一半)给药200 mg。在流行地区,一周内200 mg的暴露剂量后达到抗疟的目的[46-47]。
在中国,青蒿琥酯新药诞生于1969年,注射用青蒿琥酯原料药在1987年批准生产,它是在中国创下多项记录的创新药物[48-50]。现在执行中国药典2010年版二部标准质量。国内有桂林制药厂的口服片剂和注射用2个批准文号(注射用青蒿琥酯:国药准字H10930795;口服片剂:国药准字H10880057)。2010年11月5日,WHO官方网站已正式将桂林南药生产的注射用青蒿琥酯artesunate列入PQ认证(prequalification)药品清单。其使用说明书指出该药的主要药理特点是“青蒿琥酯为青蒿素的衍生物。对疟原虫红内期有强大且快速的杀灭作用,能迅速控制临床发作及症状。主要是干扰疟原虫的表膜一线粒体功能。青蒿素通过影响疟原虫红内期的超微结构,使其膜系结构发生变化。由于对食物泡膜的作用,阻断了疟原虫的营养摄取,当疟原虫损失大量胞浆和营养物质,而又得不到补充,因而很快死亡。其作用方式是通过其内过氧化物(双氧)桥,经血红蛋白分解后产生的游离铁所介导,产生不稳定的有机自由基及或其他亲电子的中介物,然后与疟原虫的蛋白质形成共价加合物,而使疟原虫死亡”[51]。
由Amivas公司研发的青蒿琥酯静脉注射剂(artesunate,图12)于2020年5月26日通过优先审评,经美国FDA批准上市,并获得“孤儿药”称号,本品为注射剂,用于成人和儿童严重疟疾的初期治疗,是美国目前唯一批准用于治疗严重疟疾的药物。在使用该注射剂的同时,应伴有完善的口服抗疟治疗方案[48]。青蒿琥酯的作用机制有3种:①自由基机制,青蒿素及其衍生物的过氧桥在体内活化后产生自由基,继而与疟原虫蛋白络合形成共价键,使蛋白失去功能导致疟原虫死亡,或者转化为碳自由基而发挥烃化作用,使疟原虫的蛋白烃基化;②对红内期疟原虫直接杀灭作用,通过影响表膜-线粒体,阻断宿主红细胞为其提供营养,来选择性地杀灭红内期疟原虫,同时对疟原虫配子体也具有杀灭作用;③抑制PfATP6酶,青蒿素及其衍生物对该酶具有较强的特异性抑制作用,使疟原虫胞浆内钙离子浓度升高,引起细胞凋亡[49]。
3 新型抗菌药物
抗菌药物的批准也在逐年增加,但由于“超级细菌”和耐药菌带来的危机,许多大型制药公司进行了大规模的撤资。2011年通过抗菌激励法案(GAIN),为新抗生素提供了5年的市场排他性和快速通道批准。治疗威胁生命的感染的潜在药物可获得合格治疗传染病产品(qualified infectious disease products,QIDP)之称,并可以利用GAIN法案激励其研发。自2014年以来有15种新抗菌药物获得QIDP认证(表1)。尽管该法鼓励研发新型抗感染药物,但新的抗菌疗法仍然进展缓慢,而获得批准的大多如四环素类、氨基糖苷类和氟喹诺酮类传统抗生素。
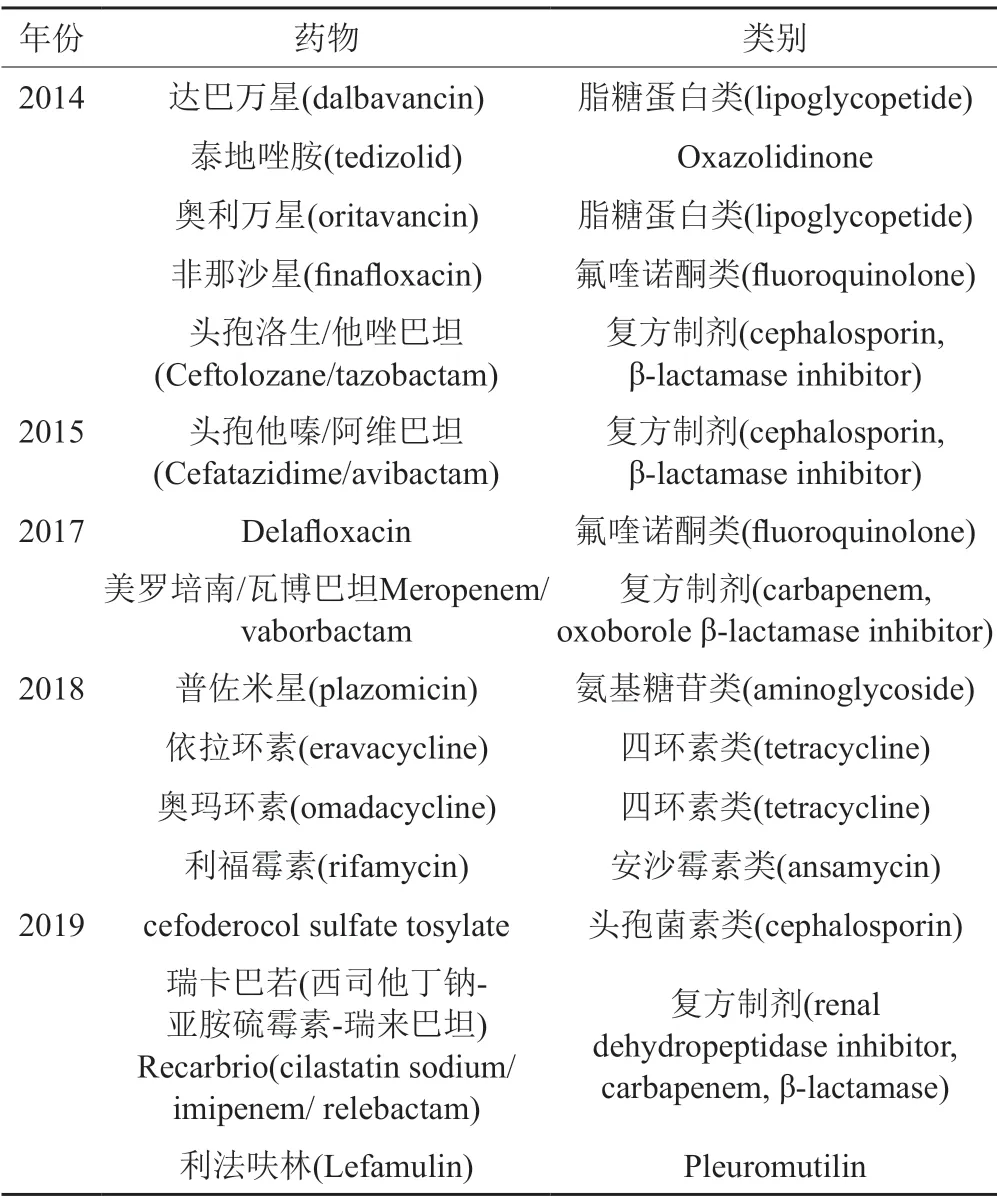
表1 获得QIDP认证批准上市的抗菌药物Tab.1 Antibacterial drugs with QIDP certification approved
β-内酰胺酶抑制剂出现了一些创新性的发展,如瓦博巴坦(2017)是第一种与美罗培南联合使用的β-内酰胺酶抑制剂(图13)。另一类新的β-内酰胺酶抑制剂阿维巴坦,2015年与头孢他啶联合使用获得批准。
3.1 抗结核药物研发
以往由于企业开发缺乏积极性,影响了有较广泛应用的治疗耐多药结核病(TB)药物的开发。2019年慈善和慈善基金会推动并促成了许多热带病药物的开发,pretomanid[52-53]成为由全球结核病药物开发联盟(TB联盟)开发的新药。
Pretomanid是一种抑制霉菌酸合成的硝基咪唑嗪药物。这导致有缺陷的细胞壁形成,最终导致细菌细胞死亡。它对复制性和非复制性结核分枝杆菌均有活性。在Ⅲ期试验中取得较好效果后,pretomanid于2019年8月获得美国FDA的批准。这种口服活性药物已被批准作为贝达喹啉、pretomanid和利奈唑胺(BPaL方案)联合方案的一部分,用于治疗患有肺广泛耐药结核病、治疗不耐受或无反应的多重耐药结核病的成人患者[54]。
3.2 治疗高度耐药菌的新药开发
甲苯磺酸头孢地洛尔硫酸盐(cefoderocol sulfate tosylate)是第5代头孢菌素类抗菌新药的硫酸头孢地尔对甲苯磺酸盐水合物(cefiderocol sulfate tosylate hydrate)[55]。其有效成分头孢地尔是一种新型铁载体头孢菌素,具有独特的穿透革兰阴性菌细胞膜的作用机制,与三价铁离子络合,通过细菌铁转运蛋白,穿透细胞膜外膜被转运至细菌细胞壁内,使之在细菌胞质中达到更高浓度,与受体结合,抑制细菌细胞壁的生物合成,对所有革兰阴性菌具有强劲的杀灭活性,包括耐碳青霉烯革兰阴性非发酵鲍曼不动杆菌、铜绿假单胞菌、难治性耐碳青霉烯肠杆菌科细菌。
美国FDA和欧洲EMA提出新药上市许可。FDA授予头孢地尔QIDP资格认定并享受快速通道资格;EMA人用医药产品委员会(CHMP)也授予头孢地尔加速评估资格。2019年10月,FDA抗微生物药物咨询委员会投票决定,推荐盐野义制药株式会社的头孢地尔静脉注射液用于治疗高度耐药革兰阴性菌感染,包括肾盂肾炎;2019年11月14日,FDA批准头孢地尔静脉注射液上市[55]。
Lefamulin(Xenleta)属于创新截短侧耳素(pleuromutilin)类抗生素,具有针对与获得性细菌性肺炎(CABP)相关的最常见致病革兰阳性,革兰阴性和非典型病原体的体外活性谱,适用于由肺炎链球菌、甲氧西林敏感金黄色葡萄球菌、流感嗜血杆菌、嗜肺军团菌、肺炎支原体和肺炎衣原体易感微生物引起的CABP。2019年8月美国FDA批准lefamulin用于治疗患有社区CABP的成人患者[56-57]。
3.3 复方抗生素的开发
Recarbrio是由3种抗生素组合的注射剂,包含亚胺培南/西司他丁和雷巴坦(cilastatin sodium/imipenem/relebactam),2019年7月FDA获批准治疗选择受限的或无其他替代选择的复杂尿路感染和腹腔感染的患者。HABP和VABP是发生在住院患者中的一类肺炎,可引起发热、寒战、咳嗽、胸痛和需氧量增加等症状[58]。英国在2020年批准该制剂上市,用于治疗选择受限的需氧革兰阴性菌感染成年患者,该抑制剂适于恢复耐药菌株对亚胺培南的敏感性[59]。
4 讨论
感染类疾病是指当病原微生物或条件致病性微生物侵入宿主后, 经过生长、繁殖并释放毒素,导致机体内微生态平衡失调并成为病理生理性疾病。这类疾病统称为感染性疾病。其主要传播方式有水平传播和垂直传播,传播途径有呼吸道传播、消化道传播、皮肤传播、性传播、血液传播、接触传播。感染性疾病的发生与发展及宿主的免疫力密切相关。具有杀灭或抑制各种病原微生物(如细菌、病毒、真菌、衣原体、立克次体以及寄生虫等)的作用的抗感染类药物,在各类感染病症治疗得到广泛应用。抗感染类药物品种丰富,种类众多,主要包括抗生素类药物、抗真菌药物、抗病毒药物、抗寄生虫病药物以及免疫制剂等。进入21世纪以来,生命科学的重大突破,生物技术与信息技术并行发展成为支撑经济社会发展的底层共性技术,针对生物技术创新、生物医药开发及应用的成就日趋显现。抗感染药物发展在挑战中有所进展。
4.1 世界重视抗感染药物耐药和滥用问题
从社会经济学角度加强抗生素的监管力度:Årdal等[60]专家从社会经济学角度讨论了导致抗生素药物发现和开发下降的挑战,以及旨在激励研究和开发新抗生素以提高抗生素开发的经济可行性的国家和国际举措。从社会经济的监管的4方面入手:①抗生素耐药性是全球卫生面临的最大挑战之一,新抗生素的研发却在减少,而耐药研究困难重重;②多种社会、经济、监管与社会因素密切相关,其研发难度大、成本高、商业利益低,其使用和研发又缺乏科学有效的监管与实施战略和策略;③非常需要有激励机制和措施,确保研发资金和盈利。各国政府、国际组织、民间机构等需全球协同处理这些问题;④加大研发力度,需在感染预防控制、抗生素滥用管理和新药研发等多方面降低抗生素的耐药性。
美国临床医生Kevin T Kavanagh在2014年8月4日的JAMA内科学杂志发表文章,阐明抗生素药物的使用隐藏了一些实际的风险[61]。抗生素如今滥用的情况愈发严重,从大的方面来说,有3方面原因:①患者专业知识匮乏。患者通常对用药没有太多的了解,只追求药到病除。同时他们对于一些基本的医疗知识了解也越来越深,希望安全合理用药。②与医生职业道德有关。绝大部分的用药主动性在医生身上。如对于抗生素应用适应症掌握不严,所以对很多非感染性疾病,甚至造成了抗生素的滥用。③医院职责。医院和药物厂商的利益关系导致特殊药品的使用和医生的绩效紧密挂钩,这也是医生无奈使用抗生素的一个背后原因。真正有作用的是医务工作者他们自身意识到这个问题的严重性,继而从改变他们自身的习惯做起。
重视新型抗生素靶向抗多重耐药菌(MDR)研究:增强其耐久性并减缓耐药性的发展的研究[62]。①把握病原体靶向抗生素的发现、开发和临床采用受到技术和监管挑战的阻碍。②对细菌生理学和耐药机制的日益深入,创新的临床试验设计,简化的监管批准途径以及快速细菌诊断的可用性是可以帮助应对这些挑战。③针对病原体的靶向抗生素提供了在正确的时间用正确的药物治疗患者的机会,有效地改善了患者的预后和更好地管理抗菌药物。④需要以患者为中心的定价和报销改革来激励创新。
抓住后基因时代的科学技术动态,推进耐药研究:在后基因时代,大量科学技术的涌现为研究耐药提供了科学理论和方法。这些技术构建了一个系统,无论是细胞还是整个微生物组,克服了以基因为中心的方法相关的问题。目前结合组学研究中得出的信息,对抗生素耐药性的演变和传播有更全面、更新的认识。将组学信息准确地集成到计算模型中,这些模型用于分析抗生素耐药的原因和后果,由此识别结构基团的位阻与所用元素的数据库也为分析目前全球抗生素耐药提供了分析的工具[63]。
4.2 美国重视抗病毒药物的基础和临床应用研究
近10年,抗病毒药物取得了多项重大突破性进展,特别是在对抗慢性病毒感染上,深刻地改变了广大患者的生活方式。获批的抗病毒药物中,抗艾滋病药物数量最多,其次是抗丙型肝炎病毒(HCV)和乙型肝炎病毒(HBV)药物,另外还有治疗流感和巨细胞病毒(CMV)感染的药物获批。基础研究对抗病毒药物的研发至关重要,为抗病毒药物研发提供了理论基础,也是创新药研发的动力来源。晶体衍射技术对病毒蛋白结构的解析为基于结构的药物靶点的发现提供了大量有价值的证据,例如对HIV整合酶结合子的晶体结构分析,引导了新型变构抑制剂的发现。
抗病毒药物研发积累的经验对于快速开发针对新发传染病的药物至关重要,对药物抑制聚合酶和蛋白酶等结构与机制的研究,以及药物抑制病毒进入细胞机制的研究,都有助于抗新病毒的药物研究,临床试验经验也对加快新药研发不可或缺。乙型肝炎病毒药物可以较好地抑制病毒复制,能有效抑制疾病恶化。然而,由于乙型肝炎病毒整合宿主细胞基因组的特性,导致病毒很难彻底清除。因此,全球制药界仍然付出大量精力开发新型乙肝治疗药物,并以彻底清除人体内HBV基因序列为终极目标。联合疗法占比越来越高,现有药物的联用组合已成为抗病毒药物临床创新的重要方式。药物的联用在HCV和HIV的治疗上具有重大意义,目前最好的药物都是联合疗法。
4.3 抗感染新药成为“神药”有难度
世界重视抗感染药物耐药和滥用问题,美国重视抗病毒药物的基础和临床应用研究,抗感染新药成为“神药”有难度。
新冠病毒疫情发展,使之成为世界关注的热点,意识到抗病毒药物研发的重要性。有报道认为瑞德西韦和氯喹等已有药很可能对新冠病毒有效,成为抗击疫情最快的途径,但是最终并未成为有效治疗的“神药”。目前还没有确切有效的抗病毒药物。其研发的难点在于,一是对全新的病毒认识不足,由于之前从来没有被发现过,没有足够时间深入开展基础研究。二是对药物安全性、有效性评价,从动物模型到应用于临床必然要有科学和技术的准备。美国Fierce Biotech网站公布了2020年十大失败的临床试验,盘点了那些没有得到批准的疾病疗法以及那些本可以在临床治疗上向前迈出一大步的疗法,其中既有大型制药公司,也有小型生物技术公司[64]。2020年,在治疗COVID-19的一系列失败案例中,最具有争议性的便是“羟基氯喹”。该药物之所以脱颖而出,一时间将其视为“神药”,并将该药称为“医药史上最大的改变游戏规则的药物”。FDA官网在4月对羟氯喹发布警告,称使用这种药物治疗COVID-19患者可能出现严重心律失常,禁止非住院患者使用,尤其是不应和大环内酯类抗菌药阿奇霉素等联合使用。
4.4 受到资本迎新新抗生物研究乏力,保证药物供应有难度
Achaogen公司的破产或说明(Achaogen申请破产,唯一新药上市不到1年):抗生素研发并不是一个好的赛道。另一家创立于2006年的创新抗生素的公司Tetraphase为了将资源集中至治疗复杂性腹腔内感染(cIAI)的XERAVA(eravacycline),取消了其内部研究功能,希望能节省研发开支。事实证明,对抗生素的研究比使其商业化更困难。在Tetraphase前任CEO Guy Macdonald声称其抗生素销售额将达到数亿美元的高峰,然而市场并没有达到他预期。一些中小企业在耐药性持续增长的情况下全力以赴开发新产品,但该领域销售上的惨淡表现,使得投资者尽量避开该领域。美国FDA前局长Scott Gottlieb也曾敦促采取新的药品注册的方式为抗生素创造一个可持续的市场,但因投资者的热情似乎不高而难以改变。Gottlieb的意见在某种情况下,也增长投资者重返市场的信心[65]。
据《西雅图时报》报道[66],数以百万计美国人所服用的药都是中国制造。从大型卖场或药店售卖的药品,到医院开的处方药,再到退伍军人以及驻扎在世界各地的美国现役军人所使用的药品。如今中国在全球药品生产中占据主导地位,庞大仿制药产业的印度地位都很重要,仿制药中的关键成分也来自美国之外的国家,而不是美国。美国人使用的药品中仿制药(专利已经到期的药物)比例高达90%,因此,美国人常用的许多基本药品越来越依赖中国。有很多仿制药都是中国制造的,包括抗抑郁药、避孕药和化疗药物。中国还提供治疗阿尔兹海默病、艾滋病、糖尿病、帕金森病、癫痫以及其他疾病的原料药。
据《西雅图时报》报道,在过去30年,美国的大部分药品生产厂家都开始迁到美国国外。美国国内已经不再生产青霉素,最后一家青霉素生产厂家已经在2004年关闭。此外,专家预计,再这样下去,未来5~10年,美国将基本丧失生产大部分仿制药的能力。如今,美国已经基本没有能力生产用于治疗耳部感染、链球菌性喉炎、肺炎、尿路感染、性传播疾病、莱姆病以及其他疾病的通用抗生素。2021年6月16日,美国两党国会议员再次提出美国制造法案[67],促进医药在美国本国生产,以降低对美国国外药物的依赖。平衡需求及其带来的风险,美国应该快速评估其医药产业的脆弱性,增加美国国内仿制药的生产。
20世纪90年代中期,WHO呼吁全球关注抗菌药耐药(antimicrobial resistance, AMR)问题。面对如此严峻的抗生素耐药菌的威胁,美国也开始开展反对抗生素滥用的运动,逐步建立严格的抗生素使用监管体系,并出台新型抗生素研发激励系列政策[68]。回顾美国21世纪初将重点放在做好抗生素的安全管理,为2011—2020年抗感染药物的科学监管奠定了基础。
1996年,美国农业部和疾病控制中心合作成立了国家抗微生物药耐药监测系统(NARMS),主要职责为监测抗生素对人畜肠道细菌的敏感性,并提供的年度总结报告并定期向公众报告监测结果,为其他AMR研究交流提供了平台[69]。2002年,根据WHO国际合理用药指标制定了医院抗菌药物使用规范,美国国际开发署的合理用药管理部为医院管理者评估和改进医院抗菌药物使用提供了理论基础[70]。2012年,FDA颁布安全创新法案(Food and Drug Administration Safety and Innovation Act),为鼓励研发QIDP,规定用以治疗严重甚至危及生命的感染性疾病的抗细菌或抗真菌药品,QIDP享有5年市场独占权,并可获取优先审评和快速通道认证资格。2013年美国疾病预防控制中心(Centers for Disease Control and Prevention)发布报告指出美国正面临AMR威胁,出台了一系列举措以进行AMR综合治理[71]。2015年3月27日白宫发布《遏制耐药菌国家行动计划》,要求所有急诊医院在2015年5月19日,FDA提出法令,要求兽药企业提供用于牛、猪、鸡和火鸡等食用动物的抗菌药物销售数据,以确保重要医用抗菌药物合理应用[72]。设立特别小组以应对日益严重的耐药细菌威胁,美国“抗击耐药细菌5年国家行动计划”采用里程碑式目标管理方式进行管理是有成效的。①特别进行追踪管理以促进目标实现。②加强“超级细菌”全国性检测,向全国医院和医师提供AMR实时数据。③加速研发并使用鉴定新型耐药菌表征的诊断工具;开发更好的“超级细菌”诊断工具。④加速新型抗生素、疫苗和其他疗法的基础及应用研发。⑤加强有关国际合作,建立动物抗生素使用的全球数据库和应对AMR危机等。美国疾病预防与控制中心基于“国家医疗安全网络(National Healthcare Safety Network, NHSN)”建立全美医院住院患者抗生素使用与管制模型和监测网络,主要从电子病历管理系统和条形码医疗管理系统,用来开展全美现抗生素使用率调查、收集患者的抗生素使用量等数据,为改善AMR提供依据[73]。
5 结论
美国在21世纪初制定的一些优先发展抗感染药的政策指引下发生了一些变化。本文从新型抗病毒药物、抗寄生虫药物、抗疟药物和新型抗菌药物几个方面回顾分析2011—2020年美国批准上市的抗感染药物,为新药研发提供参考和思路。从宏观视角来看,根据弗若斯特沙利文提供的数据,对全球传染病药物(包括抗病毒药物、抗菌药物、抗真菌药物和其他传染病药物)进行分析,以期对新药研发提供参考。
