阿莫西林克拉维酸钾复方制剂中克拉维酸钾杂质分析
2022-02-19沈丹丹沈川程义侯立新
沈丹丹 沈川 程义 侯立新,*
(1 重庆市食品药品检验检测研究院,国家药品监督管理局麻醉精神药品质量监测重点实验室,重庆 401121;2 重庆綦江区人民医院,重庆 401420)
阿莫西林/克拉维酸钾组成的复方制剂最早由Beecham公司(现为葛兰素史克公司)于1981年4月3日在英国上市,剂型为片剂,商品名Augmentin,规格为0.375 g(阿莫西林/克拉维酸:250 mg / 125 mg)。目前国内阿莫西林/克拉维酸钾复方制剂获批的剂型有7种,本次国家评价性抽样品种包括片剂、分散片、颗粒剂及胶囊剂4种剂型,片剂、分散片与颗粒剂现行标准为《中国药典》2020年版二部(ChP2020)[1-3],胶囊剂现行标准为注册标准[4],国外药典美国药典(USP43)[5]及英国药典(BP2021)[6]均收载了复方制剂的质量标准。按照法定标准检验,发现有关物质均未对克拉维酸钾引入的杂质进行有效控制,不能反映产品中杂质的真实含量,存在一定的安全性风险。目前国外药典均仅对复方制剂中阿莫西林引入的杂质进行了控制,相关文献[7-8]也只研究了阿莫西林的杂质来源及归属问题,而复方制剂中克拉维酸钾的杂质谱研究仍为空白。
本次评价的阿莫西林/克拉维酸钾复方制剂共涉及3个组分比例(包括2:1、4:1、7:1),存在规格多(共涉及9个规格)、主成分的量差异大的问题,因此可能存在主成分紫外吸收差异大的问题,特别是对于积分面积较小的主成分克拉维酸,其有关物质容易被忽视。本研究针对阿莫西林/克拉维酸钾复方制剂中杂质控制不全面的问题,结合BP2021阿莫西林[9]和克拉维酸钾[10]的杂质谱,建立能同时测定制剂中阿莫西林和克拉维酸钾的有关物质HPLC检查方法,重点分析克拉维酸钾的杂质归属和降解途径,对未开展本品一致性评价的企业提供处方工艺及质量研究基础。
1 试验材料
1.1 试验仪器
沃特世液相色谱系统:美国Waters e2695型高效液相色谱仪, Waters 2489型紫外检测器,Waters色谱工作站。德国Bruker Impact Ⅱ液相色谱/质谱联用仪。Mettler Toledo XP 205十万分之一电子天平。
1.2 药品与试剂
阿莫西林杂质A~杂质M对照品、N-新戊酰阿莫西林对照品均来源于Toronto Research Chemicals;克拉维酸杂质A对照品(Toronto Research Chemicals,批号:P840815,含量:98%);克拉维酸杂质B对照品(Quality Control Chemicals Inc.,批号:QC221202,含量:99.77%);克拉维酸杂质C对照品(Quality Control Chemicals Inc.,批号:QC221203,含量:97.96%);克拉维酸杂质D对照品(Quality Control Chemicals Inc.,批号:QC221204,含量:95.49%);克拉维酸杂质G对照品(Quality Control Chemicals Inc.,批号:QC221207,含量:98.28%);来自国内3个生产企业的11批克拉维酸钾-微晶纤维素混粉(1:1)、2个生产企业的9批阿莫西林克拉维酸钾混粉(2:1、4:1、7:1)、4个生产企业的12批阿莫西林原料及23个生产企业的226批制剂均为2020年度国家评价性抽验样品;1批阿莫西林克拉维酸钾片参比制剂[Glaxo Smith Kline,规格为0.375 g(阿莫西林/克拉维酸:250 mg/125 mg),批号860950];磷酸二氢钠及磷酸均为分析纯,甲醇为色谱纯。
2 方法
2.1 色谱条件
用十八烷基硅烷键合硅胶为填充剂(YMC ODSAQ C18,4.6 mm×250 mm,5 μm );以缓冲液[取磷酸二氢钠7.8 g,加水1000 mL使溶解后,用磷酸调节pH值至(3.7±0.1)]为流动相A,以甲醇-缓冲液(90:10,V/V)为流动相B,按表1梯度洗脱;柱温35℃;自动进样器6 ℃;流速1.0 mL/min;检测波长为220和275 nm;进样体积20 μL。

表1 梯度洗脱Tab.1 Gradient elution
2.2 溶液的制备
2.2.1 系统适用性试验溶液(1)
取阿莫西林杂质A、杂质B、杂质C、杂质D、杂质E、杂质G、杂质H、杂质I、杂质K、杂质L、N-新戊酰阿莫西林对照品各适量,精密称定,置同一10 mL量瓶中,加水适量超声使溶解后(保持超声水浴的温度在10℃~15℃),用水定量稀释制成含各杂质约0.1 mg/mL的溶液,作为杂质对照品贮备溶液(1);阿莫西林杂质F适量,精密称定,置10 mL量瓶中,加甲醇适量使溶解后,用水定量稀释制成含杂质F约0.1 mg/mL的溶液,作为杂质对照品贮备溶液(2);另取克拉维酸对照品、克拉维酸杂质D、克拉维酸杂质G对照品各适量,精密称定,置同一10 mL量瓶中,用水溶解并定量稀释制成每1 mL中各约含0.1 mg的溶液,作为杂质对照品贮备溶液(3)。取阿莫西林杂质J对照品约7.5 mg,精密称定,置5 mL量瓶中,精密加入上述杂质对照品贮备溶液(1)、(2)及(3)各0.4 mL,加水适量超声使溶解,保持超声水浴的温度在10℃~15℃,并用水稀释至刻度,作为系统适用性溶液(1)。
2.2.2 系统适用性试验溶液(2)
取克拉维酸杂质A、杂质B及杂质C对照品各适量,精密称定,置同一10 mL量瓶中,用水溶解并定量稀释制成每1 mL中各约含0.1 mg的溶液。精密量取0.5 mL,置20 mL量瓶中,用水稀释至刻度,作为系统适用性溶液(2)。
2.2.3 供试品溶液
取本品的细粉或内容物适量(约相当于阿莫西林75 mg),精密称定,置50 mL量瓶中,加水至量瓶容积的70%,超声使溶解后(保持超声水浴的温度在10℃~15℃),用水稀释至刻度,摇匀,离心取上清液。临用新配。
2.2.4 对照品溶液
取阿莫西林及克拉维酸对照品各适量,精密称定,用水溶解并定量稀释制成每1 mL中含阿莫西林约0.017 mg、克拉维酸约0.005 mg的溶液。此溶液可在6℃保持稳定20 h。
2.3 系统适用性试验
取“2.2.1”及“2.2.2”项下系统适用性试验溶液,按“2.1”项下色谱条件进行测定,记录色谱图。
2.4 降解试验
经调研各企业处方工艺,目前国内原料投料主要以克拉维酸钾-微晶纤维素(1:1)和阿莫西林克拉维酸钾混粉2种方式,故本文中降解试验重点考察了克拉维酸钾的杂质降解途径。
(1)未降解试验:取克拉维酸钾-微晶纤维素(1:1)、阿莫西林克拉维酸钾混粉(2:1)各适量(约相当于克拉维酸7.5 mg),照“2.2.3”项下配制供试品溶液。
(2)强酸降解试验:取克拉维酸钾-微晶纤维素(1:1)、阿莫西林克拉维酸钾混粉(2:1)各适量(约相当于克拉维酸7.5 mg),分别置10 mL量瓶中,加水至量瓶容积的70%(保持超声水浴的温度在10℃~15℃),超声使溶解后,加入0.2 mol/L盐酸溶液1.0 mL,摇匀,放置10 min,加入0.2 mol/L氢氧化钠溶液1.0 mL,用水稀释至刻度,摇匀,即得。同法进行空白试验。
(3)强碱降解试验:取克拉维酸钾-微晶纤维素(1:1)、阿莫西林克拉维酸钾混粉(2:1)各适量(约相当于克拉维酸7.5 mg),分别置10 mL量瓶中,加入0.1 mol/L磷酸氢二钠溶液至量瓶容积的70%(保持超声水浴的温度在10℃~15℃),超声使溶解后,在50℃水浴加热1 h,冷却至室温,用0.1 mol/L磷酸氢二钠溶液稀释至刻度,摇匀,即得。同法进行空白试验。
(4)强氧化降解试验:取克拉维酸钾-微晶纤维素(1:1)、阿莫西林克拉维酸钾混粉(2:1)各适量(约相当于克拉维酸7.5 mg),分别置10 mL量瓶中,加水至量瓶容积的70%(保持超声水浴的温度在10℃~15℃),超声使溶解后,加入1%过氧化氢溶液1.0 mL,放置10 min,用水稀释至刻度,摇匀,即得。同法进行空白试验。
(5)高温降解试验:取克拉维酸钾-微晶纤维素(1:1)、阿莫西林克拉维酸钾混粉(2:1)各适量(约相当于克拉维酸7.5 mg),分别置10 mL量瓶中,置烘箱中105℃条件下加热1 h,取出冷却至室温,照“2.2.3”项下配制供试品溶液。
(6)强光降解试验:取在4000 Lx下光照5 d的克拉维酸钾-微晶纤维素(1:1)、阿莫西林克拉维酸钾混粉(2:1)各适量(约相当于克拉维酸7.5 mg),照“2.2.3”项下配制供试品溶液。
2.5 影响因素试验
(1)高温试验:取29个不同厂家的制剂及参比制剂各适量,去除外包装,分别置开口的称量瓶中,40℃条件下放置10 d,于第5天和第10天取样,照“2.2.3”项下配制供试品溶液。
(2)高湿试验:取29个不同厂家的制剂及参比制剂各适量,去除外包装,分别置开口的称量瓶中,在温度20℃、相对湿度(70%±5%)条件下放置10 d,于第5天和第10天取样,照“2.2.3”项下配制供试品溶液。
(3)光照试验:取29个不同厂家的制剂及参比制剂各适量,去除外包装,分别置开口的称量瓶中,在(4500±500) Lx下光照5和10 d,照“2.2.3”项下配制供试品溶液。
3 结果
3.1 系统适用性试验
检测波长220 nm下,系统适用性溶液(1)的色谱图见图1(A),结果见表2,阿莫西林杂质D1与阿莫西林杂质B的分离度大于1.5,阿莫西林杂质E1与克拉维酸杂质G的分离度大于1.0;检测波长275 nm下,系统适用性溶液(2)的色谱图见图1(B),结果见表3,色谱峰出峰顺序为:克拉维酸杂质A、克拉维酸杂质B、克拉维酸杂质C。
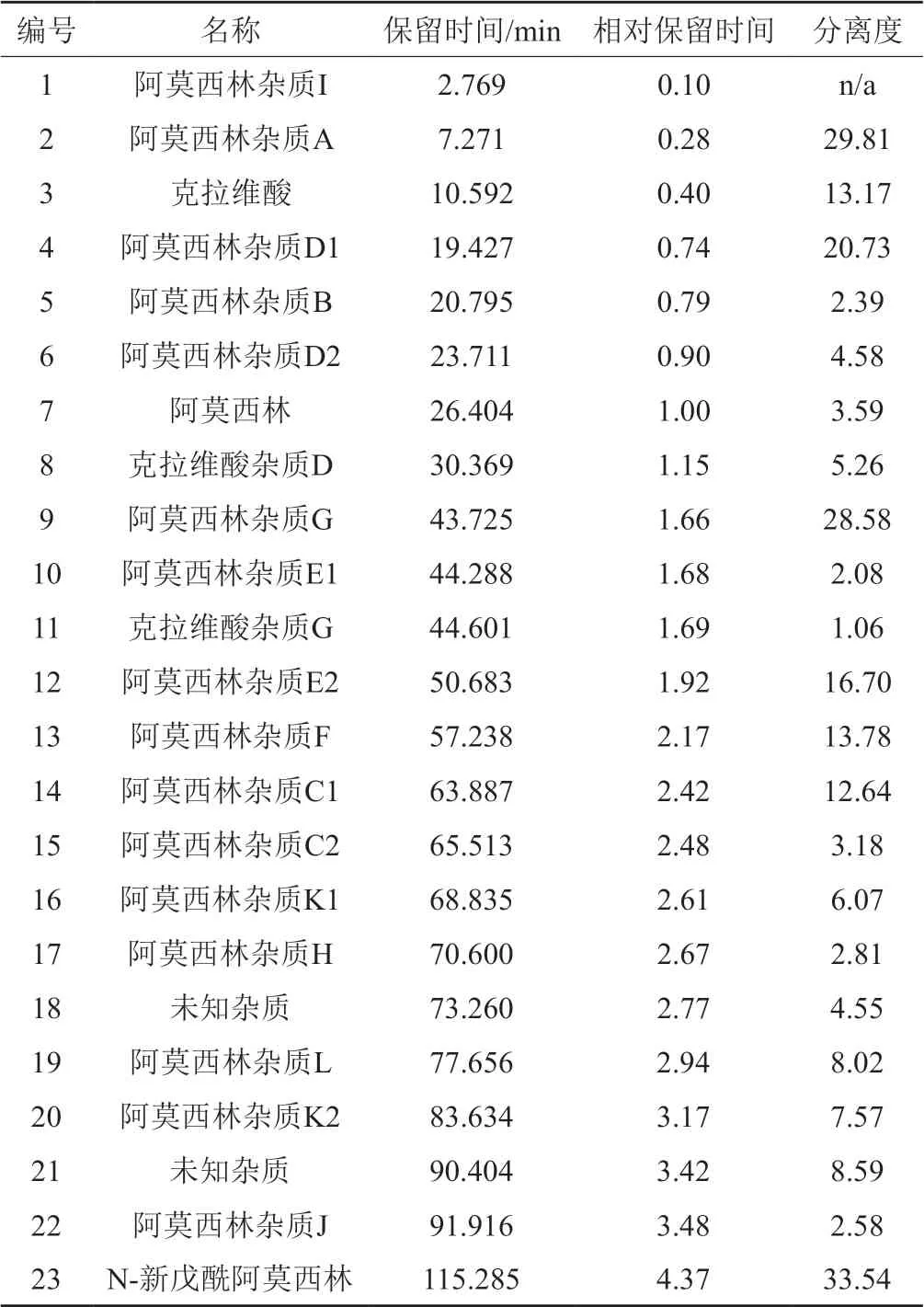
表2 系统适用性溶液(1)测定结果(220 nm)Tab.2 The results of system suitability solution (1)(220 nm)
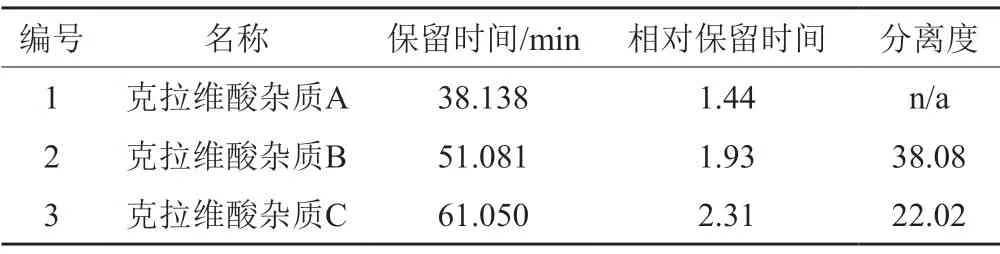
表3 系统适用性溶液(2)测定结果(275 nm)Tab.3 The results of system suitability solution (2)(275 nm)
3.2 克拉维酸钾杂质谱的分析
3.2.1 降解试验
降解试验结果(表4~5)表明,克拉维酸钾对酸、碱、氧化均不稳定,碱性条件主要降解产生杂质A、杂质B、杂质C与杂质D,酸性条件和氧化条件主要产生其他未知杂质;阿莫西林对酸、碱及氧化均不稳定,主要降解产生杂质C、杂质D、杂质E、杂质F、杂质J、杂质K。降解试验典型色谱图见图2。
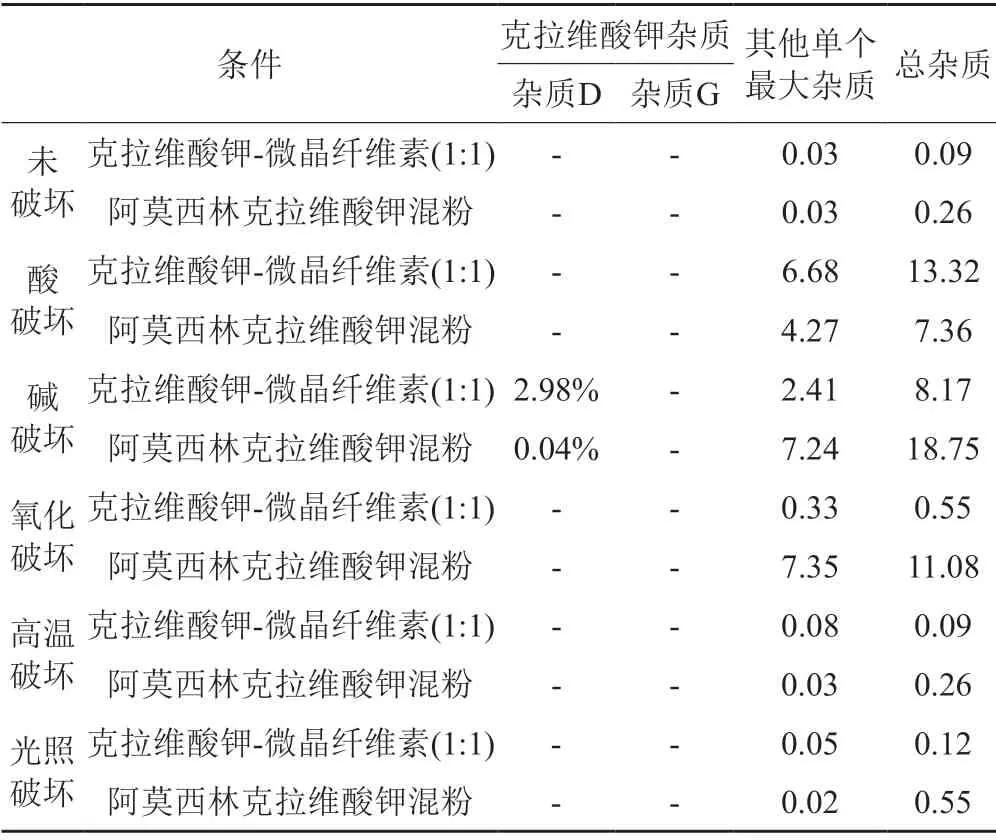
表4 克拉维酸钾的杂质谱分析(220 nm)Tab.4 The results of the impurity profile of potassium clavulanate(220 nm)
3.2.2 影响因素试验
结果表明,在高温和高湿条件下,参比制剂与国内仿制产品的阿莫西林和克拉维酸钾均不稳定,特别是高湿条件,典型色谱图见图3,克拉维酸钾非常容易降解。在220 nm下,主要检出阿莫西林的降解杂质为阿莫西林杂质C、杂质D、杂质E、杂质F和杂质K;在275 nm下,主要检出克拉维酸钾的降解杂质为克拉维酸钾杂质A、杂质B和杂质C。
3.3 水活度与克拉维酸钾杂质的相关性研究
采用冷镜露点法测定样品水活度,水活度反应了制剂中含自由水的量度值。不同企业水活度测定值与克拉维酸钾的杂质测定结果见图4~7。结果表明,克拉维酸钾杂质的含量与水活度值大小呈正相关,证明水分含量中的自由水是直接影响产品稳定性的关键指标。
4 讨论
4.1 检测波长的选择
本研究对检测波长进行了考察,采用PDA全波长190~400 nm扫描杂质对照品,结果表明:(1)阿莫西林及阿莫西林杂质均在190~300 nm范围内有一定吸收;(2)克拉维酸钾、克拉维酸钾杂质D及克拉维酸钾G均在190~240 nm范围内有一定吸收,且克拉维酸钾在240 nm后基本没有吸收;(3)克拉维酸钾杂质A、克拉维酸钾杂质B及克拉维酸钾杂质C均在210和275 nm处有最大吸收,在220~250 nm吸收很弱;(4)综合各杂质的紫外吸收差异,确定以双波长测定阿莫西林克拉维酸钾杂质,以220 nm检测波长测定阿莫西林杂质及克拉维酸钾杂质D、克拉维酸钾杂质G,以275 nm检测波长测定克拉维酸钾杂质A、克拉维酸钾杂质B、克拉维酸钾杂质C,从而达到一个色谱系统同时测定与控制两个主成分的杂质。
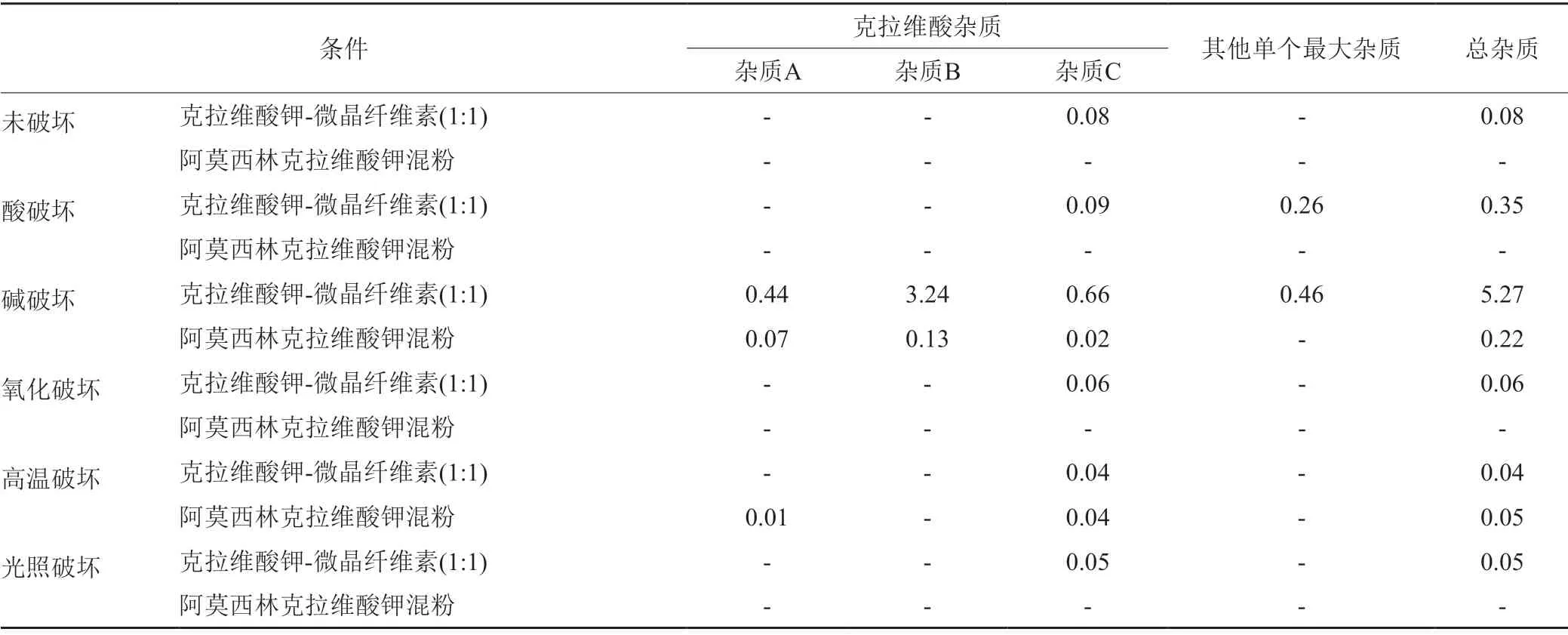
表5 克拉维酸钾的杂质谱分析(275 nm)Tab.5 The results of the impurity profile of potassium clavulanate(275 nm)
4.2 色谱条件的比对
国内外药典仅ChP2020与BP2021复方制剂质量标准中收载了有关物质检测项目,均采用梯度洗脱(梯度时间均约为60 min),但流动相组成及检测波长均不相同(ChP2020为230 nm,BP2021为254 nm),说明国内外药典色谱条件均不能有效控制在220~250 nm吸收很弱的克拉维酸钾杂质A、杂质B及杂质C,存在一定安全性风险的问题。因此,本研究建立了以双波长测定紫外吸收差异较大的各杂质含量,主要优势为:①能同时测定阿莫西林与克拉维酸钾的工艺杂质和降解杂质;②各杂质分离度更好;③测定的杂质个数及杂质总量更高,更能真实反映产品杂质水平。
4.3 克拉维酸钾杂质降解途径
通过对企业调研,发现目前克拉维酸钾合成工艺主要有两种,一种以发酵液中的链霉菌棒状体通过发酵合成克拉维酸叔丁胺,另一种直接以克拉维酸叔丁胺为起始物料。当克拉维酸钾的β-内酰胺环与水或其他亲核基团反应时,酰胺键的水解可能导致β-内酰胺环的开环,β-内酰胺基水解后可能发生一系列反应。降解试验及影响因素结果表明:在酸性条件下,克拉维酸钾主要在220 nm下降解产生未知杂质,主要未知杂质RRT分别为0.28、0.63和1.09;在碱性条件下,在220 nm下产生克拉维酸钾杂质D,在275 nm主要下产生克拉维酸钾杂质A、克拉维酸钾杂质B和克拉维酸钾杂质C;在氧化条件下,主要在220 nm下降解产生未知杂质;高温及高湿条件下,主要降解产生克拉维酸钾杂质A、杂质B和杂质C。结合克拉维酸钾的合成工艺,本研究推测了克拉维酸钾的杂质谱,即克拉维酸钾杂质G是路线一的发酵副产物,并非降解杂质,而杂质A、杂质B、杂质C和杂质D为主要降解杂质。
4.4 水活度与杂质的相关性
克拉维酸钾杂质的含量与水活度值大小呈正相关,说明本品对高湿极为敏感,提示国内生产企业在生产过程中应严格控制环境湿度,选择密封性好、防潮功能强的包装材料,以避免在生产、贮存过程中吸收水,或者避免水活度在不同成分或者包装系统中迁移,以保证产品的持续稳定性。ChP2020规定本品均应在凉暗处干燥保存(遮光并不超过20℃),原研制剂说明书中规定在25℃以下的温度下存放,并存放在原始包装中以防潮,因此建议国内说明书应考虑到开封后的防潮能力和产品质量,以保证产品的安全性。
4.5 小结
目前国内外药典收载的阿莫西林克拉维酸钾复方制剂质量标准均缺失克拉维酸钾杂质的有效控制方法,而本品存在稳定性差、极容易降解产生杂质的问题,现行标准不能满足本品的有关物质检查,导致产品质量不可控,容易引起安全性风险。本研究建立了以双波长同时测定阿莫西林及克拉维酸钾杂质的HPLC方法,该方法灵敏度高,分离效果好,能同时测定两个活性成分的工艺杂质和降解杂质,并且能对两个活性成分引入的杂质分别进行归属与控制。本研究中克拉维酸钾在酸性及氧化条件下产生的较大未知杂质还有待进一步研究。
